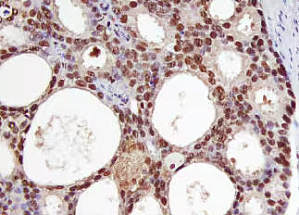
所有用于免疫组化/免疫细胞化学实验的样本都必须进行固定,以保持组织形态并保留靶分子的抗原性。固定会改变组织的化学成分,通常需要在保持组织结构和保留抗原表位之间做出权衡。细胞或组织固定不完全(固定不足)可能导致组织内靶蛋白快速蛋白水解降解,从而降低特异性免疫反应性。
表位被掩盖的原因可能是表位内氨基酸的交联、表位附近或位点无关肽段的交联、表位构象的改变或抗原静电荷的改变。抗原修复是指任何能够逆转表位掩盖并恢复表位-抗体结合的技术。
1、研究中该如何选择 AAV 血清型和剂量? 您可以在我们的血清型选择指南中找到所有血清型和组织趋向性的介绍。2、重组 AAV 是复制缺陷的吗?对于野生型 AAV,如果没有辅助病毒(如腺病毒)的存在,其复制效率极低。对于现在生产的重组 AAV,复制和衣壳基因是在 Rep/Cap 质粒中提供的。只有 AAV 基因组的两个 ITR(倒置末端重复序列)被保留并包装成病毒颗粒,而所需的腺病毒基因要么是由腺病毒提供的,要么是由另一个质粒提供的。理论上,重组 AAV 是不可能复制的。3、AAV 病毒载体表达目的基因效果差,可能是什么原因?可能的原因解决方案AAV 血清型靶向特异性不足测试不同的 AAV 血清型对靶标组织/细胞的特异性;通过基因工程修饰 AAV 的衣壳蛋白,改进 AAV 的靶向性病毒量不够做预实验进行最佳感染剂量探索,确保使用适量的病毒启动子选择不当,目的基因表达量低优化启动子选择,根据目标细胞类型选择合适的启动子mRNA 翻译效率低增加 IRES 或其他元件来增强翻译效率;调整目的基因的序列以优化其 mRNA 结构,增加翻译效率 4、AAV(带荧光标记)体内感染后检测不到荧光或者荧
AAV 在神经退行性疾病模型中的建立及应用
AAV 在新型血清型筛选中的应用现状
AAV 在神经科学研究中的应用
小派课堂第三期-AAV的生活周期-感染方式
小派课堂第二期-AAV 有哪些血清型?
小派课堂第一期-什么是 AAV?
腺相关病毒(AAV)助力心脏研究与治疗
遗传性眼病是一类由于基因缺陷而导致的疾病,目前已报道大约有 200 种遗传性眼病和超过 400 种具有眼部表现的系统性疾 病。遗传性眼病引起的视觉功能丧失通常很难通过传统的手术、激光治疗和局部药物治疗来治愈。基因治疗已成为治疗这类疾 病最重要的手段。腺相关病毒(AAV)由于具有安全性好、免疫原性低、表达时间长、有多种组织和细胞特异性血清型可选 择、高稳定性等优势,已被广泛应用于眼科疾病基因治疗。首款获批上市的遗传性视网膜疾病基因治疗药物 Luxturna(约 85 万 美元/剂)采用了 AAV2 作为递送载体。派真生物能为您提供从研究至 GMP 级别的多种 AAV 血清型载体,助力眼科疾病基因治疗。AAV 眼科基因治疗策略1、基因替代(Gene Replacement):原理:将功能正常的目的基因的 CDS 序列由 AAV转导到细胞内,并在载体上启动子的作用下转录表达应用场景:隐性单基因疾病应用案例精选适应症:双等位基因 RPE65 突变相关视网膜营养不良病毒载体:AAV2-hRPE65v2注射方式:视网膜下注射,1.5×10^11 vg/ 眼,0.3 ml2、基因编辑(Gene Ed
心脏研究中常用的 AAV 血清型天然的 AAV 血清型中,AAV1、AAV6、AAV8、AAV9、AAVrh.10 和 AAVrh.74 对心脏有较好的感染效率,其中:小鼠静脉或心肌注射:AAV9 > AAV8 > AAV6 > AAV1 > AAV2(图 3-5)大动物心肌注射:AAV6 ≥ AAV1 > AAV9(图 6)小鼠体内:AAV9 > AAVrh.74 ≥ AAVrh.10(图 7)图 3. 五种 AAV 血清型在小鼠体内的心脏基因递送效率比较。注射方式为颈静脉注射,病毒注射总量为 1×10^11 vg/小鼠。Luc 的表达由 cTnT 启动子控制。(DOI: 10.1038/gt.2010.105)图 4. 五种 AAV 血清型在小鼠体内的心脏基因递送效率比较。注射方式为左心室前壁注射,病毒注射总量为 5×10^10 vg/小鼠,体积为 10μL。Luc 的表达由 cTnT 启 动子控制。(DOI:10.1002/jgm.1576)图 5. 五种 AAV 血清型以不同剂量注射至小鼠体内的心脏基因递送效率比较。注射方式为颈静脉注射。EG
肾脏疾病是威胁人类健康的主要疾病之一,全球约有 13% 人口受其影响。目前对肾脏疾病的干预措施包括透析和肾脏移植,这些措施的效果或可用性有限,并且通常会引起各种并发症如心血管疾病和免疫抑制等。因此,迫切需要为肾脏疾病开发新的治疗方法。值得注意的是,高达 30% 的肾脏疾病病例是由单基因疾病引起的,故基因药物治疗可能对此有所帮助;但由于肾脏结构和功能的复杂性,针对肾脏疾病的基因治疗的研究和开发滞后于肝脏、神经肌肉和眼睛等,目前还没有任何一种针对肾脏的基因治疗药物获批上市。AAV 是目前体内基因治疗最合适的载体,已有研究人员利用 AAV 进行体内外肾脏的基因递送研究,并取得一定的成果。我们相信如何用 AAV 靶向肾脏是部分老师关心的重点问题。本文将详细介绍肾脏研究中针对不同细胞,如何选择不同的血清型和启动子,以及 AAV 导入肾脏的方式,希望能够帮助从事相关研究的老师获得有用的实验信息,节约宝贵的时间。案例一、AAV 基因疗法治疗由 NPHS2 基因突变引起的肾病综合征[1]足细胞是肾脏中的一种细胞类型,其基因突变(如 NPHS2 基因)是儿童遗传性肾病综合征的常见原因。这篇文章旨在探索用
rAAV 在神经科学研究中的应用方向rAAV 血清型的选择01 用于神经元示踪的血清型⸺AAV2-retro、AAV1、AAV9使用 AAV 精确标记神经回路需要考虑可逆性,包括神经元的顺行和逆行标记,以及是否跨突触(图 2)。目前,只有两种血清型可 以用于神经元顺行标记,即 AAV1(图 3)和 AAV9,高滴度的 AAV9 可顺向跨突触。唯一可用于逆行标记是 AAV2-retro(图 4)。图 2 AAV 等工具病毒在神经环路示踪应用中的传播方向和层级 [Neurosci Bull,2020, 36(3):199‒201]图 3 AAV1 顺向跨突触标记 [J Neurosci,2020,Apr 15;40(16):3250-3267]图 4 rAAV2-retro 逆行非跨突触标记 [Neuron, 2016, 92(2):372-382]可跨血脑屏障的 AAV 血清型⸺AAV-PHP.S、AAV-PHP.B、AAV-PHP.eB、PG008、AAV9P801、VCAP-101、VCAP-102血脑屏障(BBB)的存在对中枢神经系统(CNS)具有强大的保护作用,但它也可能阻碍药物
目前慢病毒载体主要应用在以下几个方面:细胞基因治疗(截止目前,已上市的 CAR-T 产品有 9 款采用了慢病毒载体递送 CAR 基因)基因表达调控(过表达、RNA 干扰研究等)基因编辑(CRlSPR/Cas9 gRNA 文库筛选、基因敲除、敲入、点突变、基因激活/抑制)稳转细胞株构建活体细胞成像追踪转基因动物图 1 慢病毒载体的主要应用方向应用案例案例 1:用慢病毒载体进行基因过表达,构建稳转细胞株,研究葡萄糖激酶在前列腺癌(PCa)中的作用[1]细胞代谢在肿瘤进展中起着关键作用,靶向癌症代谢可能有效地杀死癌细胞。本文旨在研究葡萄糖激酶在前列腺癌中的作用,并确定 PCa 治疗的关键靶点。实验设计和主要研究结果:癌症基因组图谱(TCGA)数据库和在线工具评估结果显示 ADP 依赖型葡萄糖激酶(ADPGK)是唯一一种在前列腺腺癌(PRAD)中上调并预测较差总生存(OS)的葡萄糖激酶。临床样本分析显示,与非 PCa 组织相比,ADPGK 在 PCa 组织中显著上调。ADPGK 过表达促进了 PCa 细胞的增殖和迁移,而敲低 ADPGK 则抑制了恶性表型。代谢组学、蛋白质组学以及 ECAR 和
腺相关病毒在骨科研究中的应用现状腺相关病毒(AAV)属于细小病毒科,病毒颗粒无包膜,结构为直径约 20-26nm 的正二十面体,是迄今发现的一类结构最简单且无法自主复制的线性单链 DNA 病毒,对分裂细胞和非分裂细胞均具有感染力。在研究中常用的重组腺 相关病毒(rAAV)是在非致病性野生型 AAV 的基础上经过改造而成的特异性更强的基因载体,其感染后约 3 周可达 表达高峰。自互补 AAV(scAAV) 是一种经过特殊设计的 AAV,在感染细胞后可以迅速形成双链 DNA,从而绕过了传统 AAV(ssAAV)需要宿主细胞 DNA 聚合酶合成第二条链的步骤,加快了基因表达的启动时间,scAAV 感染后 3-5 天达 到表达高峰。因致病性低、可在分裂及非分裂细胞中实现持久表达等优势,AAV 已成为骨科领域基因递送的首选载体之一。AAV 可在软骨、骨、肌腱乃至滑膜组织中实现高效转导,并支持局部长期表达,为创伤修复及骨关节退行性疾病提供了 新的干预思路。目前,针对骨关节炎、类风湿关节炎、罕见骨骼疾病、软骨修复与再生等的 AAV 基因疗法取得了显著进展,多项临床 前研究和临床试验 (图 2,表 1
在肝脏中应用较多的有 AAV1、AAV2、AAV3、AAV5、AAV8 及 AAV-DJ 等血清型:Mouse:AAV8、AAV-DJ 对 mouse 肝脏均具有较强的亲嗜性,其中 AAV8 嗜肝性更强,用于活体动物注射表现为免疫原性低, 感染效率高;AAV-DJ 的体内肝细胞转导效率与 AAV8 相近,且在体外实验中也能表现出较强的感染效率。Rat:AAV1、AAV2 对 rat 肝脏均具有较强的亲嗜性,AAV8 并不推荐,因为感染效率并不优秀。注意事项:① 小鼠的品系与性别会影响到感染效率,一般会选择雄性小鼠做实验。② AAV2/3B 载体对人肝脏的感染效率明显,对 NHPS 也有效,但不能有效地转导 MOUSE 肝脏。AAV 在肝脏应用中的局限及解决方式肝细胞的自我更新会稀释体内 AAV 导致降低转导效率重新注射新的血清型使用药物阻断免疫应答重新注射同种血清型AAV 基因整合到小鼠基因组上体内预存的抗 AAV 中和抗体降低转导效率实验前做中和抗体预筛,选择无中和抗体的小鼠使用不同的血清型进行小鼠实验预先处理小鼠来抑制其免疫应答再进行小鼠实验AAV 载体包装能力有限性大基因片段分两
案例精选:2021 年 7 月,复旦大学附属中山医院肺重 症医学科在 Respiratory Research 上发是 表题为:SERPINB10 contributes to asthma by inbibiting the apoptosis of allergenic Th2 cells 的研究论文。 该研究表明,辅助型 T 细胞 2 (Th2) 及其分 泌的细胞因子与哮喘发病机制密切相关, 丝氨酸蛋白抑制剂家族成员 SERPINB10 与 哮喘的过敏性炎症有关,本研究,作者通 过抑制小鼠 SERPINB10 基因表达。发现屋 尘螨 HDM 诱导的气道炎症和 Th2 反应有所 缓解,HDM 诱导的 Th2 细胞因子分泌和 HDM 特异性 IgE 水平显著降低,且诱导了 Th2 的凋亡增加。血清型:AAV6注射方式:气管内注射病毒滴度:6.32x1012 vp/ml 30 μl靶向部位:肺动物模型:6-8 周龄 C57BL/6J 雌性小鼠2019 年 2 月,上海交通大学医学院附属上 海总医院重症医学科在 Cell Death and Disease 上发是表题为:circHIPK
机体在抗原物质刺激下,由B细胞分化成的浆细胞所产生的、可与相应抗原发生特异性结合反应的免疫球蛋白。因为最初有人用电泳证明血清中抗体活性在γ球蛋白部分,故曾把抗体统称为两种(γ)球蛋白。后来证明,抗体并不都在γ区;而且位于γ区的球蛋白,也不一定都具有抗体活性。1964年,世界卫生组织举行专门会议,将具有抗体活性以及与抗体相关的球蛋白统称为免疫球蛋白(Ig)。如骨髓瘤蛋白,巨球蛋白血症、冷球蛋白 ...
操作演示