AAV 在神经科学研究中的应用策略
派真生物
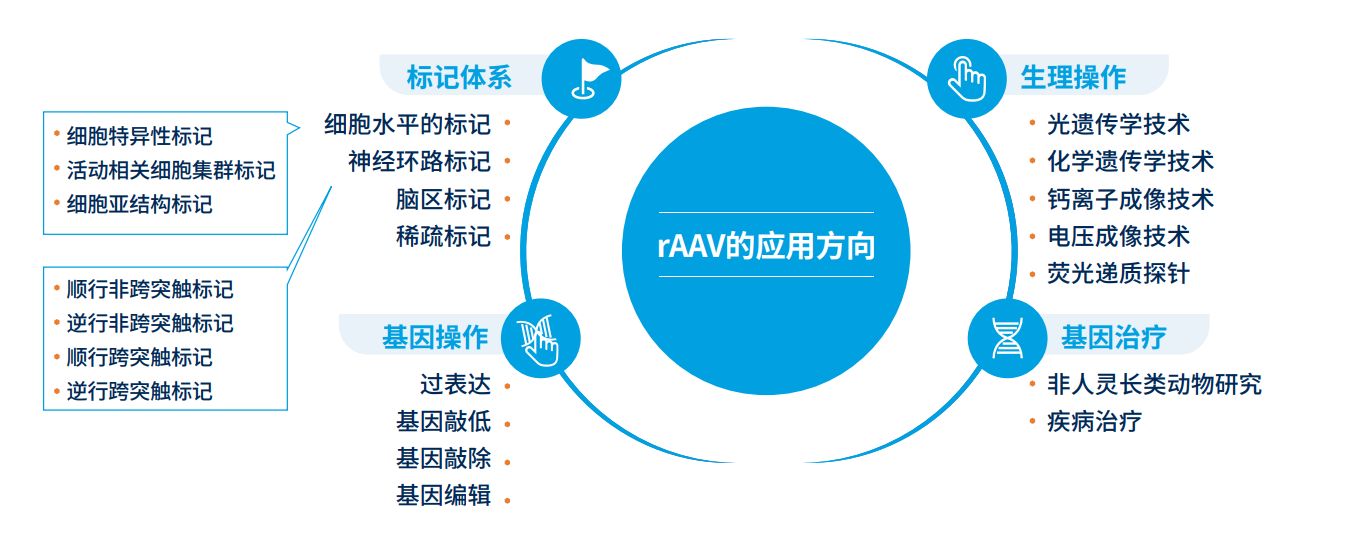
rAAV 在神经科学研究中的应用方向
rAAV 血清型的选择
01 用于神经元示踪的血清型⸺AAV2-retro、AAV1、AAV9
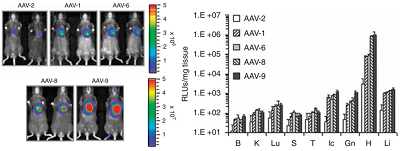
使用 AAV 精确标记神经回路需要考虑可逆性,包括神经元的顺行和逆行标记,以及是否跨突触(图 2)。目前,只有两种血清型可 以用于神经元顺行标记,即 AAV1(图 3)和 AAV9,高滴度的 AAV9 可顺向跨突触。唯一可用于逆行标记是 AAV2-retro(图 4)。
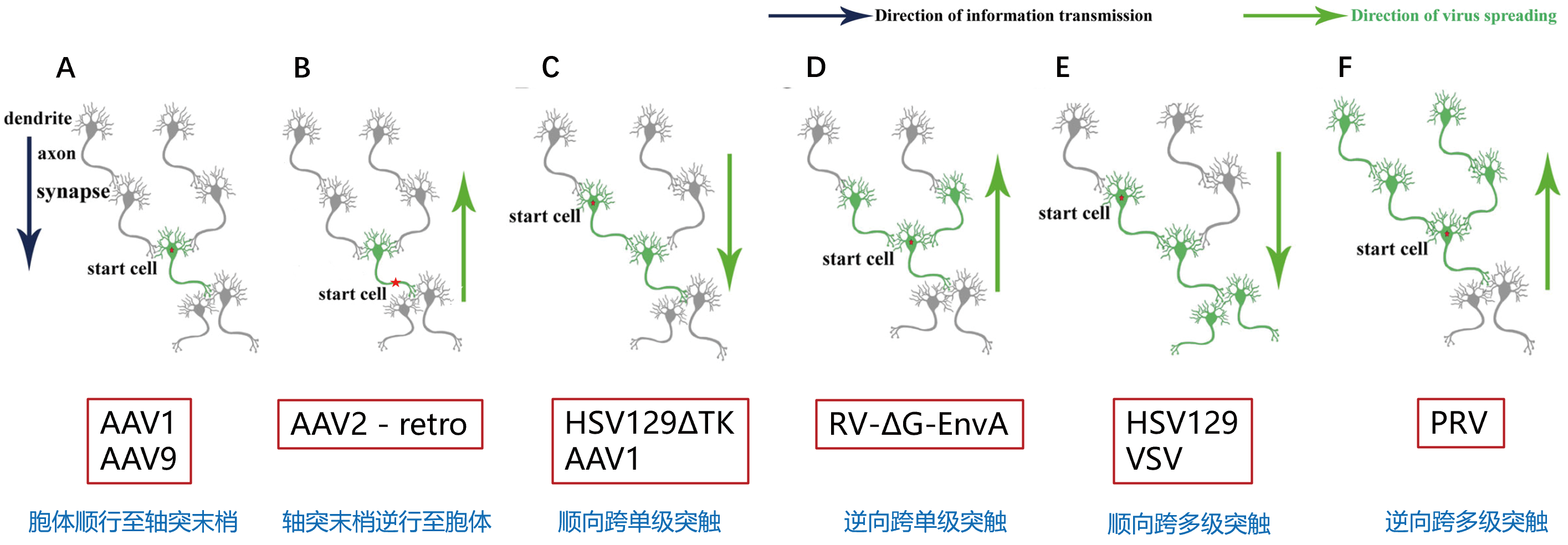
图 2 AAV 等工具病毒在神经环路示踪应用中的传播方向和层级 [Neurosci Bull,2020, 36(3):199‒201]
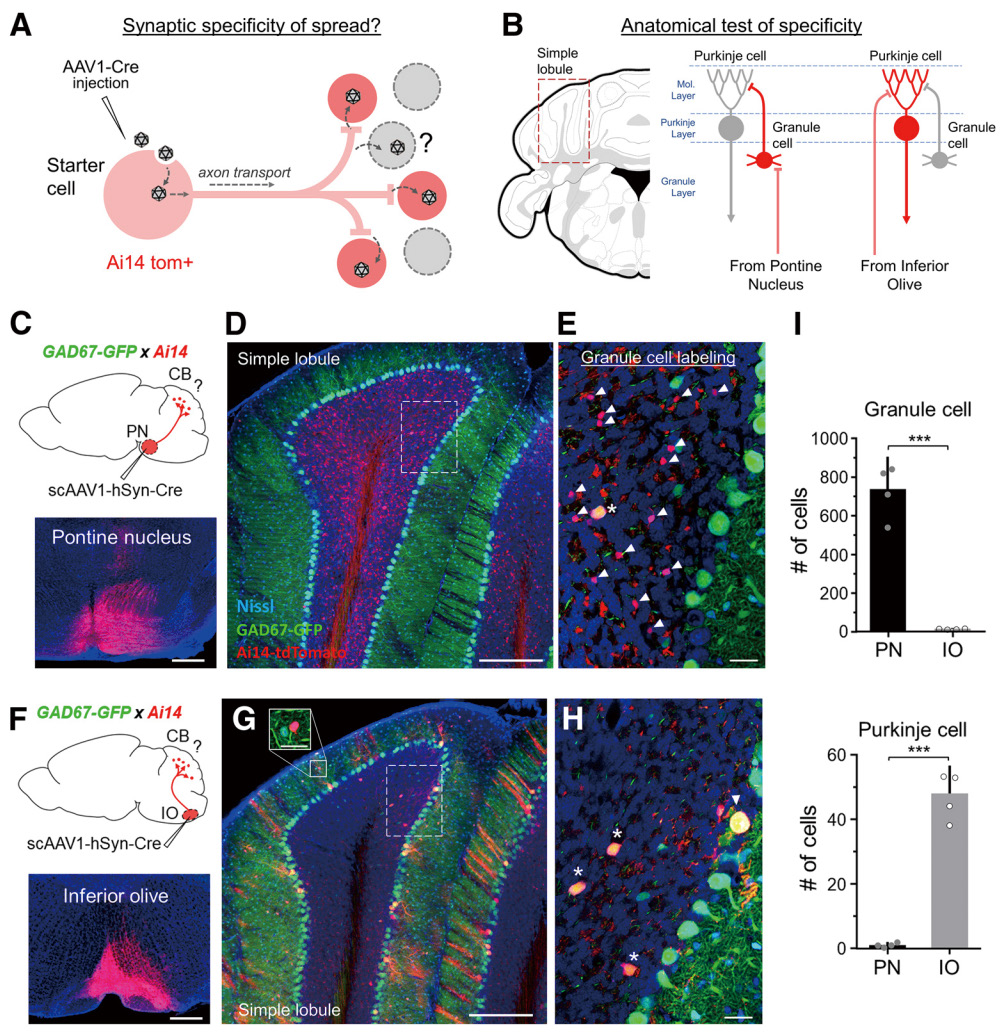
图 3 AAV1 顺向跨突触标记 [J Neurosci,2020,Apr 15;40(16):3250-3267]
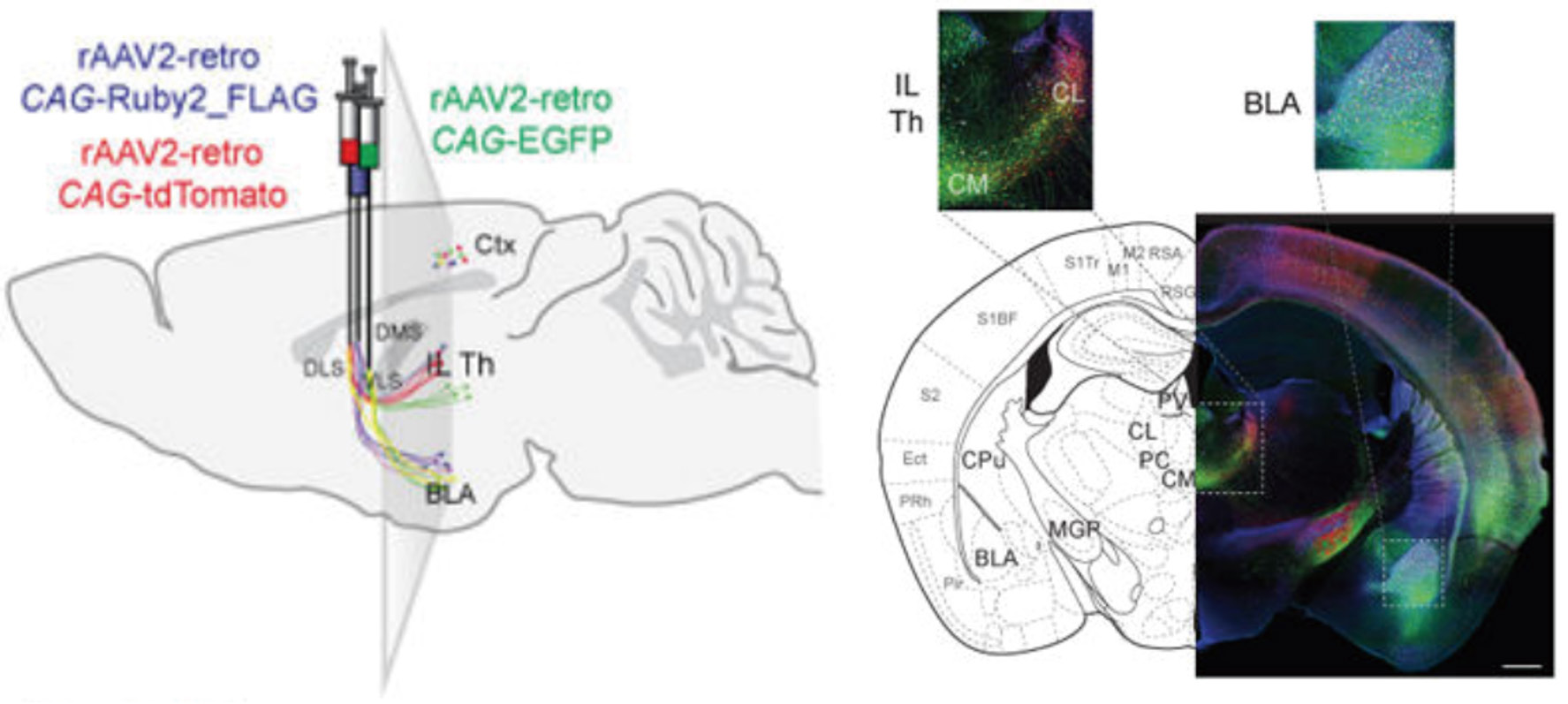
图 4 rAAV2-retro 逆行非跨突触标记 [Neuron, 2016, 92(2):372-382]
可跨血脑屏障的 AAV 血清型⸺AAV-PHP.S、AAV-PHP.B、AAV-PHP.eB、PG008、AAV9P801、VCAP-101、VCAP-102
血脑屏障(BBB)的存在对中枢神经系统(CNS)具有强大的保护作用,但它也可能阻碍药物的传输和吸收。AAV9、AAVPHP.B、 AAVPHP.eB、AAVPHP.S、AAV9P801 等血清型能够有效介导基因从外围向 CNS 的转移,然后将遗传物质递送到大脑或脊髓。 2017 年,Gradinaru 团队通过 CREATE 筛选技术,开发了两种新型 AAV 衣壳变体:AAV-PHP.eB(用于中枢神经系统)和 AAV-PHP.S(用于外周神经系统)(图 5)。AAV-PHP.eB 在 AAV-PHP.B 基础上进化而来,在低剂量(1×10¹¹ vg)下,可高效转导大 脑皮层、纹状体、小脑 Purkinje 细胞等 CNS 神经元,转导率高达 69%(皮层)和 76%(Purkinje 细胞),比 AAV-PHP.B 效率提升 2.5 倍以上。 AAV-PHP.S 基于 AAV9 进化,可高效转导背根神经节(DRG)、心脏神经节、肠道神经系统(ENS)等 PNS 神经元,DRG 神经元转导 率高达 82%。
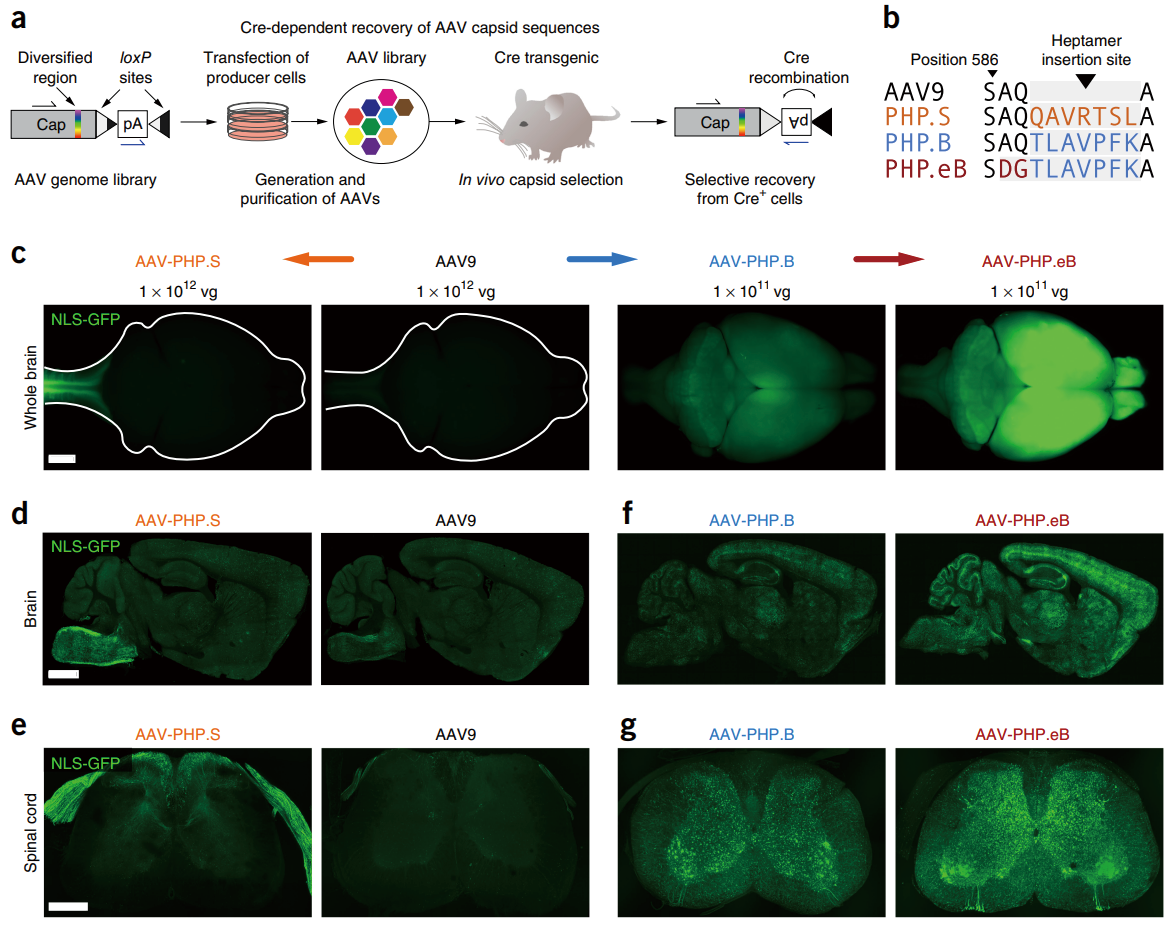
图 5 AAVPHP.B、AAVPHP.eB、AAVPHP.S 可实现外周和中枢神经系统的转导 [Nat Neurosci, 2017, 20(8): 1172-1179]
派真生物基于自主研发的π-Icosa 血清型筛选平台,通过在 AAV9 衣壳中随机插入肽段构建 AAV 衣壳变体库,经过多轮动物体 内筛选,获得了比 AAV-PHP.eB 更高效的血清型—PG008,已被证实在小鼠中可以穿透血脑屏障,靶向神经元细胞、星形胶质细 胞、小胶质细胞,且肝脏毒性较小(图 6)。

图 6 AAV-PG008 可有效穿透血脑屏障,靶向中枢神经系统 [Cell & Gene Therapy Insights, 2024; 10(11): 1413‒1429]
研究人员发现,很多 AAV 变体(如 AAV-PHP.eB)虽然在小鼠中表现优异,但是无法应用到灵长类动物等大型动物模型。这种物 种差异性严重限制了在小鼠中筛选得到的 AAV 变体向临床应用的转化。因此,直接在与人更近的非人灵长类体内做定向进化 筛选,成了提高临床可转化性的关键路径。 AAV9P801 是 Voyager Therapeutics 通过 TRACER™(Translationally Optimized Capsid Evolution via RNA)平台开发的新 型 AAV 衣壳变体。在灵长类动物中,AAV9P801 表现出显著优于 AAV9 的中枢神经系统转导能力,在脑干、丘脑、苍白球和纹状 体等区域显示出强烈的神经转导特性。在剂量为 2 x 1012 vg/kg 的低剂量下,AAV9P801 实现了超生理水平的转基因表达,而 AAV9 达到相同表达水平需要更高剂量。同时,AAV9P801 在低剂量下表现出显著的肝脏去靶向性,减少了潜在的肝脏副作用(图 7)。

图 7 AAV9P801 表现出显著优于 AAV9 的中枢神经系统转导能力和肝脏去靶向性 (Voyager-ASGCT-2023)
随后,Voyager Therapeutics 又通过在食蟹猴体内进行 AAV9 衣壳的定向进化筛选,获得了两个高性能变体:VCAP-101 和 VCAP-102。令人惊喜的是,这两个在灵长类动物中筛选出的变体,在小鼠中同样展现出优异的血脑屏障穿透能力(图 8)。
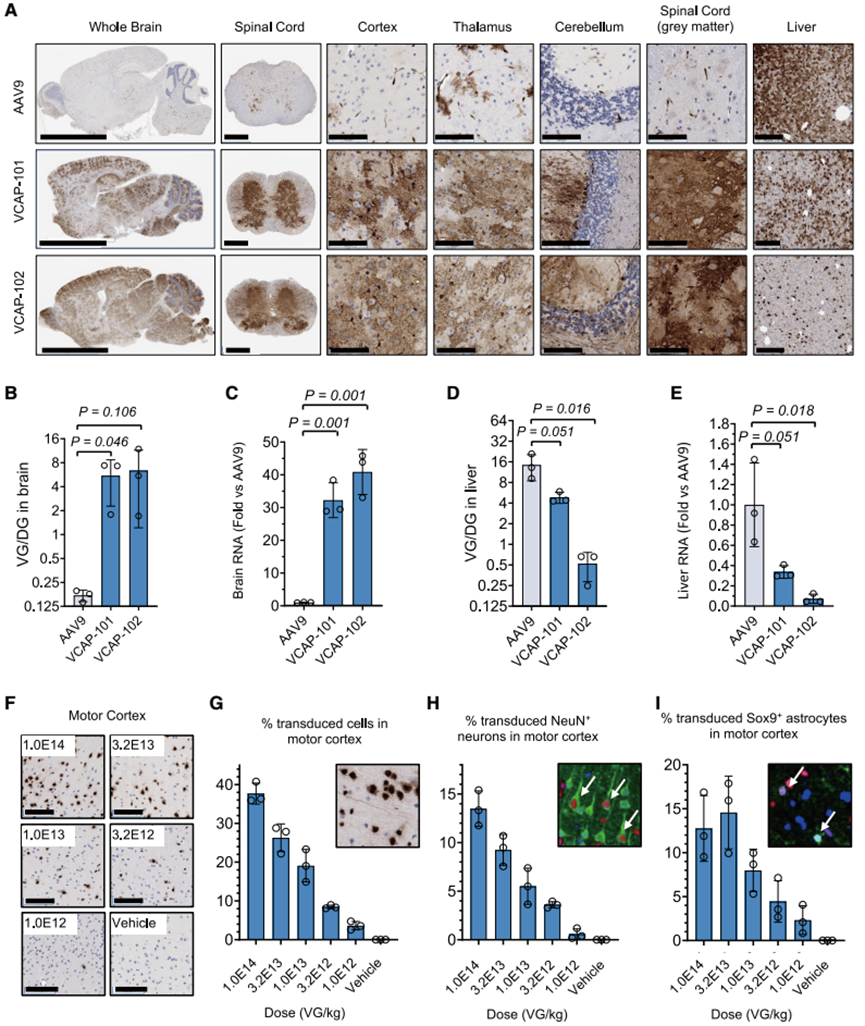
图 8 VCAP-101 和 VCAP-102 在小鼠脑部表现出更强的中枢神经系统靶向性 [Molecular Therapy. 2025;33(8)]
可高效靶向神经元的血清型⸺AAV-EP+
神经元作为中枢神经系统的核心功能单元,负责信息处理、传递和存储,是维持认知、运动和感觉功能的基础。随着阿尔茨海默 病、帕金森病、亨廷顿病等神经退行性疾病发病率的不断上升,神经元已成为基因治疗领域的重要靶点。然而,针对大脑神经元 的基因递送面临着独特的挑战:血脑屏障的严密保护、神经元亚型的高度异质性、以及对外源载体的敏感性都限制了传统基因 治疗载体的应用效果。传统 AAV 血清型在跨越血脑屏障和实现神经元特异性转导方面存在效率低、脱靶效应明显等问题。 2025 年 5 月,来自美国宾夕法尼亚大学和俄亥俄州立大学的研究团队通过非人灵长类动物 (NHP) 筛选,成功开发出 AAV-EP+衣 壳变体,对室管膜细胞的转导效率比其亲本 AAV1 高 22 倍,能够广泛转导大脑皮质神经元和深层脑区,在整个脑室系统中实现 均匀分布。AAV-EP+在三种非人灵长类动物(恒河猴、非洲绿猴、食蟹猴)、两种小鼠品系(C57BL/6 和 FVB)和人源化诱导多能干 细胞(iPSC)衍生神经元中都表现优异。在 NHP 中,AAV-EP+的使用剂量比以往报道低 30 倍以上,达到的蛋白表达水平是正常 人脑脊液的 5-9 倍,大幅提升了治疗的安全窗口。相比传统 AAV9 载体,AAV-EP+展现出更好的安全特征,包括极低的外周组织 转导(肝脏、心脏),背根神经节转导率<3.3%,显著降低的毒性风险(图 9)。
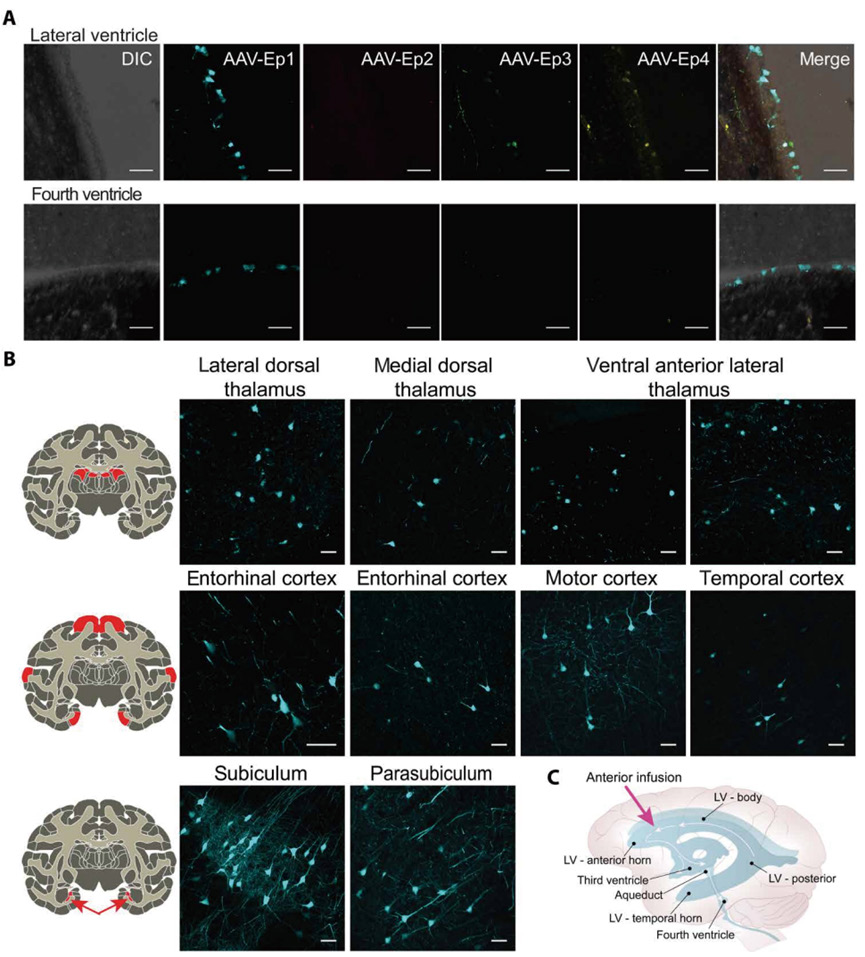
图 9 AAV-Ep+在成年食蟹猴中的感染效果(Sci Transl Med,2025,17, eadr2531)
rAAV 在神经科学研究中的应用案例
实例一:全脑细胞类型特异性稀疏神经元标记方法及其在 Shank3 自闭症小鼠模型中的应用
单个神经元作为大脑的基本单位,由细胞体和突起组成,包括树突和轴突。即使是同一类型的神经元也会展现出各种细微的突起特征,以适应多样的神经回路。不同类型的神经元在大脑中形成了复杂的回路。因此,了解详细的神经元形态对于理解正常的神经功能和病理机制至关重要。本文开发了一种策略,在整个大脑中稀疏标记相同类型的神经元,并在自闭症动物模型⸺Shank3 基因敲除(KO)小鼠中测试了其应用。
| 使用病毒 | AAVPHP.eB-hSyn-DIO-EGFP-P2A-EGFPf |
| 注射方式 | 眼眶后注射 |
| 注射计量 | 病毒滴度1.3E+12 vg/mL,注射体积 100μL |
| 实验动物 | Sst-IRES-Cre 小鼠,Shank3B KO小Shank3+/+:CaMKIIα-Cre 杂合小鼠,Shank3-/-:CaMKIIα-Cre 杂合小鼠,10 周龄 |
主要实验结果
1.将病毒注射到 CaMKIIα-Cre 小鼠中,可以稀疏标记多个大脑区域的投射神经元(图 18A-C)。
2.对 Shank3 KO 小鼠的投射神经元形态进行了分析,发现与同窝对照小鼠相比,Shank3 KO 小鼠在纹状体、皮层和海马体中的 投射神经元表现出不同的树突复杂性和树突棘变化(图 18D-L)。
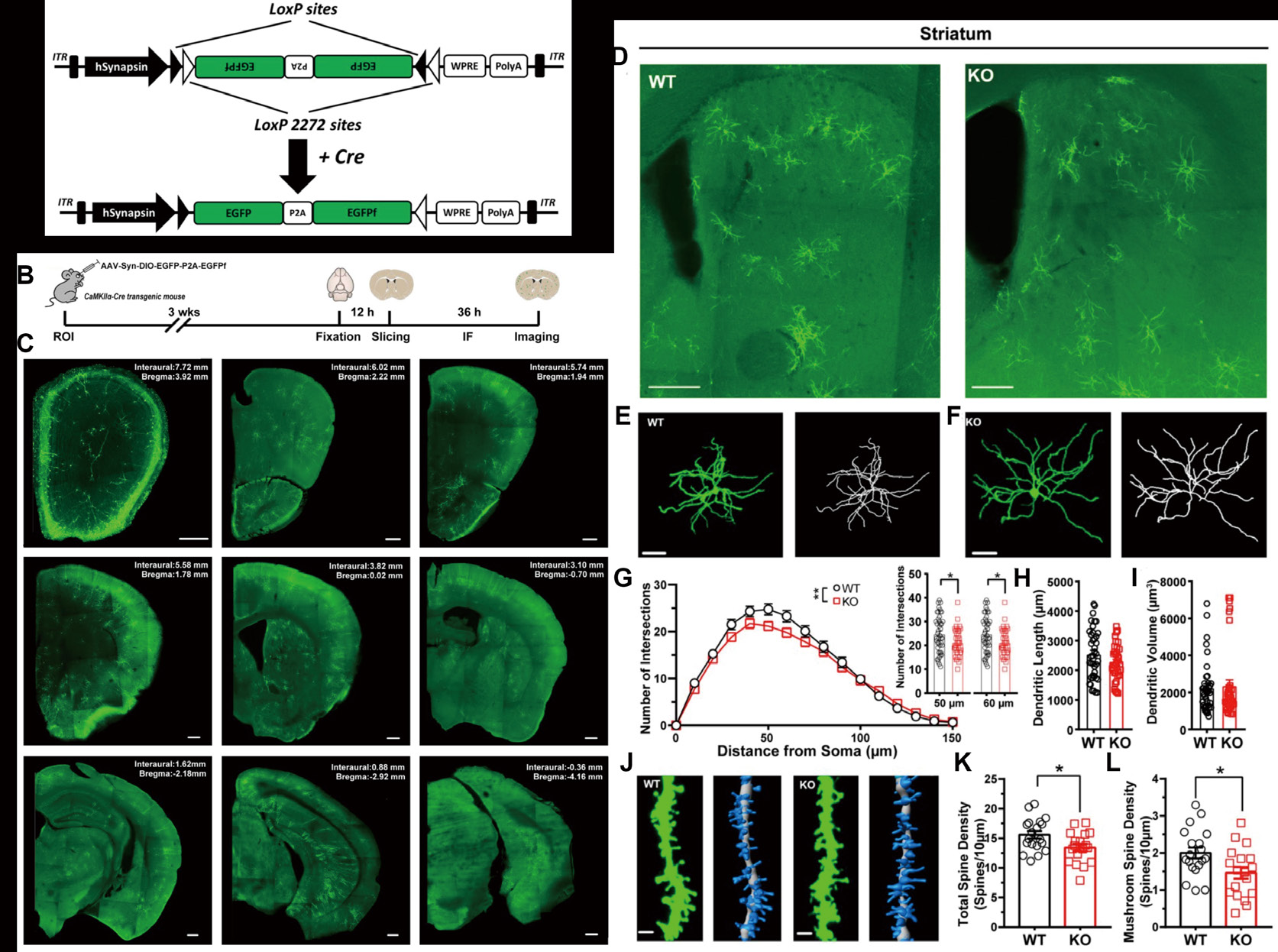
图18 AAV-hSyn-DIO-EGFP-P2A-EGFPf 在小鼠中的标记效果,参考文献:Front Cell Neurosci, 2020, 14:145。
实例二:rAAV 递送基因编辑工具,用于亨廷顿舞蹈症的基因治疗
亨廷顿舞蹈症(Huntington’s disease, HD)是一种常染色体显性遗传的神经退行性疾病,由亨廷顿基因(Huntingtin, HTT)一号外显子区域中的 CAG 重复异常扩增(超过 36 次)所导致。突变 HTT 基因编码的蛋白(mHTT)会发生错误折叠,在细胞内形成聚集体并产生神经毒性。尽管对 HD 发病机制的理解取得了重大进展,但仍然没有有效的治疗方法。
| 使用病毒 | AAV9-mini-cmv-spCas9, AAV9-control-gRNA-RFP,AAV9-HTT-gRNA-RFP-20Q |
| 注射方式 | 脑立体定位注射,耳静脉注射 |
| 注射剂量 |
(1)脑立体定位注射:表达 gRNA 和 Cas9 的病毒以 1:2 的比例混合,将 30μL 的混合病毒(总共 1-1.5E+12vg)注入猪纹状体的两侧(每侧15μL),注射速度 800nL/min (2)耳静脉注射:2E+13 vg/kg 或1.8E+13 vg/ 只 |
| 实验动物 | 三个月大的小猪崽(脑立体定位注射),出生后 3-7 天的小猪仔(耳静脉注射) |
主要实验结果
在大脑或外周静脉中单次注射 AAV9-mini-cmv-spCas9 和 AAV9-HTT-gRNA-RFP-20Q 可以有效减少神经退行性变并改善相关 症状(图 20)。这些发现支持了 CRISPR/Cas9 在治疗 HD 和其他由基因突变引起的人类神经系统疾病方面的进一步转化发展。
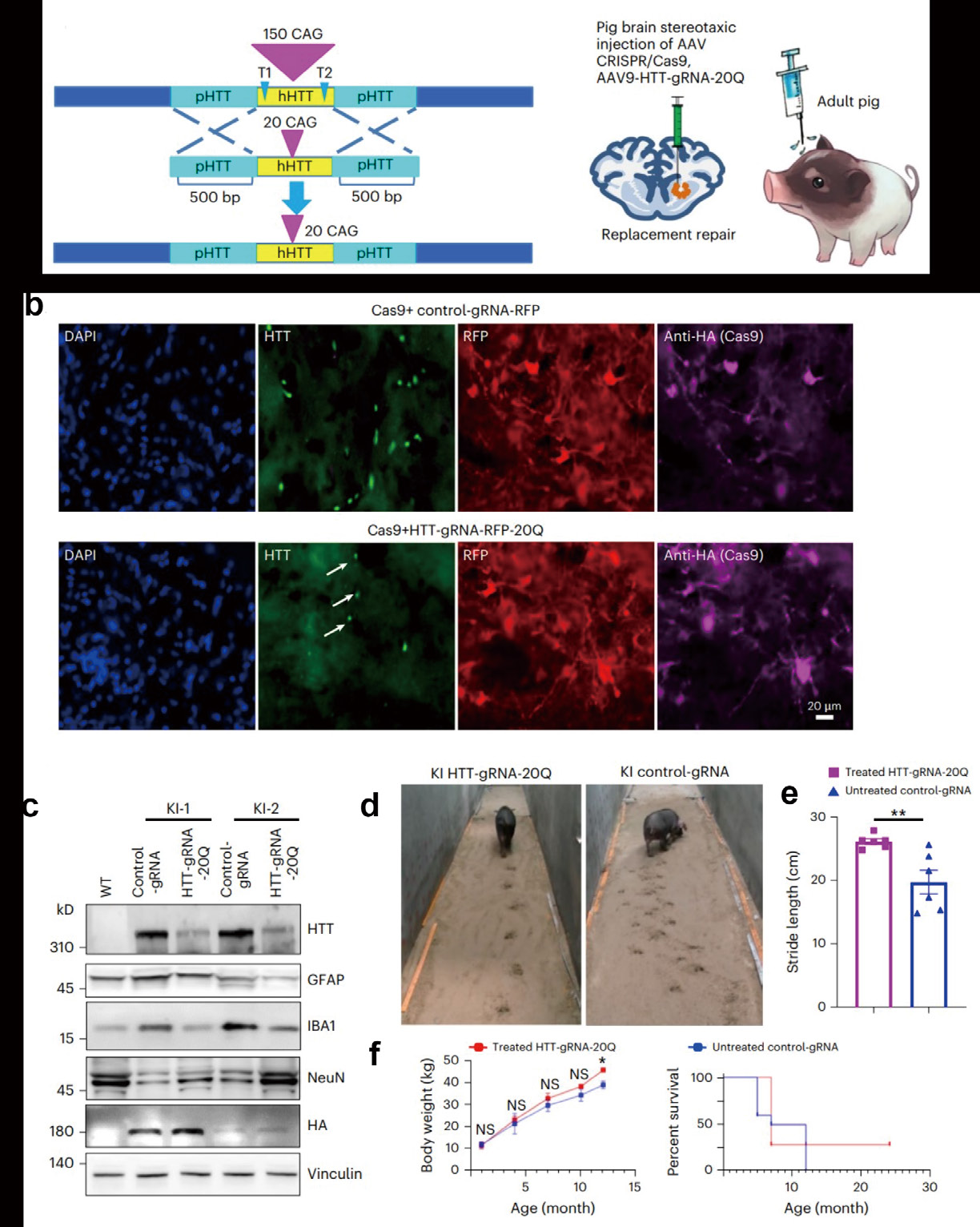
图 20 脑注射 AAV9-mini-cmv-spCas9 和 AAV9-HTT-gRNA-RFP-20Q 对 HD KI 猪的治疗效果,参考文献:Nat Biomed Eng,2023,7:629‒646 。