AAV 在骨科研究中的应用策略
派真生物
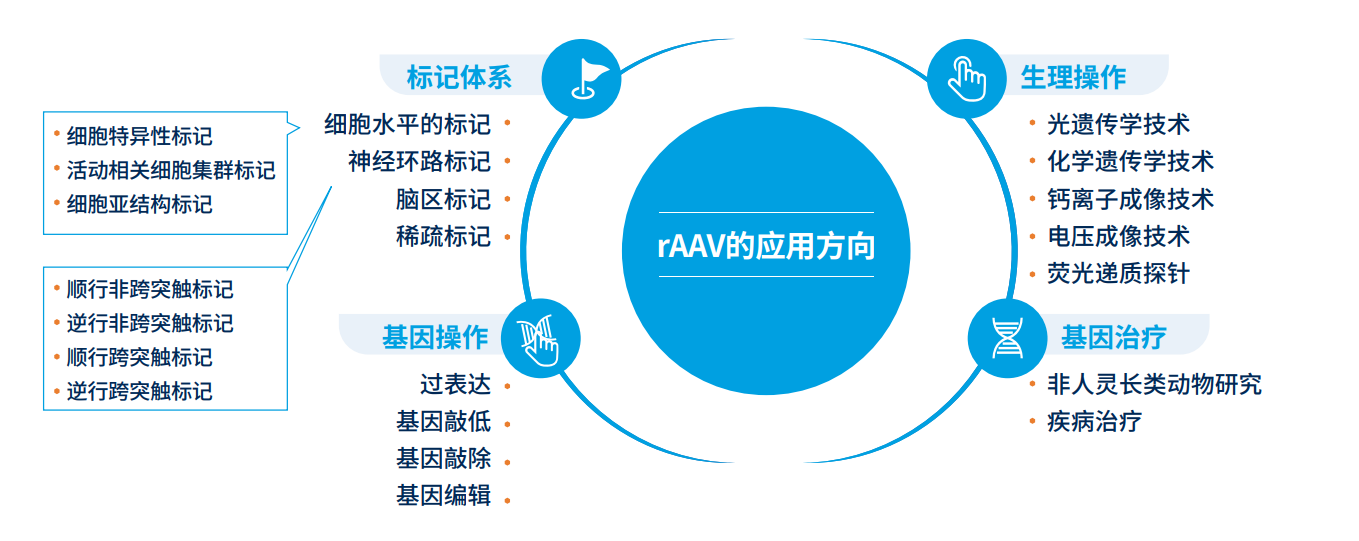
腺相关病毒在骨科研究中的应用现状
腺相关病毒(AAV)属于细小病毒科,病毒颗粒无包膜,结构为直径约 20-26nm 的正二十面体,是迄今发现的一类结构最简单且无法自主复制的线性单链 DNA 病毒,对分裂细胞和非分裂细胞均具有感染力。在研究中常用的重组腺 相关病毒(rAAV)是在非致病性野生型 AAV 的基础上经过改造而成的特异性更强的基因载体,其感染后约 3 周可达 表达高峰。自互补 AAV(scAAV) 是一种经过特殊设计的 AAV,在感染细胞后可以迅速形成双链 DNA,从而绕过了传统 AAV(ssAAV)需要宿主细胞 DNA 聚合酶合成第二条链的步骤,加快了基因表达的启动时间,scAAV 感染后 3-5 天达 到表达高峰。
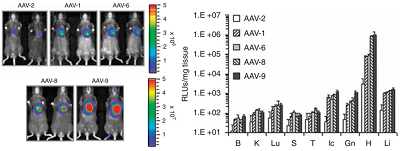
因致病性低、可在分裂及非分裂细胞中实现持久表达等优势,AAV 已成为骨科领域基因递送的首选载体之一。AAV 可在软骨、骨、肌腱乃至滑膜组织中实现高效转导,并支持局部长期表达,为创伤修复及骨关节退行性疾病提供了 新的干预思路。
目前,针对骨关节炎、类风湿关节炎、罕见骨骼疾病、软骨修复与再生等的 AAV 基因疗法取得了显著进展,多项临床 前研究和临床试验 (图 2,表 1) 证实了其安全性和有效性 [1, 2]。
AAV 在骨科研究中的应用案例
应用案例 1:骨关节炎的 AAV 基因治疗[3]

研究背景:骨关节炎(OA)是一种全球性的重大健康问题,目前尚无疾病修饰疗法。白细胞介素-1(IL-1)是与 OA 病 理生理学相关的关键细胞因子,可通过 IL-1 受体拮抗剂(IL-1Ra)抑制。研究团队开发了一种自互补型重组 AAV 载体(sc-rAAV2.5IL-1Ra),用于将 IL-1Ra 基因递送至膝关节。
研究方法:
试验设计:这是一项开放标签、单中心、1 期临床试验,旨在评估 sc-rAAV2.5IL-1Ra 的安全性和耐受性。共招募了 9 名 患有放射学证实的膝关节 OA 患者,按剂量分为低(1×10¹¹ vg)、中(1×10¹² vg)和高(1×10¹³ vg)三个剂量组。
给药方式:通过膝关节内注射 sc-rAAV2.5IL-1Ra,患者接受单次注射,随后进行为期 52 周的随访。
评估指标:主要评估安全性,包括不良事件(AEs)和严重不良事件(SAEs)。次要评估指标包括对生命体征、临床实 验室指标的影响,以及 IL-1Ra 在关节液中的表达水平。
实验结果
安全性:未报告与 sc-rAAV2.5IL-1Ra 相关的 SAEs。两名患者出现可能与载体相关的关节积液和疼痛,但均通过保守 治疗解决。未观察到对生命体征、体格检查或临床实验室指标的影响。
IL-1Ra 表达:所有患者的关节液中 IL-1Ra 浓度均有所增加,并在 1 年后仍保持较高水平。低剂量组患者关节液中 IL-1Ra 浓度增加了约 5 倍,中高剂量组患者的 IL-1Ra 浓度更高(原文图 3)。
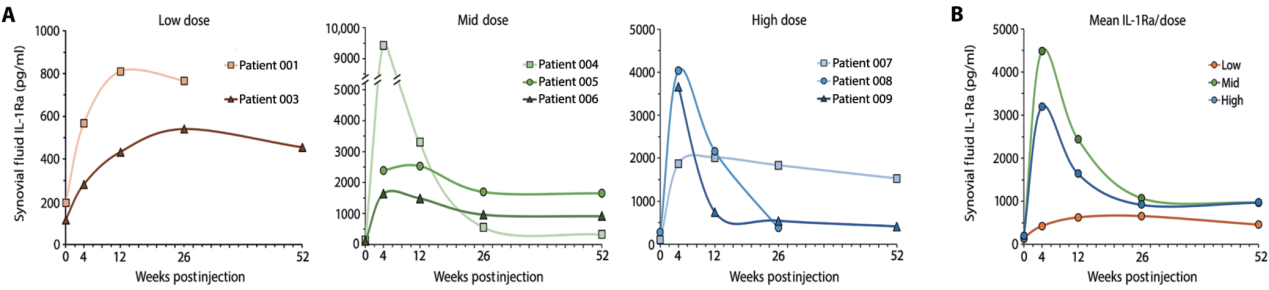
原文图 3. 注射 sc-rAAV2.5IL-1Ra 后,关节穿刺液中 IL-1Ra 浓度随时间的变化。
疼痛和功能改善:患者报告的疼痛和功能评分在研究期间有所改善。低剂量组患者的疼痛改善较为显著,中高剂量 组患者的改善更为持久。
免疫反应:大多数患者在基线时存在低水平的 AAV2.5 中和抗体(NAbs),注射后中和抗体滴度有所上升,但未检测 到细胞介导的免疫反应。
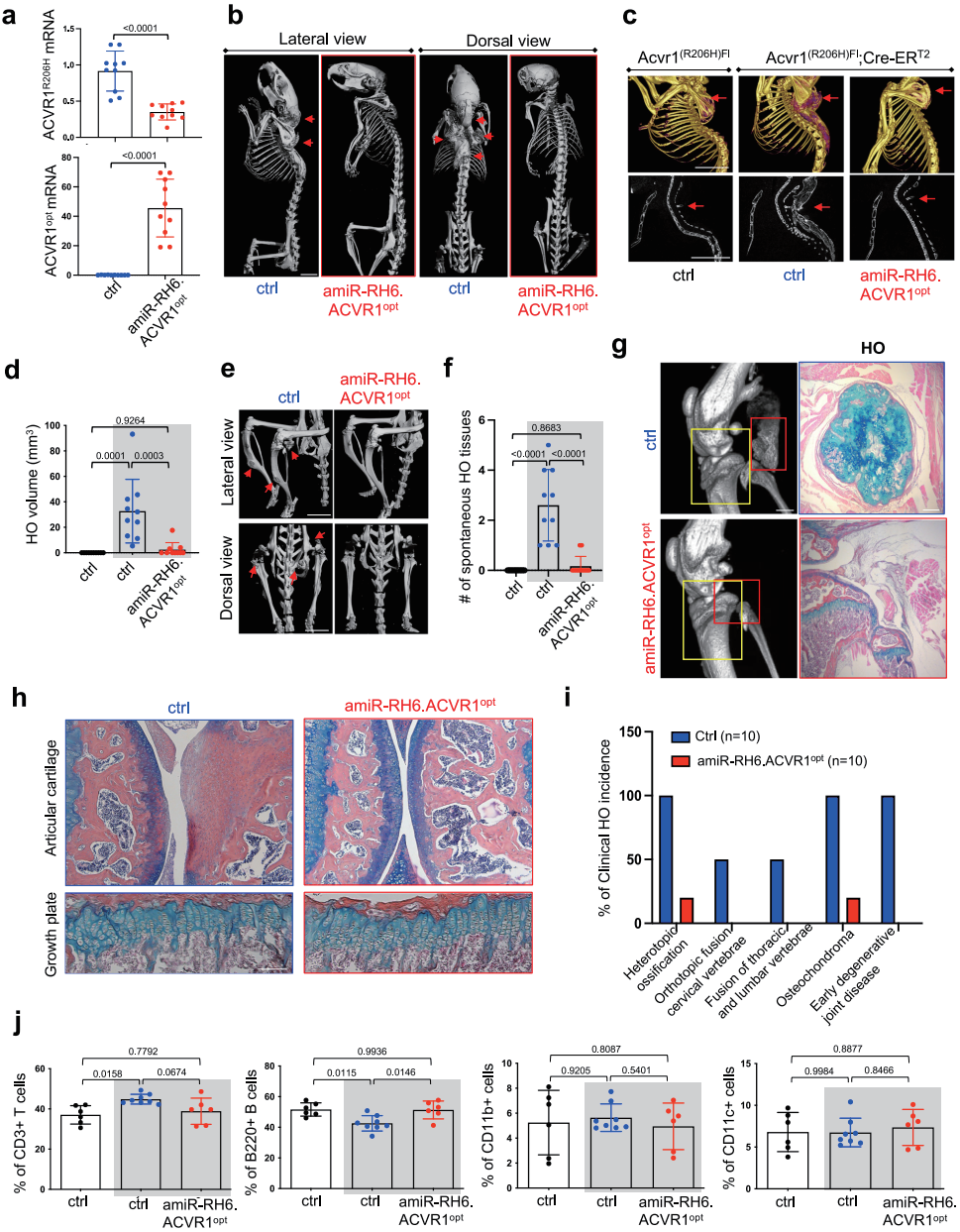
应用案例 2:异位骨化的抑制[4]

背景知识:FOP(Fibrodysplasia Ossificans Progressiva, FOP)是一种由 ACVR1 基因突变引起的遗传性疾病,其中约 97% 的 患者携带 ACVR1R206 H 突变。这种突变导致 BMP 信号通路异常激活,进而引发异位骨化。目前,FOP 尚无有效的预 防或治疗方法,患者主要依赖于对症治疗,如使用高剂量皮质类固醇来缓解炎症和疼痛。
研究方法:以 AAV9 作为基因递送载体,设计了三种 AAV 基因治疗策略: 基因替换:通过表达优化的人类 ACVR1(ACVR1opt)来稀释 ACVR1R206 H 的异常信号。 基因沉默:使用微 RNA(miRNA)特异性沉默 ACVR1R206 H 等位基因。 基因替换与沉默的组合:同时进行基因替换和基因沉默。
实验设计:
体外实验:首先在人类 FOP 患者的诱导多能干细胞(iPSCs)和小鼠骨骼细胞中测试了这些策略的有效性。结果显 示,这些基因治疗策略能够显著抑制由 Activin A 诱导的异常 BMP 信号通路激活、软骨生成和成骨分化。
体内实验:在携带人类 ACVR1R206 H 突变的小鼠模型中进行了实验。通过局部注射或系统性注射 AAV9 载体,评估 了这些策略对创伤诱导和自发性异位骨化的抑制效果。
实验结果:
体外实验:在人类 FOP iPSCs 和小鼠骨骼细胞中,AAV 基因治疗显著降低了 Activin A 诱导的 ALP 活性、矿化作用以 及 RUNX2、SOX9 等成骨和软骨生成相关基因的表达。
体内实验:在小鼠模型中,局部或系统性注射 AAV9 载体能够显著减少创伤诱导和自发性异位骨化的发生。特别是 在出生时或成年早期系统性注射 AAV9 载体,能够几乎完全预防异位骨化的发展,并且对骨骼生长和骨重建没有明 显的负面影响。
安全性评估:研究还评估了 AAV 基因治疗对小鼠免疫系统的影响,发现治疗并未引起明显的免疫反应,表明该方法 具有良好的安全性。
原文图 4 CasRx 介导的 Ctnnb1 和 Smo 敲低阻止了骨关节炎(OA)膝关节的退变
参考资料:
[1].Lin, C., et al., Development of AAV-Mediated Gene Therapy Approaches to Treat Skeletal Diseases. Hum Gene Ther, 2024. 35(9-10): p. 317-328.
[2].rol, M.W., The evolving landscape of gene therapy strategies for the treatment of osteoarthritis. Osteoarthritis Cartilage, 2024. 32(4): p. 372-384.
[3].De la Vega, R.E., et al., A phase 1 clinical trial shows safe, sustained, AAV-mediated expression of IL-1Ra in the human osteoarthritic knee joint. Sci Transl Med, 2025. 17(801): p. eadu9804.
[4].Yang, Y.S., et al., Suppression of heterotopic ossification in fibrodysplasia ossificans progressiva using AAV gene delivery. Nat Commun, 2022. 13(1): p. 6175.