AAV 在心脏研究中的应用策略
派真生物
心脏研究中常用的 AAV 血清型
天然的 AAV 血清型中,AAV1、AAV6、AAV8、AAV9、AAVrh.10 和 AAVrh.74 对心脏有较好的感染效率,其中:
- 小鼠静脉或心肌注射:AAV9 > AAV8 > AAV6 > AAV1 > AAV2(图 3-5)
- 大动物心肌注射:AAV6 ≥ AAV1 > AAV9(图 6)
- 小鼠体内:AAV9 > AAVrh.74 ≥ AAVrh.10(图 7)
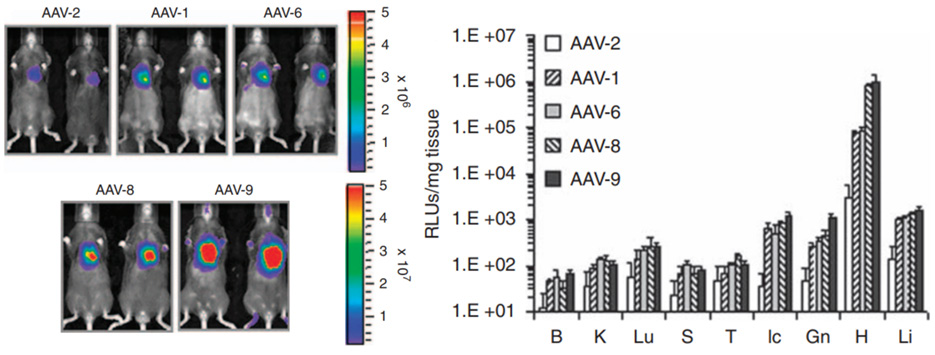
图 3. 五种 AAV 血清型在小鼠体内的心脏基因递送效率比较。注射方式为颈静脉注射,病毒注射总量为 1×10^11 vg/小鼠。Luc 的表达由 cTnT 启动子控制。(DOI: 10.1038/gt.2010.105)
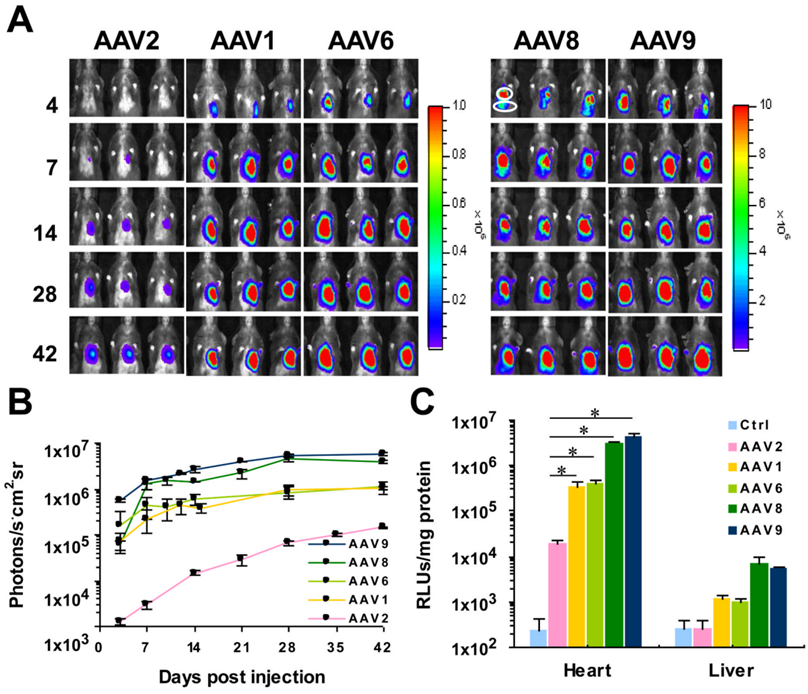
图 4. 五种 AAV 血清型在小鼠体内的心脏基因递送效率比较。注射方式为左心室前壁注射,病毒注射总量为 5×10^10 vg/小鼠,体积为 10μL。Luc 的表达由 cTnT 启 动子控制。(DOI:10.1002/jgm.1576)
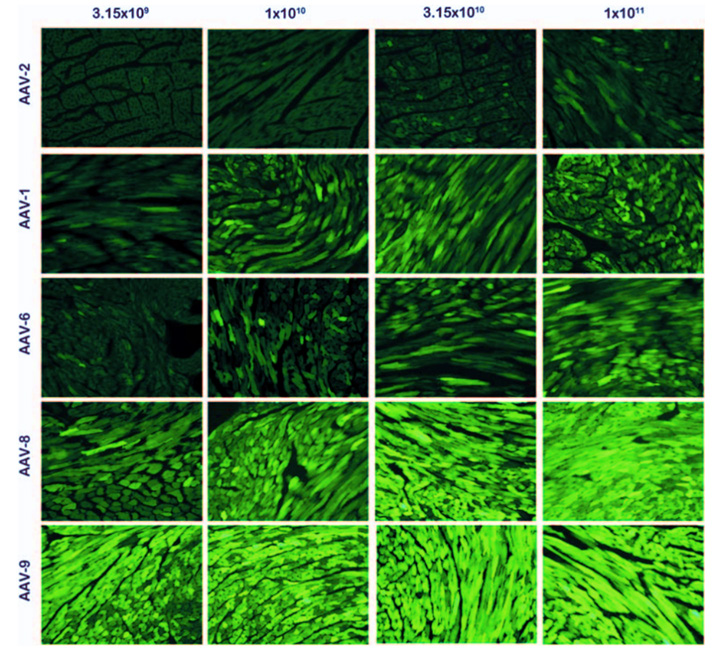
图 5. 五种 AAV 血清型以不同剂量注射至小鼠体内的心脏基因递送效率比较。注射方式为颈静脉注射。EGFP 的表达由 cTnT 启动子控制。(DOI: 10.1038/gt.2010.105)
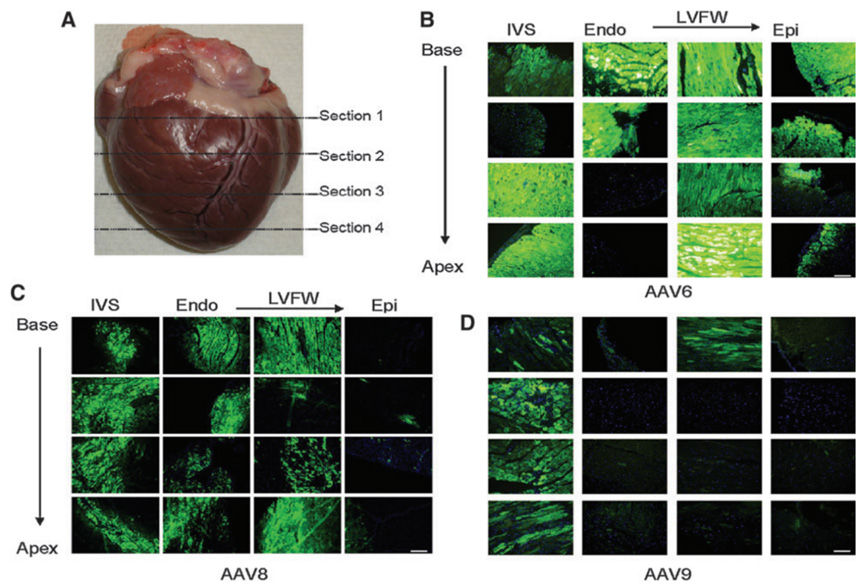
图 6. 三种 AAV 血清型在猕猴体内的心脏基因递送效率比较。注射方式为心内膜注射,病毒注射量为 5.4×10^12 vg/kg。EGFP 的表达由 CBG 启动子控制。Endo,心 内膜;Epi,心外膜;IVS,室间隔;LVFW,左心室游离壁。比例尺 = 200 微米。(DOI: 10.1089/hum.2011.042)
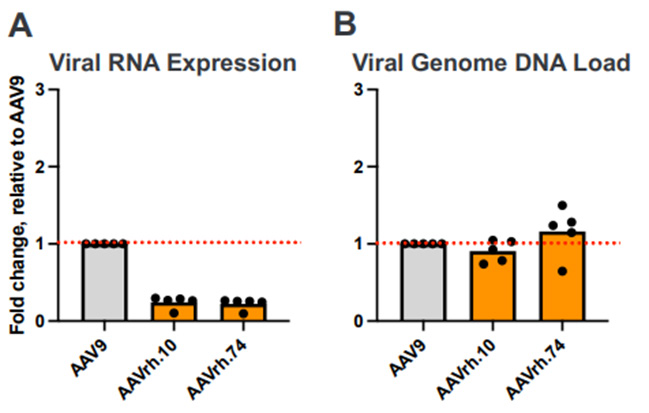
图 7. 在体内,AAV9 对心肌细胞的转导效率高于 AAVrh.10 和 AAVrh.74。(https://www.tenayatherapeutics.com/wp-content/uploads/ASGCT-2023-Capsid -Engineering-Ze.pdf)
AAV 血清型选择建议:
1、小鼠心脏研究
首选:AAV9(已验证的金标准)
增强效率:MyoAAV2A/4A(肌肉+心脏)
避免肝脏泄漏:AAV9 + miR122TS 或 MyoAAV 系列
2、大动物/灵长类心脏研究
心肌原位注射:AAV6(金标准)或 AAV5
系统性注射:AAV9、AAVrh.10
肝脏去靶向需求:AAV2i8、MyoAAV 变体
3、临床转化研究
已进入临床:AAV2i8(肝脏去靶向)
工业界验证:Tenaya TN 系列
传统可靠:AAV6、AAV9
4、人源细胞/组织研究
人心肌细胞转导:TN1、AAV.KK04
人心脏类器官组织:AAV9 定向进化变体
心脏研究中 AAV 的应用案例 :
01 心肌靶向 AAV 的肝脏泄露问题
2024 年 5 月,北京大学郭宇轩研究员团队在 Circulation 杂志上发表题为「MicroRNA-122-mediated liver detargeting enhances the tissue specificity of cardiac genome editing」的研究成果。该研究基于 Cre-LoxP、CRISPR/Cas9 等超敏 DNA 记录技术, 发现 AAV9-Tnnt2 载体在肝脏中广泛泄漏表达。利用 microRNA-122 在肝脏组织中高度特异性表达的特点,该团队在 AAV9-Tnnt2 转基因的 3'-UTR 引入4个串联的 miR122 靶序列(4×miR122TS),利用肝脏中高表达的 miR-122 与这些靶序列结合,诱导 mRNA降解,从而大幅降低肝脏中的泄漏表达,同时不影响心肌中的基因表达(因心肌中 miR-122 表达极低)。这种策略将肝脏表达降低了约 80-90%,显著提高了心脏特异性。利用这种优化的载体,该团队通过静脉注射 AAV,成功实现心肌特异性的 CaMKIIδ 单碱基编辑失活,显著缓解心梗小鼠模型的疾病表型,并且不造成额外肝损伤。该研究构建了更加严格的心脏特异性 AAV 体内基因递送载体,实现了 AAV 在心脏研究中的技术升级。
研究思路及结果:
1.组织特异性评估:通过 Cre-LoxP 和 CRISPR/Cas9 技术,研究证实了 AAV9-Tnnt2 载体在肝脏中存在广泛的低水平泄漏表达;
2.miR122TS 介导的肝脏去靶:利用 miR122 在肝脏中的特异性高表达,通过在载体中引入 miR122TS,有效降低了肝脏的基因泄漏表达;
3.心脏疾病模型验证:将优化后的 AAV 载体应用于心梗小鼠模型,证实了其在改善心脏功能方面的显著效果,同时避免了对肝脏的额外损伤。
| 病毒工具 | AAV9-Tnnt2-GFP AAV9-Tnnt2-Cre |
| 实验动物 | 心梗小鼠模型 |
| 血清型 | AAV9 |
| 注射方式 | 静脉注射 |
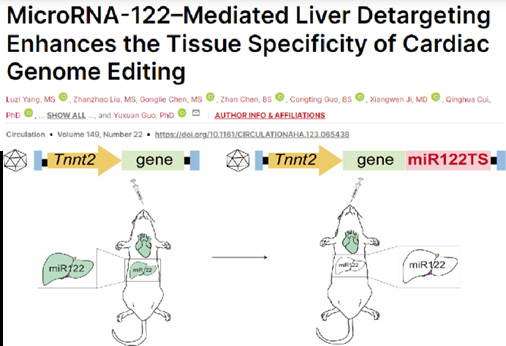
https://doi.org/10.1161/CIRCULATIONAHA.123.065438
02 在非人灵长动物中实现有效的 RNA 编辑的研究
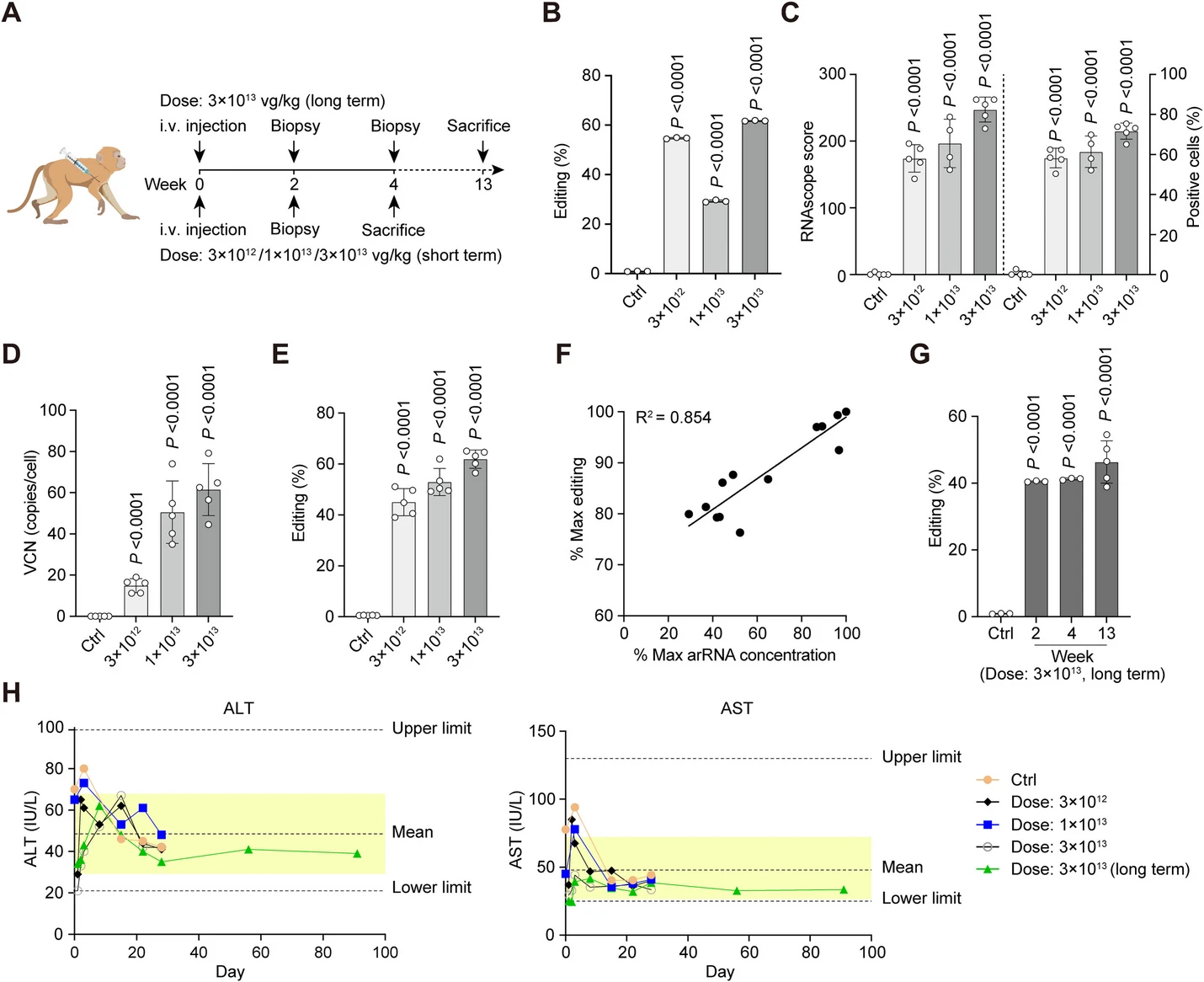
2023 年 10 月 23 日,北京大学魏文胜教授在 Genome Biology 在线发表题为「Utilizing AAV-mediated LEAPER 2.0 for programmable RNA editing in non-human primates and nonsense mutation correction in humanized Hurler syndrome mice」的研究论文,该研究展示了通过 AAV 介导的环状 ADAR 招募的 RNA(arRNAs)递送在适用于治疗的剂量下,可 以在灵长类非人灵长动物中实现有效的 RNA 编辑。在感染后的 4 至 13 周内,AAV 感染的细胞中的编辑效率可以达到约 80%,即 使在高剂量下也没有明显的毒性。此外,当 AAV 传递的循环 arRNAs 被系统地用于 Hurler 综合症人源化小鼠模型时,它能够精确纠正早期终止密码子,并在多个器官中恢复由 Hurler 致病基因编码的 IDUA 酶的功能。
| 病毒工具 | AAV8- Circ-arRNA |
| 启动子 | U6、CAG |
| 实验动物 | 食蟹猴(3-5 岁) |
| 血清型 | AAV8 |
| 注射方式 | 静脉注射 |
| 注射剂量 |
3×1012 vg/ kg 1×1013 vg/ kg 3×1013 vg/ kg |
https://genomebiology.biomedcentral.com/articles/10.1186/s13059-023-03086-6