材料与仪器
步骤
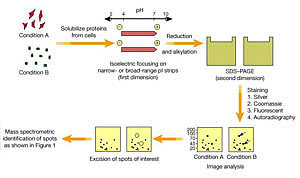
1. 用单向或者双向凝胶电泳将 32P 标记的目的蛋白质与其他不需要的成分分开。
2. 电泳结束后,用 50% 甲醇清洗三次,时间控制在 6 小时,去处 SDS 和电泳缓冲液将凝胶放在两张塞热玢膜(Bio-Rad) 之间吸干。用放射性墨水在凝胶边缘点几个记号。
3. 置于 X 射线片下曝光,在读片灯下看放射自显影图,找到放射标记的目的蛋白带用干净刀片小心地切下目的胶带,放入带螺帽的离心管用 0.5~1 ml 50 mol/L 碳酸氢铵泡。剥下赛璐玢膜,将胶带修剪成更小的小条。
4. 加一等份胰蛋白酶(1 μg 溶于 50 mmol/L 碳酸氢铵,TPCK 处理过),于 37℃ 在 360° 旋转器中消化和洗脱几小时或者过夜。
5. 10000 g 离心样品 5 分钟。小心取出上清,用一小等份做液闪计数估计回收效率。
6. 用真空离心浓缩器(Savant) 抽干上清。在 50 μl 碳酸氢铵中,用 0.5 μg 胰蛋白酶于 37℃ 继续消化 4 小时。离心抽干样品,用 20 μl pH 1.9 的电泳缓冲液重悬,以去处残余的碳酸氢铵。再次离心抽干样品。此时样品已可进行电泳。
2. 电泳结束后,用 50% 甲醇清洗三次,时间控制在 6 小时,去处 SDS 和电泳缓冲液将凝胶放在两张塞热玢膜(Bio-Rad) 之间吸干。用放射性墨水在凝胶边缘点几个记号。
3. 置于 X 射线片下曝光,在读片灯下看放射自显影图,找到放射标记的目的蛋白带用干净刀片小心地切下目的胶带,放入带螺帽的离心管用 0.5~1 ml 50 mol/L 碳酸氢铵泡。剥下赛璐玢膜,将胶带修剪成更小的小条。
4. 加一等份胰蛋白酶(1 μg 溶于 50 mmol/L 碳酸氢铵,TPCK 处理过),于 37℃ 在 360° 旋转器中消化和洗脱几小时或者过夜。
5. 10000 g 离心样品 5 分钟。小心取出上清,用一小等份做液闪计数估计回收效率。
6. 用真空离心浓缩器(Savant) 抽干上清。在 50 μl 碳酸氢铵中,用 0.5 μg 胰蛋白酶于 37℃ 继续消化 4 小时。离心抽干样品,用 20 μl pH 1.9 的电泳缓冲液重悬,以去处残余的碳酸氢铵。再次离心抽干样品。此时样品已可进行电泳。
来源:丁香实验