万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
派真生物
- 服务名称:
病毒包装服务
GMP级别AAV生产
随着基因与细胞治疗领域的快速发展,符合监管申报标准的大规模GMP级AAV生产需求应运而生。派真生物致力于为基因与细胞治疗全生命周期提供解决方案,覆盖研究者发起的临床试验(IIT)、新药临床试验(IND)申报、I-III期临床试验直至商业化阶段的大规模GMP级AAV生产。
依托自主开发的平台技术,派真生物提供符合GMP标准的AAV大规模生产服务,涵盖从上游生产到下游纯化以及制剂灌装的全流程服务。我们确保AAV生产服务严格遵循GMP规范,并满足临床应用相关的所有法规要求。

关键优势
- 自主高产技术:基于多项已获授权的专利技术有效提升AAV产量5~20倍,包括GOI质粒骨架、 RC 和 Helper 辅助质粒的高产设计等;
- 工艺优化能力:通过优化上游培养及转染、下游层析工艺,实现产量、质量、成本最适配;
- 规模化生产:稳定、可靠的生产工艺可放大性以及批间一致性,为商业化大规模生产铺平道路;
- 可适配性:10~2000L生产规模的贴壁或悬浮生产工艺,满足不同基因治疗适应症对产能的各种需求;
- 先进的生产设施:中美双cGMP生产设施,行业领先的一次性生产技术,符合全球申报要求;
- 完备的注册申报体系:严格的GMP质量管理体系、专业的中美注册团队,准确、完整、可追溯的开发、生产、质量等原始数据及报告。
服务内容
派真生物是AAV领域的龙头企业,凭借π-Icosa™ AAV衣壳筛选平台、π-Alpha™ 293 AAV高产技术平台、π-Omega™ 质粒高产技术平台以及一站式分析检测服务平台,以客户需求为导向,不断追求技术创新,成功开发了具有自主知识产权的多款新型AAV衣壳、病毒载体生产用PCS™及PCA™细胞、AAV生产工艺技术,大幅度提高AAV产量、降低相关杂质水平以及提高大规模生产的批间一致性。
派真生物分别位于中国广州和美国休斯顿的10000平方米和3200平方米cGMP设施,为全球客户提供质粒、病毒载体从质粒构建、工程菌/细胞建库、工艺开发、上下游生产、制剂灌装到注册申报等服务。
我们的AAV GMP生产一站式服务平台包括:
- π-Alpha™ 293细胞AAV高产技术平台:安全、高产、稳定的制造工艺平台
- π-Omega™ 质粒DNA高产平台:高产、稳定的制造工艺平台
- 分析检测服务平台:从早期概念验证到商业化制造的一站式分析检测服务
厂房设施

派真生物(PackGene)致力于为全球患者提供可负担的基因治疗解决方案,以“让基因治疗更可及”为使命。我们在国内的10,000㎡GMP生产基地包含2条质粒生产线及4条病毒载体生产线,在美国的3,200㎡GMP生产基地包含2条病毒载体生产线,全面满足国内外客户的全球申报需求。公司配备了国际领先的多产品柔性生产车间,支持10升至2000升的模块化生产规模,灵活适配临床前研究至商业化阶段需求。从上游培养到下游纯化,广泛采用一次性技术,最大限度降低交叉污染风险,保障产品高质量与合规性。
- 2 GMP生产基地(中国广州和美国休斯顿)
- 6 GMP AAV生产线(10~2000L)
- 2 GMP 质粒生产线 (5~200L)
能力
高产、稳定的平台生产工艺,确保生产工艺的可放大性
悬浮生产从30mL~200L稳定放大,上游产量>1E17vg,下游回收率>40%
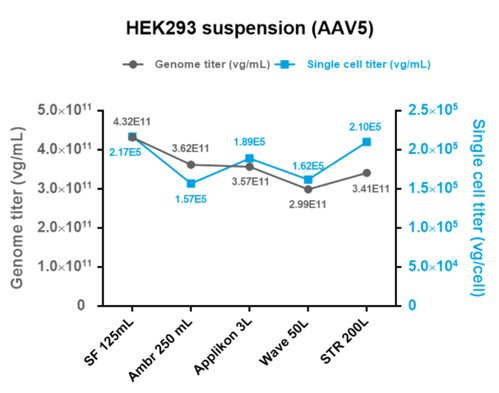
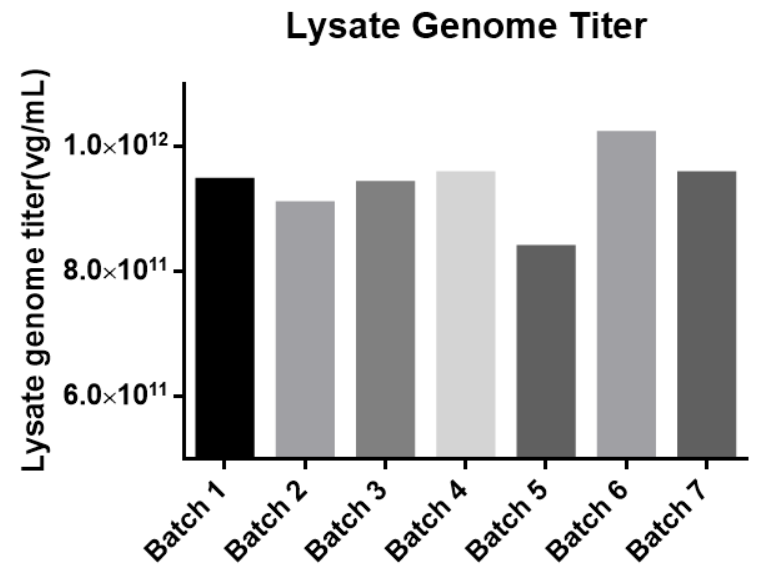
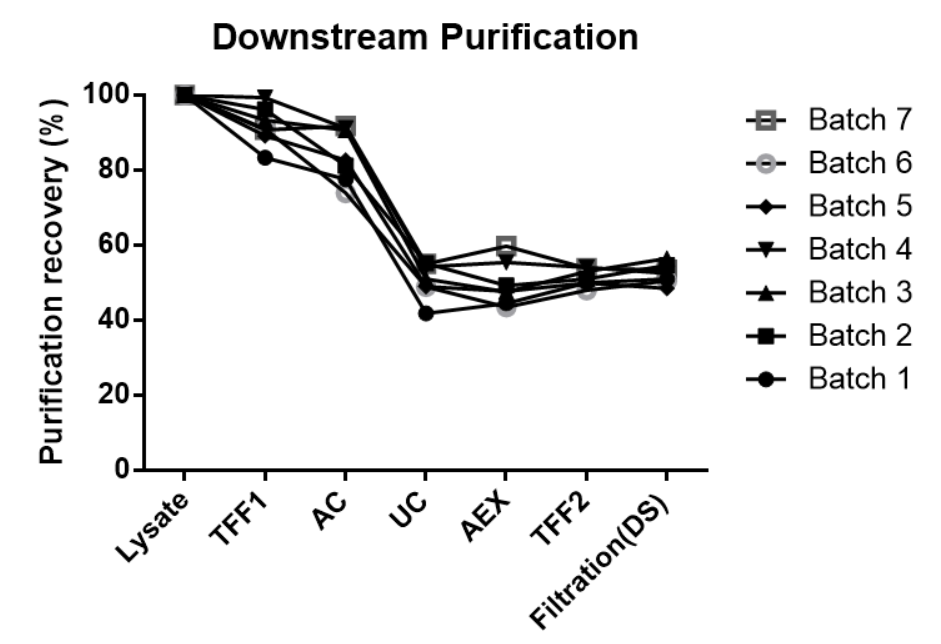
快速、高效的工艺优化能力,应对创新型AAV衣壳、GOI的多样性、复杂性挑战
案例:优化培养条件、转染条件、补料措施、酶切、亲和层析等,大幅降低HCD残留
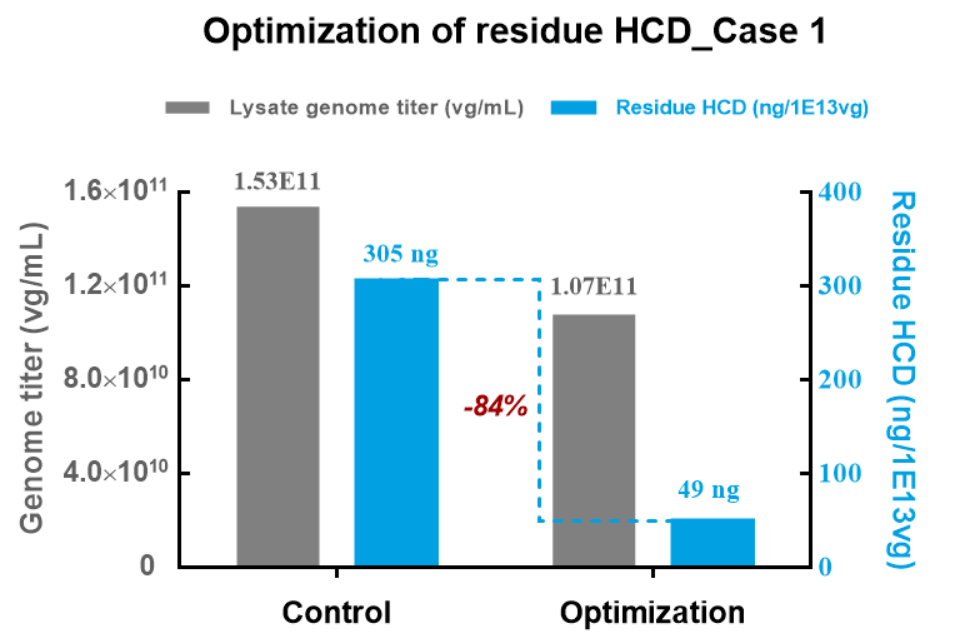
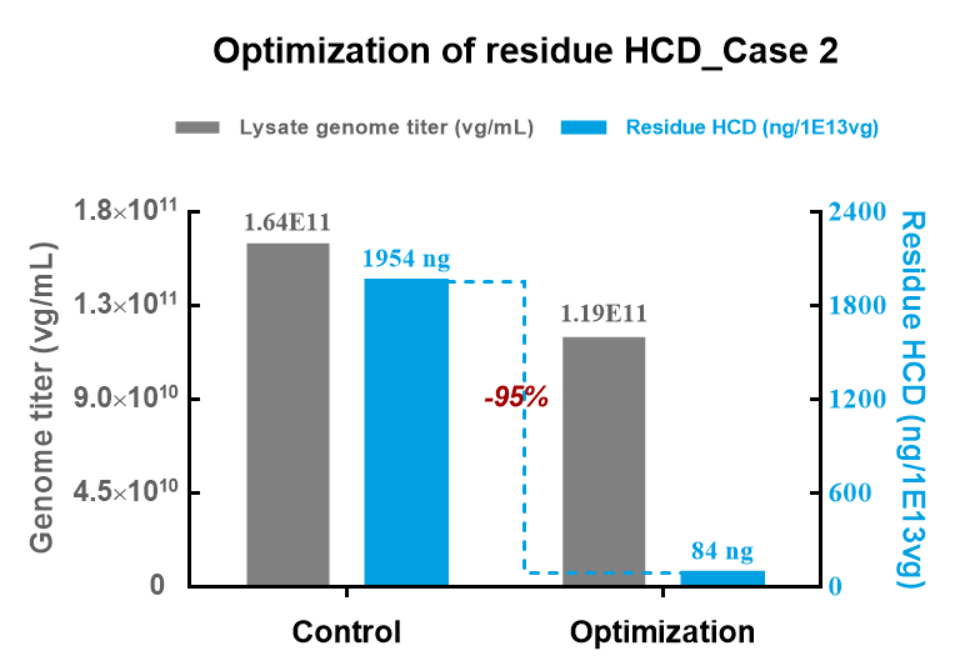
丰富的项目经验
国内最多的AAV IND项目经验,22个IND; 零发补通过FDA/NMPA 中美IND申报; 成功交付9个FDA、12个NMPA IND申报项目; 成功交付30+个IIT项目; 成功交付中试规模AAV产品200+批;
派真生物为您的项目提供GMP级别AAV生产服务。请留言提出您的项目需求,或联系派真生物技术支持以获得价值建议。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验2 作为递送载体。派真生物能为您提供从研究至 GMP 级别的多种 AAV 血清型载体,助力眼科疾病基因治疗。 AAV 眼科基因治疗策略 1、基因替代(Gene Replacement): 原理:将功能正常的目的基因的 CDS 序列由 AAV 转导到细胞内,并在载体上启动子的作用下转录表达 应用场景:隐性单基因疾病 应用案例精选 适应症:双等位基因 RPE65 突变相关视网膜营养不良 病毒载体:AAV2-hRPE65v2 注射方式:视网膜下注射,1.5×10^11 vg/ 眼,0.3 ml
目前,国内正规的制药行业均依据《药品生产质量管理规范》(GMP)进行工厂管理,生产环境的要求及其严格。为了保证药品质量安全,GMP中对不同类型药品的生产环境洁净度都进行了限定,因此,生产环境监测就成为了把关药品生产安全的重要一环。最新版《药品生产质量管理规范》附录1:无菌药品中,第十一条指出:“应当对微生物进行动态监测,评估无菌生产的微生物状况。监测方法有沉降菌法、定量空气浮游菌采样法和表面取样法(如棉签擦拭法和接触碟法)等。”沉降皿法是最常用的“空气微生物取样”方法,目前国标及药典中均采用
1、研究中该如何选择 AAV 血清型和剂量? 您可以在我们的血清型选择指南中找到所有血清型和组织趋向性的介绍。 2、重组 AAV 是复制缺陷的吗? 对于野生型 AAV,如果没有辅助病毒(如腺病毒)的存在,其复制效率极低。对于现在生产的重组 AAV,复制和衣壳基因是在 Rep/Cap 质粒中提供的。只有 AAV 基因组的两个 ITR(倒置末端重复序列)被保留并包装成病毒颗粒,而所需的腺病毒基因要么是由腺病毒提供的,要么是由另一个质粒提供的。理论上,重组 AAV 是不可能复制的。 3、AAV
 技术资料
技术资料暂无技术资料 索取技术资料