万千商家帮你免费找货
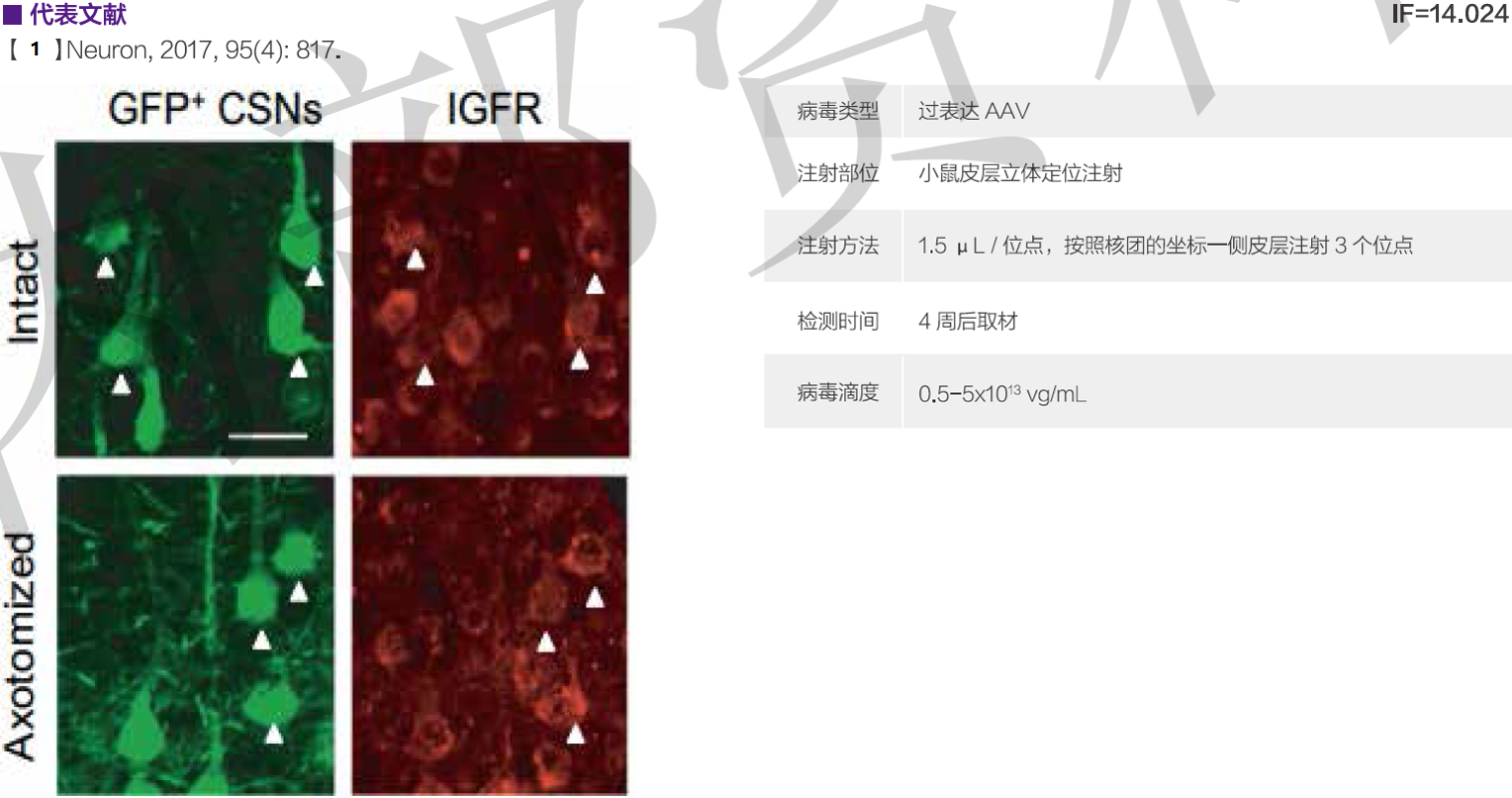
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
吉凯基因
- 服务名称:
AAV 在神经领域中的应用
AAV 在神经领域中的应用优势
1. 扩散性强: 体积小,滴度高,具有远高于腺病毒和慢病毒的扩散性,可穿透血脑屏障,是最理想的神经元和胶质细胞感染工具。
2. 特异性强: 有十数种常用的血清型,不同的血清型对不同的脏器有较高的识别及感染能力。
3. 免疫原性低: 局部大剂量感染肌肉、脑、眼等组织时,很少有感染上的细胞之后被免疫系统所清除。这种特性对于动物实验显然极有帮助。
AAV 应用于神经系统的文献综述
| 病毒类型 | 注射部位 | 病毒滴度( 量) | 注射方法 | 检测时间 | 代表文献 |
| AAV | 小鼠单侧皮层 | 0.5-5×1013 v.g/mL | 1.5 μL/ 位点,按照核团的坐标一侧皮层注射3个位点 | 28天 | 【1】 |
| 小鼠双侧皮层 | 1.49×1012 v.g/mL | 0.5 μL/ 位点,速度30nL/min,留针10 min | 至少28 天 | 【2】 | |
| 小鼠双侧海马 | 1 μL/ 位点,速度0.2μL/min,留针10 min | 14 天 | 【3】 | ||
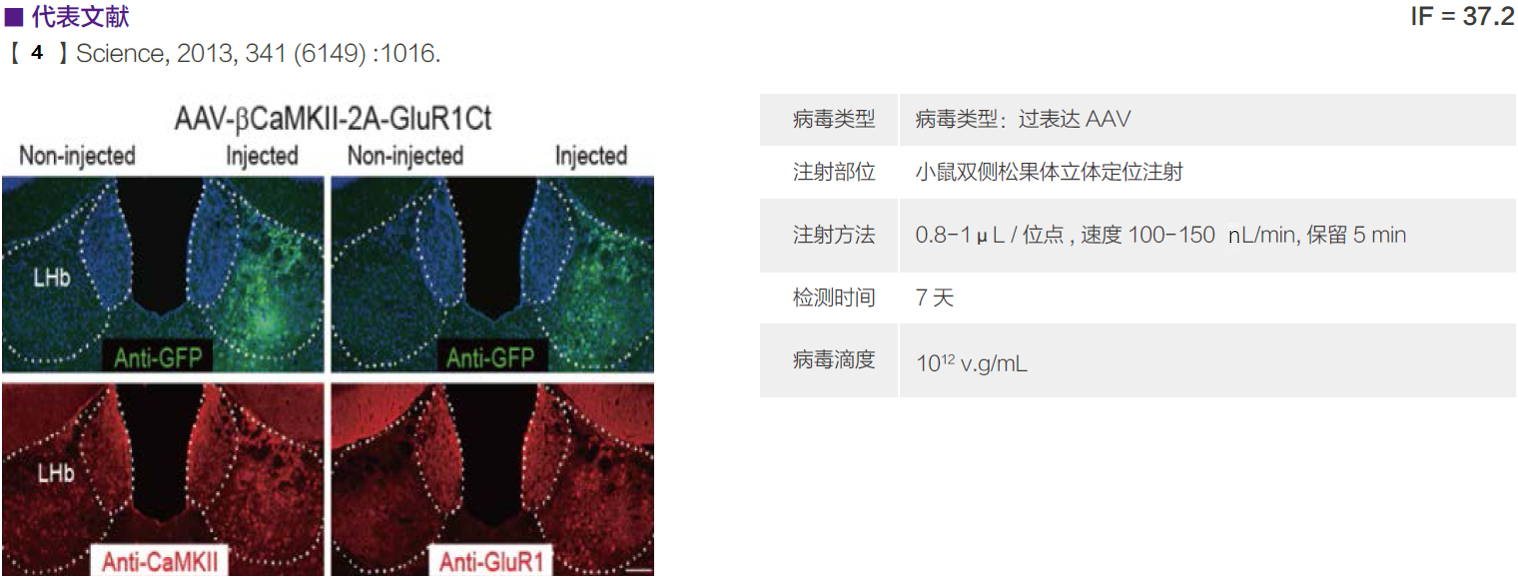
| 小鼠双侧松果体 | 1×1012 v.g/mL | 0.8-1 μL / 位点,速度100-150μL/min, 保留5 min | 【4】 | ||
| 小鼠脊髓注射 | 1×1012 v.g/mL | 8 个位点, 1 μL / 位点 | 30 天 | 【5】 |
AAV 在神经系统中的应用
1. 皮层注射

2. 海马体注射

3. 松果体注射
4. 脊髓注射

AAV 在神经系统中的注射方法综述
脑立体定位注射
第一部分:实验前准备
1. 首先麻醉小鼠。
2. 然后从饲养笼中取出小鼠。5-10min 后,麻醉剂起效。
3. 待小鼠麻醉后,用剃毛器将小鼠头部毛发剔除干净。
第二部分:固定小鼠
1. 将麻醉剔毛后的小鼠固定到立体定位仪上。
2. 固定时,先将小鼠门齿卡在适配器门齿夹上,轻轻压上门齿夹横杆,调整适配器高度和前后,使耳杆可以方便进入小鼠外耳道。
3. 左手托起小鼠头部,将左侧耳杆插入小鼠耳道,调节左右侧耳杆使动物头部保持在U 型开口的中心位置,先锁紧固定一侧耳杆,后旋紧另一侧耳杆,使动物头部不能晃动,同时旋紧门齿夹螺丝。
4. 检查是否固定成功:鼻对正中,头部不动,提尾不掉,目测大脑放置水平。
5. 用脱毛膏或者剃刀将需要手术部位的毛发去除。
6. 然后用手术刀划开小鼠头部皮肤,去除颅骨表面结缔组织,暴露前后囟。
7. 根据脑图谱,确定待注射脑区的位置参数,包含离Bregma 和Lambda点的距离以及核团深度。
8. 以Bregma 为0 点,按照预先确定好的坐标移动颅骨钻,打开合适大小的骨窗(窗口尽量小但是又不妨碍实验)。小心地用颅骨钻在注射位点处轻磨颅骨,将颅骨慢慢打薄,当颅骨出现裂缝的时候,用医用注射器的针头小心挑破,防止损伤,如果在此过程中有出血,可以用很小的医药棉球拉成长条形将血吸走,钻孔时一定要控制好,否则很容易在钻通颅骨后一不小心钻头进入脑组织,造成损伤。
第三部分: 注射病毒
1. 用PBS 冲洗微量注射器3-5 次。
2. 先吸取1μl 空气,再吸取1μl 稀释好的病毒( 方便病毒充分注射进脑),在空气中测试注射器是否通畅;
3. 将微量注射泵,微量注射器组装好,置于钻好的孔上方,针尖与颅骨平行(Z=0),微调注射器位置使之与之前钻孔时位置相同。
4. 根据定好的深度将注射针缓慢下降。

原位注射方式多样,由于篇幅限制,其他注射方式不详细列举。请扫描二维码登录吉凯基因网上商城干货区详细了解,更有动物实验操作视频等。

相关产品
腺相关病毒AAV包装/载体构建一站式服务
RNAi 腺相关病毒AAV产品
过表达腺相关病毒AAV包装
慢病毒包装/载体构建一站式服务
逆转录病毒
腺病毒
慢病毒/腺病毒/AAV腺相关病毒等全线病毒产品服务
上海吉凯基因医学科技股份有限公司
地址:上海张江高科技园区爱迪生路332号
邮编:201203
全国热线:4006210302
售前顾问:13818254889;17600138744
邮箱:service@genechem.com.cn
URL: http://www.genechem.com.cn

风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验遗传性眼病是一类由于基因缺陷而导致的疾病,目前已报道大约有 200 种遗传性眼病和超过 400 种具有眼部表现的系统性疾 病。遗传性眼病引起的视觉功能丧失通常很难通过传统的手术、激光治疗和局部药物治疗来治愈。基因治疗已成为治疗这类疾 病最重要的手段。腺相关病毒(AAV)由于具有安全性好、免疫原性低、表达时间长、有多种组织和细胞特异性血清型可选 择、高稳定性等优势,已被广泛应用于眼科疾病基因治疗。首款获批上市的遗传性视网膜疾病基因治疗药物 Luxturna(约 85 万 美元/剂)采用了 AAV
and mitophagy in lung fibroblasts 的研究论文。 该研究表明,骨形态发生蛋白 4 (BMP4) 在 人肺中的下调,在 IPF 疾病发生和进展中起 关键作用,BMP4 信号通路通过调节肺成 纤维细胞的衰老和线粒体自噬抑制肺纤维 化。因此,BMP4 信号的激活可能是治疗 IPF 肺纤维化的一种新型有效的治疗方法。 血清型:AAV9 注射方式:气管内注射 病毒滴度:1x1010 vp/ml 靶向部位:肺 动物模型:C57BL/6 BMP4+/+ and BMP4+/- mice
rAAV 在神经科学研究中的应用方向 rAAV 血清型的选择 01 用于神经元示踪的血清型⸺AAV2-retro、AAV1、AAV9 使用 AAV 精确标记神经回路需要考虑可逆性,包括神经元的顺行和逆行标记,以及是否跨突触(图 2)。目前,只有两种血清型可 以用于神经元顺行标记,即 AAV1(图 3)和 AAV9,高滴度的 AAV9 可顺向跨突触。唯一可用于逆行标记是 AAV2-retro(图 4)。 图 2 AAV 等工具病毒在神经环路示踪应用中的传播方向和层级 [Neurosci
 技术资料
技术资料暂无技术资料 索取技术资料