重磅发现:m5C修饰的circRREB1通过诱导线粒体自噬促进肺癌进展!
2025-08-14 09:52点击次数:377
关键词:肺癌是常见的恶性肿瘤,也是导致癌症相关死亡的首要原因。环状RNA(circRNAs)具有重要的生物学功能,并与肿瘤发展密切相关。5-甲基胞嘧啶(m5C)修饰能够调控RNA 分子的分子命运,从而影响疾病的发展。在本研究中,我们发现环状RREB1 在肺癌组织和细胞中高度表达,而高表达环状RREB1 的患者预后较差。我们发现环状 RREB1 通过甲基转移酶NSUN2 的介导进行 m5C 修饰。这种修饰通过m5C 读取器 ALYREF 促进其向细胞核的输出。功能研究表明,环状RREB1 在体外和体内均促进肺癌的发展。从机制上讲,环状RREB1 直接与 HSPA8 结合,并通过抑制依赖于泛素的降解来稳定它,从而通过HSPA8/PINK1/Parkin 信号轴诱导线粒体自噬,并最终促进肺癌的发展。该研究于2025年7月发表在《Journal of Experimental & Clinical Cancer Research》,IF:12.8。
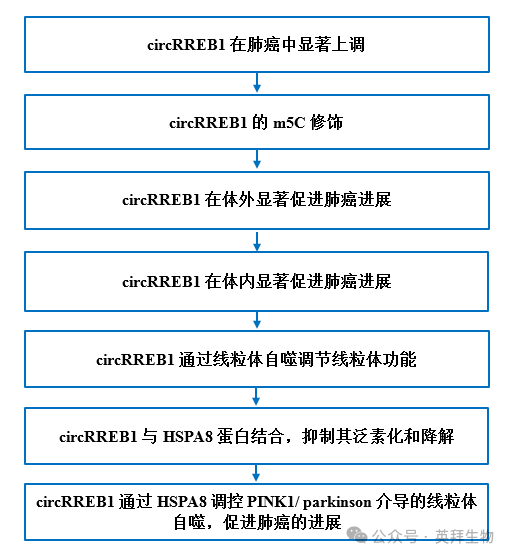
技术路线
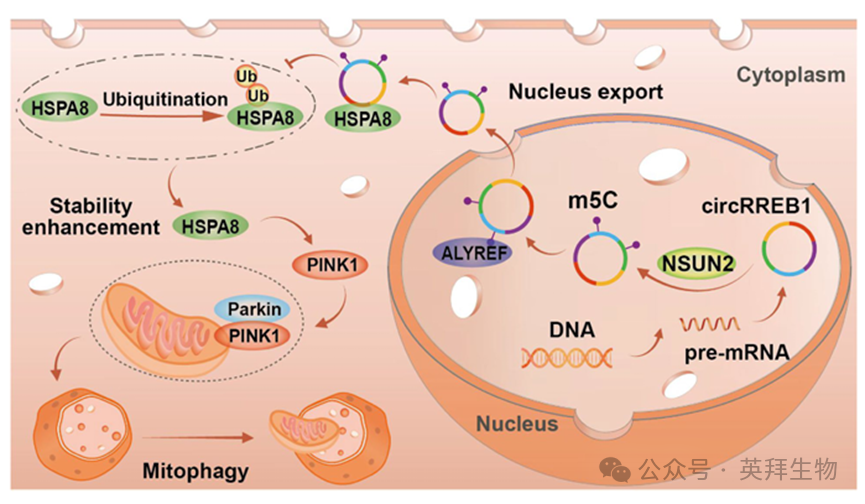
Graphical Abstract
主要研究结果:
1.circRREB1在肺癌中显著上调
我们以人类支气管黏膜上皮细胞作为对照组,以砷诱导的恶性细胞模型作为实验组,构建了差异性的环状 RNA 表达图谱,以确定在肺癌中起关键作用的环状 RNA(图 1A)。通过对高表达的环状RNA进行生物信息学分析以及KEGG通路富集分析,我们发现了一个与癌症密切相关的环状RNA,即circRREB1(图 1B)。随后,我们检测了circRREB1 在BEAS-2B、A549、H1299、HCC827和H460细胞中的表达情况,qPCR实验结果表明,circRREB1 在这些肺癌细胞系中高度表达(图 1C)。此外,我们还评估了circRREB1在60对肺癌组织和癌旁组织中的表达情况,结果表明肺癌组织中的 circRREB1 表达显著上调(图 1D)。同时,深入的临床相关性分析显示,circRREB1 的表达与肿瘤分级和肿瘤直径呈正相关(图 1E、F);ROC 分析显示曲线下面积(AUC)为 0.859(图 1G)。基于这些结果,我们认为circRREB1 有可能成为肺癌的诊断标志物。随后的生存分析显示,circRREB1 高表达的患者预后比低表达的患者更差(图 1H)。
我们访问了 UCSC 基因浏览器网站,以全面描述circRREB1 的特征,并发现circRREB1由位于6号染色体上的 RREB1 基因的第2至6个外显子通过反向剪接形成,其环化位点通过Sanger测序得到了确认(图 1I)。与线性 RNA 相比,circRNA 对线性核酸酶的消化具有抵抗力。在用 RNase R 处理总 RNA 样本后,circRREB1 比线性 GAPDH 更耐受 RNase R 的消化(图 1J)。我们还设计了 circRREB1 特定的正向和反向引物,并使用三组样本(RNase R - 组、RNase R + 组和 gDNA 组)进行了 PCR 扩增。经过琼脂糖凝胶电泳和成像,由正向引物扩增出的产物比由反向引物扩增出的产物更耐受 RNase R 的消化(图 1K)。随后,我们用 Act D 处理细胞,提取 0 小时、4 小时、8 小时、12 小时和 24 小时的 RNA,并通过 qPCR 检测 circRREB1 和 RREB1 的表达。结果表明,circRREB1 的半衰期比 RREB1 更长(图 1L)。通过上述结果,我们确定 circRREB1 具有环状结构。最后,通过在肺细胞系 A549 和 H1299 上进行的荧光原位杂交(FISH)实验,以及在 A549 细胞中进行的核-质分离分析,我们研究了 circRREB1 的亚细胞定位。实验结果表明,circRREB1 主要位于细胞质中。(图 1M、N)。然而,我们使用 BEAS-2B 细胞进行的 FISH 实验显示,circRREB1 主要位于细胞核中(补充图 S1A)。
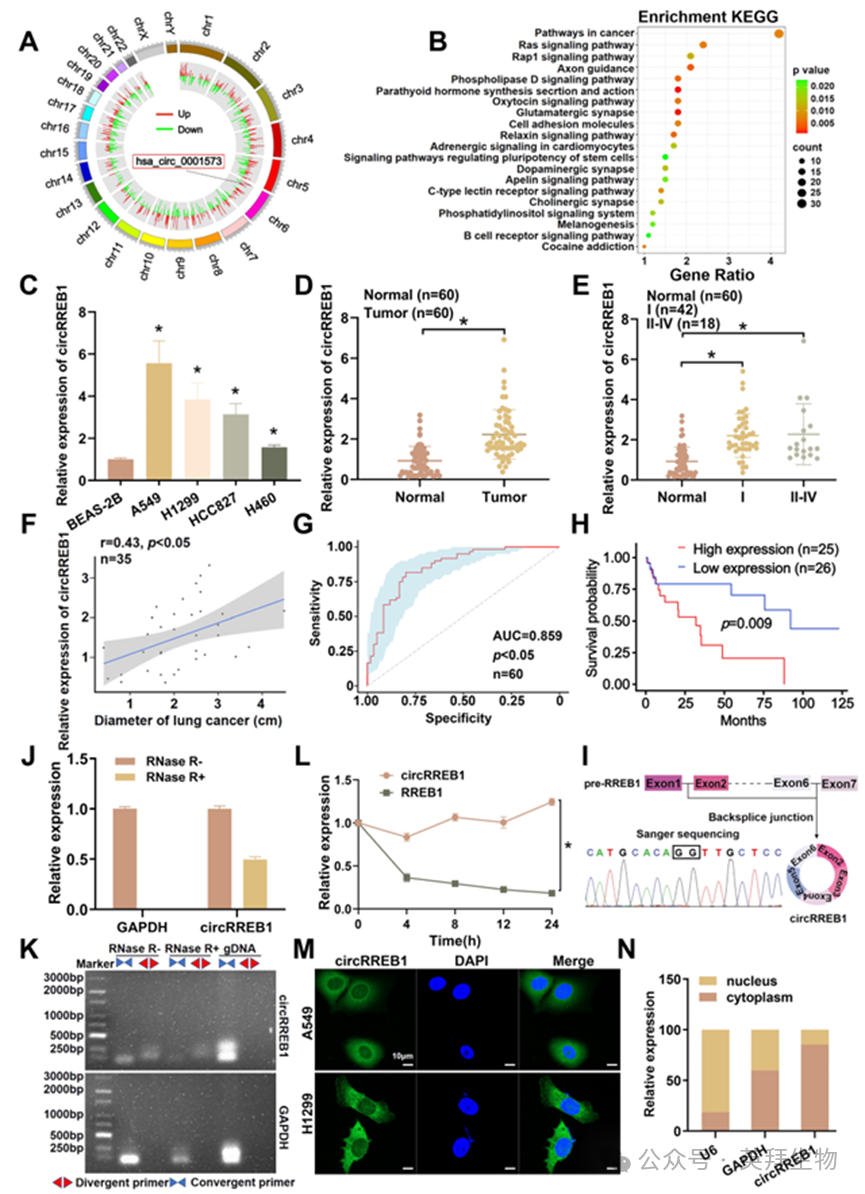
图1. circRREB1在肺癌中显著上调
2.circRREB1的m5C修饰
我们的初步研究发现,circRREB1在A549 和 BEAS-2B 细胞中的亚细胞定位存在差异。鉴于异常的环状 RNA 表达通常与肿瘤发展有关,我们旨在详细探究环状 RNA 表达差异的原因。m5C修饰在调节环状RNA的命运中起着关键作用。我们使用癌组织作为实验组,相邻的非癌组织作为对照组,进行了 m5C 微阵列芯片检测,以获得环状 RNA 的差异 m5C 修饰图谱。结果表明,circRREB1 可能被 m5C 修饰(图 2A)。我们使用 m5C 修饰特异性抗体进行了 MeRIP 实验,发现 m5C 抗体显著富集了 circRREB1,这表明 circRREB1 中存在 m5C 修饰(图 2B、C)。随后,我们在 50 个碱基对的片段中设计了特异性的截短引物,并进行了 CLIP 实验,以探索环状 RNA 上 m5C 修饰的位置。qPCR 结果显示,m5C 修饰位于第二个片段(图 2D)。
m5C 修饰需要甲基转移酶(writers)的参与。此前的研究表明,真核生物的 m5C 修饰通常由 NOL1/NOP2/sun(NSUN)家族和 DNA 甲基转移酶成员 2(DNMT2)介导。我们最初进行了 TRAP 实验,以确定介导 circRREB1 的 m5C 修饰的writers。经过聚丙烯酰胺凝胶电泳(PAGE)和银染处理后,我们进行了液相色谱 - 质谱分析(LC-MS)以确定与 circRREB1 结合的蛋白质(图 2E)。根据 LC-MS 结果,我们确定了 NSUN2,这是一种已被报道介导 m5C 修饰的写入者。通过查询 The Cancer Genome Atlas(TCGA)数据库中的数据,我们发现 NSUN2 在肺癌组织中高度表达,且高表达 NSUN2 的患者比低表达 NSUN2 的患者预后更差(补充图 S1B、C)。这一趋势与肺癌组织中 circRREB1 高表达的趋势一致。因此,我们选择了 NSUN2 进行进一步研究。在 NSUN2 过表达后,我们进行了 MeRIP 实验。结果表明,circRREB1 的 m5C 修饰水平显著升高(图 2F、G)。
m5C 修饰的生物学功能通常与识别蛋白有关。我们的 TRAP-MS 结果显示,在本研究中,主要的 m5C 识别蛋白是 Aly/REF 输出因子(ALYREF),它已被证实能够识别 m5C 修饰并调节 RNA 稳定性和核输出。来自 TCGA 数据库的数据表明,ALYREF 在肺癌患者中高度表达,且高 ALYREF 表达与不良预后相关(图 2H,补充图 S1D)。这一趋势与肺癌组织中 circRREB1 的高表达及其主要位于细胞质相一致。因此,ALYREF 被选作进一步研究的对象。我们首先进行了 RIP 实验,发现 circRREB1 直接与 ALYREF 结合(图 2I)。随后的 CLIP-qPCR 显示,circRREB1 与 ALYREF 的结合区域位于第二段,这与 m5C 修饰段一致(图 2J)。在 NSUN2 过表达的情况下,ALYREF 能够富集更多的 circRREB1(图 2K)。这些结果表明,ALYREF 能够识别 circRREB1 上的 m5C 修饰。我们设计了 ALYREF siRNA 来探究 ALYREF 报道的调节 RNA 分子命运的途径(图 2L)。通过进行 RNA 稳定性实验,我们发现 ALYREF 基因沉默后,circRREB1 的稳定性并未发生变化(补充图 S1E)。荧光原位杂交(FISH)和核-质分离实验表明,ALYREF 基因沉默后,circRREB1 的核含量显著增加(图 2M、N)。这一发现表明,沉默 ALYREF 可增加 circRREB1 的核表达,这与肺癌组织中ALYREF 的高表达相一致。我们还发现,NSUN2 过表达显著增加了 circRREB1 的核输出,而 ALYREF 基因沉默则逆转了由 NSUN2 过表达引起的核输出增加(图 2O)。综上所述,这些结果表明,NSUN2 增加了 circRREB1 的 m5C 修饰水平,而 ALYREF 能够识别 circRREB1 的 m5C 修饰,并以 m5C 依赖的方式调节 circRREB1 的核输出。
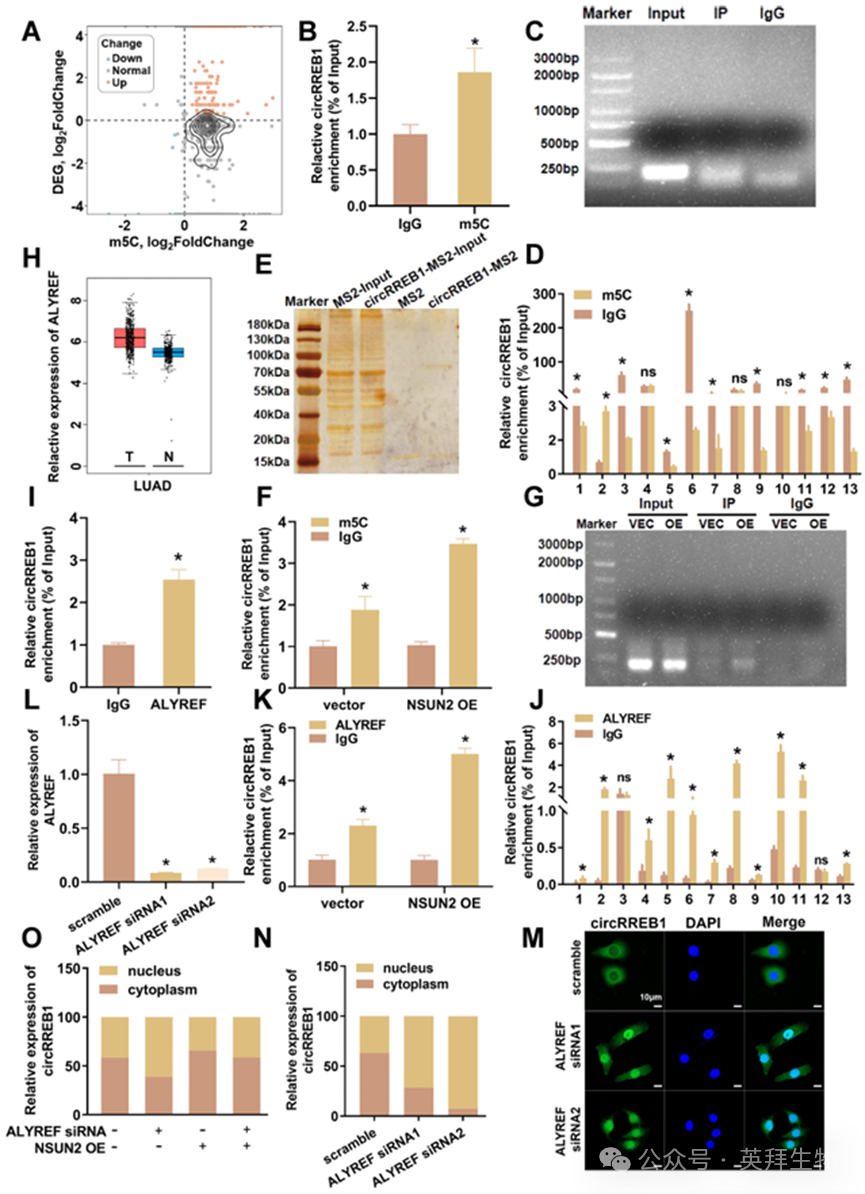
图2. circRREB1的m5C修饰
3.circRREB1在体外显著促进肺癌进展
我们构建了 circRREB1 基因沉默和过表达系统,以探究 circRREB1 的生物学功能(见补充图 S2A)。EdU 检测显示,circRREB1 基因沉默后细胞增殖减少,而过表达后细胞增殖增加(图 3A、B)。CCK-8 检测显示,circRREB1 基因沉默后细胞活力降低,而过表达后细胞活力增加(图 3C)。细胞周期的流式细胞术分析表明,circRREB1 基因沉默后细胞周期进程受到抑制,而过表达后细胞周期进程加快(图 3D、E)。流式细胞术检测显示,circRREB1 基因沉默后细胞凋亡增加,而过表达后细胞凋亡减少(图 3F、G)。Transwell 和伤口愈合检测显示,circRREB1 基因沉默后细胞迁移减少,而过表达后细胞迁移增加(图 3H、I;补充图 S2B、C)。总之,circRREB1 在体外能够显著促进肺癌的发展。为进一步阐明 m5C 修饰对 circRREB1 生物学功能的影响,我们同时抑制了阅读蛋白 ALYREF 的表达,并过表达了 circRREB1,随后评估了细胞活力和迁移能力。circRREB1 的过表达恢复了由 ALYREF 抑制所导致的细胞活力和迁移能力的下降(补充图 S2D-F)。
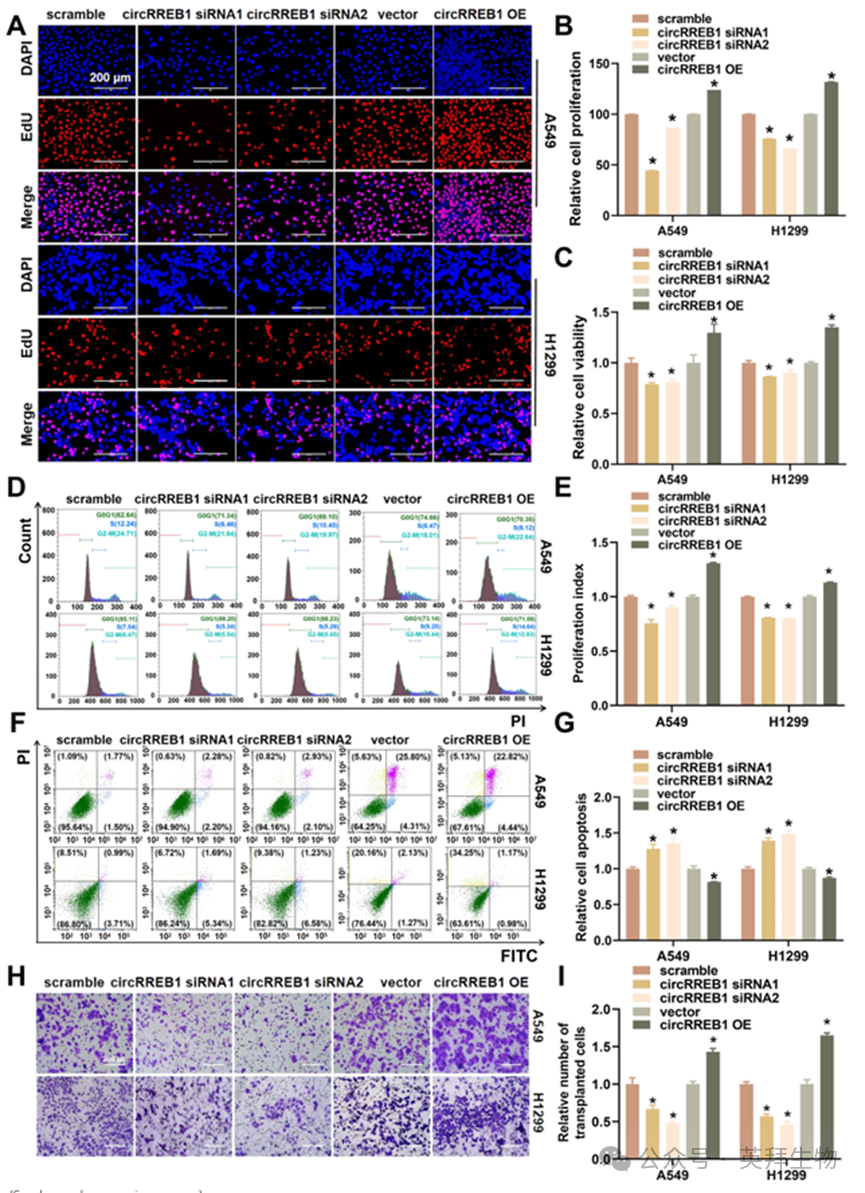
图3. circRREB1在体外显著促进肺癌进展
4.circRREB1在体内显著促进肺癌进展
我们阐明了环状 RNA RREB1 在肺癌中的体外作用机制,随后又探究了其在体内的作用。首先,我们成功构建了一个稳定的环状 RNA RREB1 编辑沉默的 A549 细胞系(补充图 S2G、H)。对照细胞和稳定的环状 RNA RREB1 编辑沉默细胞被皮下注射到裸鼠的右侧腹侧。在肿瘤形成后,每隔三天观察一次裸鼠的存活状况,并对每只裸鼠的体重和肿瘤体积进行评估和记录。在观察期结束时,对裸鼠进行Euthanasia,并收集肿瘤组织进行拍照(图 4A、B)。对肿瘤生长进行了统计分析,结果显示在环状 RNA RREB1 编辑沉默后,肿瘤生长速度变慢(图 4C)。我们进行了免疫组织化学实验以进一步阐明环状 RNA RREB1 在体内的生物学功能,发现稳定环状 RNA RREB1 编辑沉默的肿瘤组织中,与增殖相关的蛋白 Ki67、与细胞周期相关的蛋白 cyclin D1、与凋亡相关的蛋白 BCL2 以及与迁移相关的蛋白 RhoA 的表达水平均降低(图 4D-G)。补充图 S2I-L)。总之,这些结果表明,circRREB1 在体内能够显著促进肺癌的发展。
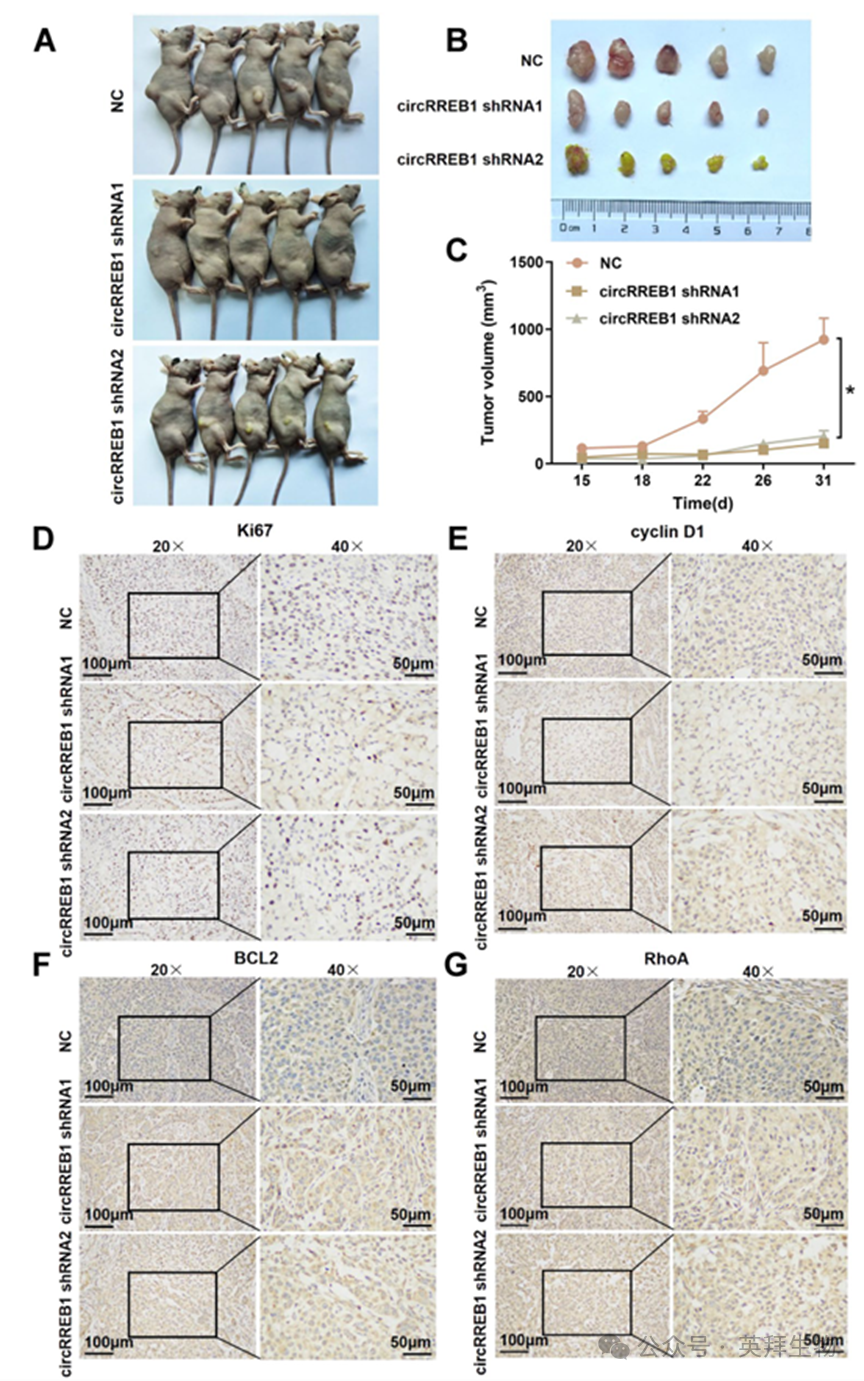
图4. circRREB1在体内显著促进肺癌进展
5.circRREB1通过线粒体自噬调节线粒体功能
通过体外和体内功能实验,我们发现circRREB1能够促进肺癌的发展。然而,circRREB1促进肺癌发展的具体分子机制仍需进一步研究。我们对TRAP-MS的结果进行了KEGG通路富集分析,并确定了几个与细胞色素P450酶系统相关的通路(图5A)。研究表明,通过细胞色素P450酶代谢各种药物或化学毒素所产生的代谢产物可导致线粒体功能障碍。因此,我们评估了线粒体功能。通过JC-1染色,我们检测到在circRREB1沉默后,JC-1聚集体的水平(以红色荧光表示)降低,而JC-1单体的水平(以绿色荧光表示)升高,这表明线粒体膜电位降低。相比之下,circRREB1的过表达导致JC-1聚集体水平升高,JC-1单体水平降低,表明线粒体膜电位升高(图5B)。此外,在进行 TMRE 染色后还进行了流式细胞术检测,以检测线粒体膜电位。这些结果与 JC-1 染色的结果一致,JC-1 染色显示,沉默 circRREB1 会降低线粒体膜电位,而过表达 circRREB1 则会增加线粒体膜电位(图 5C、D)。我们还测量了细胞内的活性氧(ROS)水平,发现沉默 circRREB1 后 ROS 水平升高,而过表达 circRREB1 后 ROS 水平降低,这表明在沉默 circRREB1 后线粒体功能受损,在过表达 circRREB1 后线粒体功能增强(图 5E、F)。
线粒体自噬是通过特定方式专门针对受损线粒体进行的自噬过程,是调节线粒体功能的关键途径。我们使用 MitoTracker Green 和 LysoTracker Red 分别对线粒体和溶酶体进行标记,并观察线粒体与溶酶体的共定位情况,以探究 circRREB1 是否能调节线粒体自噬。我们发现,沉默 circRREB1 显著降低了线粒体与溶酶体的共定位,而过表达 circRREB1 则显著增加了这种共定位,这表明 circRREB1 能够正向调节线粒体自噬(图 5G、H)。PINK1/Parkin 途径是线粒体自噬的经典途径。我们进行了 WB 检测与 PINK1 介导的线粒体自噬相关的蛋白质。结果显示,沉默 circRREB1 降低了 PINK1、Parkin 和 LC3 的表达,并增加了线粒体外膜蛋白 TOM20 的表达。相比之下,过表达 circRREB1 增加了 PINK1、Parkin 和 LC3 的表达,并降低了 TOM20 的表达,这表明 circRREB1 能够在细胞水平上调节线粒体自噬(图 5I、补充图 S3A-D)。我们通过在异种移植组织上进行免疫组织化学检测,以评估 PINK1 和 Parkin 的水平,来探究 circRREB1 是否在体内促进线粒体自噬。结果发现,抑制 circRREB1 的表达会降低其水平(图 5J-L)。随后,我们从裸鼠的肿瘤组织中提取蛋白质,并进行蛋白质印迹实验以检测与线粒体自噬相关的蛋白质。与免疫组织化学结果一致的是,稳定抑制 circRREB1 显著降低与线粒体自噬相关的蛋白质的表达(补充图 S3E)。当同时抑制 m5C 读取器 ALYREF 并过表达 circRREB1 时,线粒体与溶酶体的共定位显示,m5C 修饰也调节了由 circRREB1 过表达引起的共定位增加(补充图 S3F、G)。当过表达 circRREB1 后,用自噬抑制剂氯喹(CQ)处理细胞,并检测活性氧(ROS)水平时,我们发现氯喹的加入抑制了自噬,导致 ROS 水平升高,表明受损线粒体的数量增加了(图 5M、N)。这些结果表明,circRREB1 通过线粒体自噬增强线粒体功能。我们添加了氯喹以抑制线粒体自噬,并检测了细胞凋亡的水平,以探究环状 RREB1 是否通过线粒体自噬来调控肺癌的发展,并发现添加氯喹能够逆转由环状 RREB1 过表达所导致的细胞凋亡减少现象(补充图 S3H、I)。总之,环状RREB1 可能通过 PINK1/Parkin 介导的线粒体自噬来调节线粒体功能,从而促进肺癌的发展。
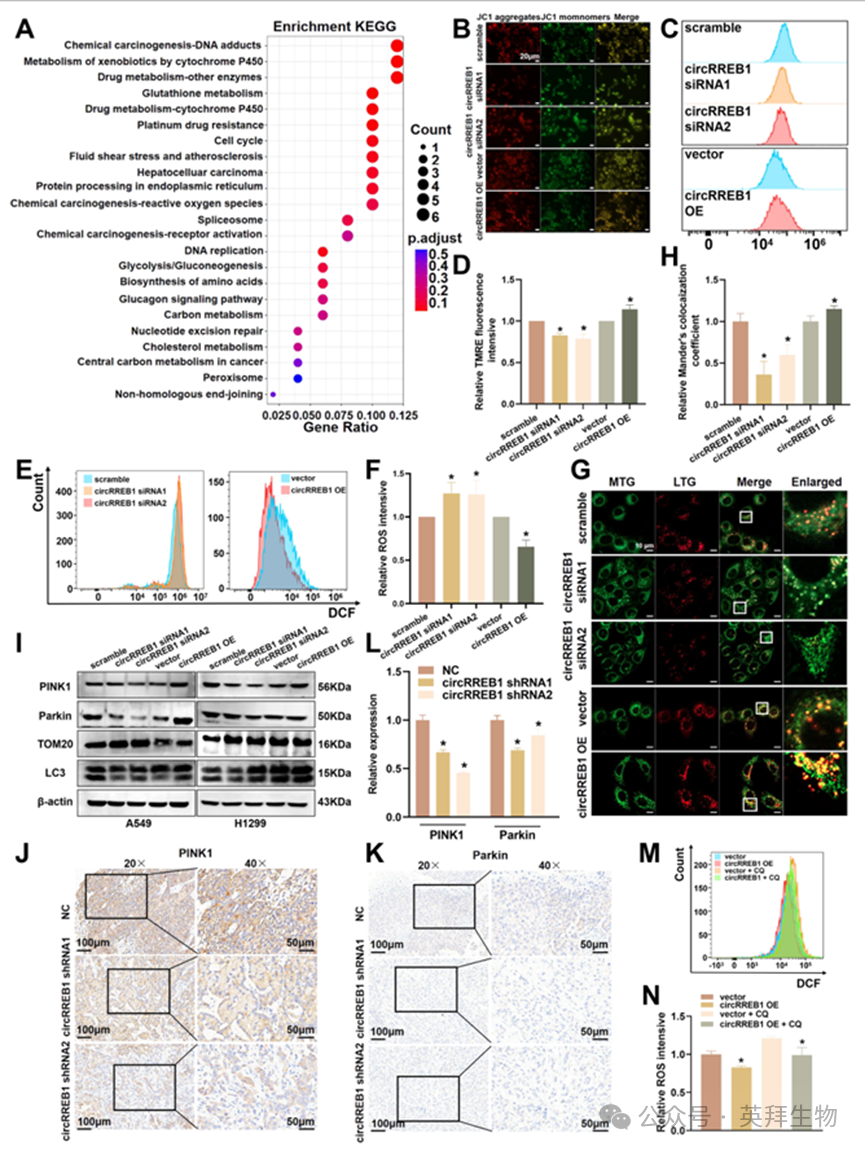
图5.circRREB1通过线粒体自噬调节线粒体功能
6.circRREB1与HSPA8蛋白结合,抑制其泛素化和降解
circRREB1 能够调节 PINK1/Parkin 介导的线粒体自噬过程,然而针对 circRREB1 的 TRAP-MS 结果并未包含 PINK1 蛋白,且沉默和过表达 circRREB1 并未显著改变 PINK1 的 mRNA 水平(补充图 S4A)。我们推测,circRREB1 可能通过中间蛋白在转录后水平调控 PINK1 的表达。因此,我们将与通过 TRAP-MS 识别的蛋白质相关的自噬相关基因进行交叉分析,创建了一个维恩图,并选择了 HSPA8 蛋白(图 6A)。在沉默和过表达 circRREB1 后,HSPA8 mRNA 的水平未发生变化(补充图 S4B)。因此,我们推测 circRREB1 可能直接与 HSPA8 蛋白相互作用,从而影响其表达。我们进行了 FISH 和 IF 实验,发现 circRREB1 和 HSPA8 共定位(图 6B)。与 IgG 相比,在 RIP 实验中,HSPA8 对 circRREB1 的结合更多(图 6C、D)。这些结果表明 circRREB1 直接与 HSPA8 结合。为确定 circRREB1 和 HSPA8 之间的结合区域,我们进行了 CLIP 实验。通过 CLIP 实验,我们发现 HSPA8 与 circRREB1 的第 13 区域结合(图 6E)。随后,我们利用 RBPMap预测了环状 RREB1 第 13 节段中的潜在蛋白质结合位点,并设计了针对这些结合区域的节段特异性引物以及相应的突变引物。CLIP 实验结果证实了环状 RREB1 与 HSPA8 之间存在特定的结合模式(图 6F、G)。
随后,我们进行了蛋白质印迹实验以检测 HSPA8 蛋白的表达情况,结果发现 circRREB1 能够正向调节 HSPA8 蛋白的表达(图 6H,补充图 S4C)。对来自裸鼠肿瘤组织提取的蛋白质进行的蛋白质印迹分析显示,在稳定沉默 circRREB1 的组中,HSPA8 的表达有所降低(图 6I)。通过免疫组织化学法,我们发现稳定沉默 circRREB1 后,其表达水平显著降低(图 6J,补充图 S4D)。通过查询 TCGA 数据库,我们发现肺癌患者中 HSPA8 的表达增加,且 HSPA8 高表达组的生存率低于低表达组,这与 circRREB1 作为致癌因子的作用一致(补充图 S4E,F)。由于 ALYREF 可以作为 circRREB1 的 m5C 修饰的读取蛋白来调节 circRREB1 的核输出,因此我们过表达 circRREB1 并同时沉默 ALYREF。在 ALYREF 被沉默后,circRREB1 的核输出减少,HSPA8 的表达也降低,这通过蛋白质印迹实验得以证实;值得注意的是,这些变化在 circRREB1 过表达的情况下又恢复了原状(图 6K、L)。
许多研究表明,circRNAs 可通过泛素-蛋白酶体途径调节蛋白质表达。首先,我们用 CHX 抑制蛋白质合成。与对照组相比,circRREB1 缺失组的 HSPA8 蛋白稳定性较差,半衰期更短(图 6M、补充图 S4G)。当我们添加蛋白酶体抑制剂 MG132 时,我们发现 circRREB1 无法调节 HSPA8 的表达(图 6N)。我们进行了共免疫沉淀实验,以进一步研究 circRREB1 对泛素化 HSPA8 水平的影响,结果发现,在 circRREB1 缺失的细胞中,泛素化 HSPA8 的水平显著增加(图 6O)。通过上述实验,我们阐明了 circRREB1 可以靶向 HSPA8 并通过控制其泛素化来调节其表达。我们进行了分子对接预测和共免疫沉淀实验,以确定 HSPA8 是否直接与 PINK1 结合,结果表明 HSPA8 可以直接与 PINK1 结合(图 6P、Q)。
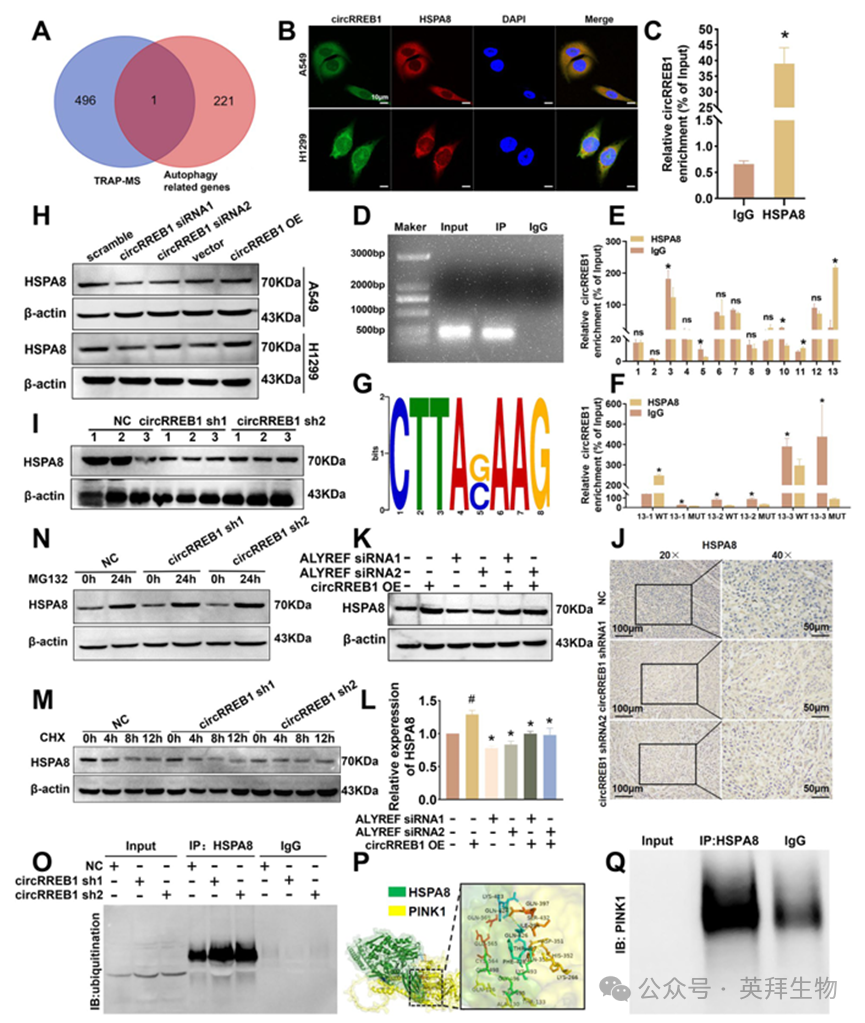
图6.circRREB1与HSPA8蛋白结合,抑制其泛素化和降解
7.circRREB1 通过 HSPA8 调节 PINK1/Parkin 介导的线粒体自噬,从而促进肺癌的发展
我们之前的研究表明,circRREB1 能够靶向并调节 HSPA8 蛋白的表达,而 HSPA8 能够直接与 PINK1 结合。我们设计了拯救实验,以探究 circRREB1 是否通过 HSPA8 来调节 PINK1 蛋白的表达,进而通过调节线粒体自噬来促进肺癌的发展。我们通过沉默 circRREB1 并同时过表达 HSPA8 来检测与 PINK1/Parkin 介导的线粒体自噬相关的蛋白质。WB 实验的结果显示,HSPA8 过表达逆转了因沉默 circRREB1 而导致的线粒体自噬相关蛋白质 PINK1、Parkin 和 LC3 表达的降低(图 7A,补充图 S4H-J)。
随后,我们抑制了 circRREB1 的表达,同时过量表达 PINK1,并进行了一系列功能测试,以探究 circRREB1 通过 PINK1 促进肺癌发展的能力。首先,我们通过检测线粒体与溶酶体的共定位来测定细胞中的线粒体自噬水平。结果表明,PINK1 过表达逆转了由 circRREB1 灭活所引起的线粒体自噬减少现象(图 7B,补充图 S4K)。我们进行了 EdU 检测以检测细胞增殖能力,并发现过表达 PINK1 逆转了由 circRREB1 灭活所引起的细胞增殖能力下降(图 7C,D)。我们使用流式细胞术检测细胞凋亡情况,结果表明 PINK1 过表达逆转了由 circRREB1 灭活所引起的细胞凋亡增加(图 7E,F)。我们进行了 Transwell 检测以检测细胞迁移能力,结果表明 PINK1 过表达逆转了由 circRREB1 灭活所引起的细胞迁移能力下降(图 7G,补充图 S4L)。总之,circRREB1 可通过靶向 HSPA8 增加 PINK1 的表达水平,从而引发线粒体自噬,并最终促进肺癌的发展(图 7H)。
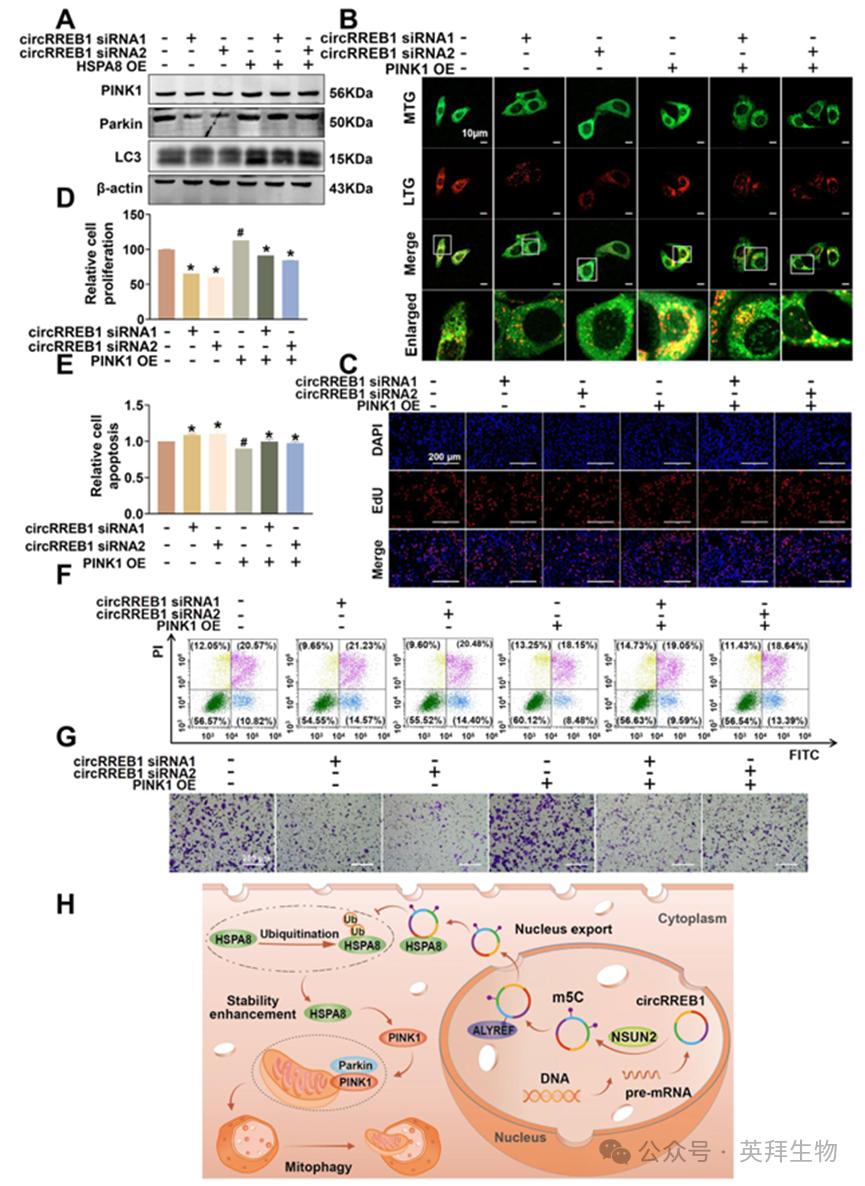
图7.circRREB1 通过HSPA8 调节 PINK1/Parkin 介导的线粒体自噬,从而促进肺癌的发展
结论
这项研究发现,circRREB1上存在m5C修饰,并表明m5C修饰的circRREB1能够诱导线粒体自噬,从而促进肺癌的发生。这些发现不仅为进一步探究肺癌发展背后的机制提供了理论依据,也为肺癌的治疗提供了潜在的靶点。
参考文献
Cai D, Chen X, Xu H, Zhao Q, Zhou X, Wu J, Yuan S, Gao Y, Li D, Zhang R, Peng W, Li G, Nan A. m5C-modified circRREB1 promotes lung cancer progression by inducing mitophagy. J Exp Clin Cancer Res. 2025 Jul 14;44(1):203. doi: 10.1186/s13046-025-03460-1. PMID: 40653497; PMCID: PMC12257754.

本周
本月
本年
单个细胞也能提取核酸?超全干货教你微量样本发高分(含完整电子版宝典资料))
LetPub发布最新SCI影响因子查询及期刊投稿分析系统
应用gentleMACS™灌流技术从脂肪肝小鼠模型高效分离肝细胞与非实质细胞
草甘膦(glyphosate)酶联免疫分析(ELISA)试剂盒使用说明书
ELISpot试剂盒限时特惠!一口价低至500元,加赠免费读板服务
LetPub完整SCI影响因子、期刊分区查询系统
Elabscience® 从原料到标记,打造属于中国自己的流式抗体品牌
链脲佐菌素 (Streptozotocin,STZ)-糖尿病动物模型造模
淋巴细胞百分比偏低原因解析
11月Cell重磅:新线粒体细胞死亡方式!或将引爆国自然新热点!先天免疫和代谢信号通过线粒体周膜裂解诱导线粒体依赖性膜裂解
- 促销公告
- 更多 ›
你可能感兴趣的产品
- mRNA m5C BS-seq技术服务,绘制单碱基分辨率m5C修饰图谱
- m6A全转录组测序(还提供m5C,m1A,m7G等RNA修饰测序)
- P62介导的线粒体自噬诱导剂,P62-mediated mitophagy inducer,1809031-84-2,**科研现货速达** HPLC 随货提供COA、HPLC谱图、MS谱图,NMR图谱等,详细联系客服。用于LC-MS/MS定量分析,代谢组学、质谱,药代动力学等
- FyMeso人间充质干细胞无血清培养基(chemical defined)
- 冷冻研磨仪/低温冷冻研磨仪/组织研磨仪
- 美国PE耗材配件珀金埃尔默GC色谱耗材
- 外泌体提取纯化试剂盒(组织、细胞上清、血液、尿液等)
- RNA快速提取试剂盒(带DNA清除柱 )
- BVC professional 真空吸液系统(废液处理器)
- 链酶蛋白酶浓缩液(20X)
- 氘灯Waters 486 D2 lamp 2000时
- Merck默克化学试剂一级代理


