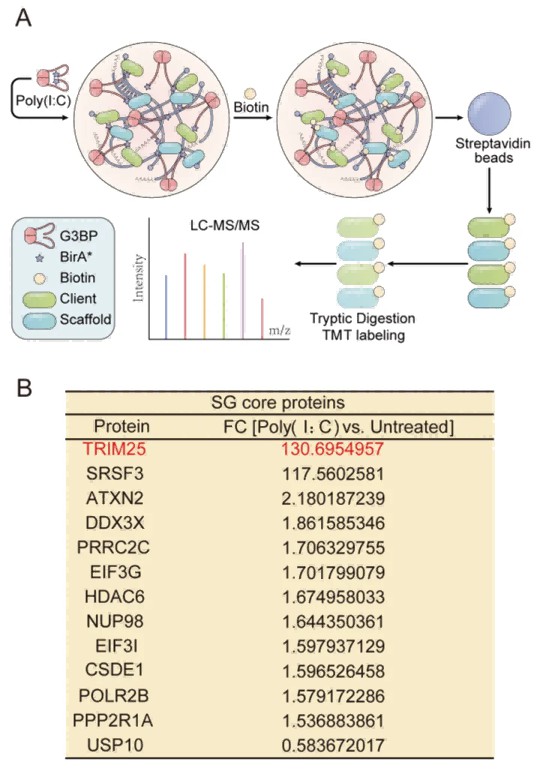
文献速递|Cell 封面:应激颗粒异常互作介导 CMT2 周围神经病变的共同机制
仪景通
2023 年 2 月 3 日,浙江大学医学院脑科学与脑医学学院白戈课题组与合作者在 Cell 杂志 ( IF = 66.850 (2022) / JCR 分区: Q1 ) 以封面文章形式在线发表研究论文。该工作发现虽然在正常生理状态下不同 CMT 致病蛋白在细胞中的定位各异,但在应激状态下这些 CMT 致病蛋白会表现出相同的细胞定位,进入应激颗粒中并与其核心蛋白 G3BP 发生异常互作,引起应激颗粒异常,使得周围神经应对环境不良刺激的能力下降,从而导致周围神经病的发生。

该研究首先使用浙江大学医学院公用技术平台奥伟登(Evident)FV3000 激光共聚焦显微镜 ~K~Hspan~M~Kspan~M奥伟登(Evident)现已推出全新共聚焦显微镜,在 HeLa 细胞、鸡胚运动神经元和小鼠原代培养运动神经元中确定了导致 CMT2D 亚型的 GlyRS 蛋白能够在应激状态下进入到应激颗粒中(图 1),同时利用该显微镜的时间序列和 FRAP 成像模块获得数据揭示了 GlyRS 致病蛋白对神经元生长长度的影响及 GlyRS 致病蛋白对应急颗粒动态性的影响。
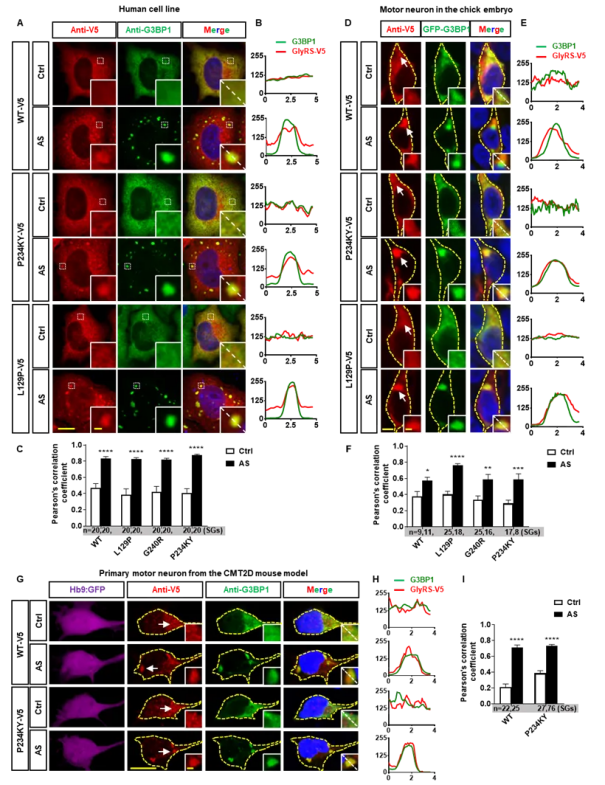
图 1. GlyRS 蛋白在应激下定位到 SG 中。
A-C:HeLa 细胞中野生型和突变型的 GlyRS 蛋白在应激状态下进入到 SG 中,并与 SG 核心蛋白 G3BP1 发生共定位;D-F:在鸡胚脊髓运动神经元中验证体内 GlyRS 与 G3BP1 蛋白共定位;G-I:在小鼠原代培养运动神经元中确定了內源性 GlyRS 与 G3BP1 蛋白发生共定位。
随后研究人员通过活细胞荧光成像、邻近标记、定量蛋白质谱、STORM 超分辨成像等技术发现,GlyRS 突变蛋白与 G3BP 的异常相互作用不会影响 SG 组装-解聚的动态变化,却会显著干扰以 G3BP 为核心的 SG 蛋白网络,导致大量非 SG 组分异常滞留在 SG 中,从而扰乱了细胞正常的应激反应,导致运动神经元抵御外界不良环境刺激的能力明显下降,更易发生轴突退变(图 2)。
研 究 人 员 还 进 一 步 鉴 定 出 了 GlyRS 突 变 蛋 白 与 G3BP 的 结 合 位 点 位 于 其 「 内 在 无 序 区 」(Intrinsically disordered region, IDR),通过破坏二者的异常结合,能够消除 GlyRS 突变蛋白对 SG 的干扰,改善运动神经元抵抗不良环境刺激的能力,有效缓解 CMT2D 小鼠模型的疾病症状(图 2)。
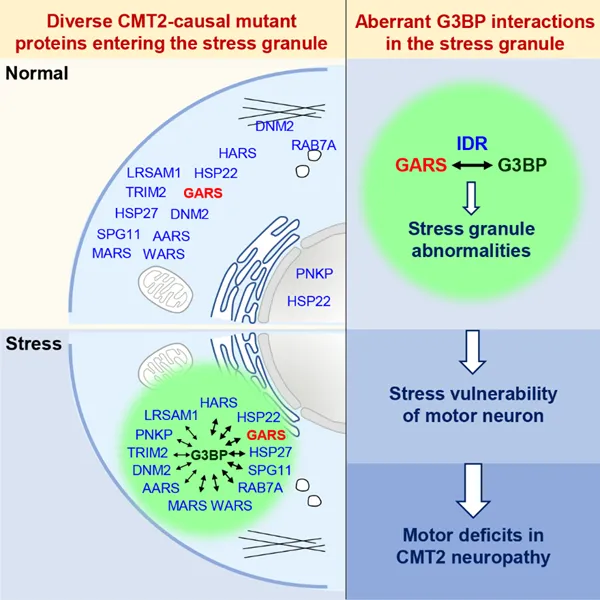
图 2. 不同 CMT2 蛋白的共性致病机制
最后,研究人员还发现这个机制可以进一步扩展到其他 CMT2 亚型。通过对 20 几种不同类型 CMT2 致病蛋白进行测试,研究人员发现这些原本定位在细胞内不同部位的蛋白质,在应激条件下大部分都可以进入 SG 并且与 G3BP 发生异常相互作用,引起 SG 异常,导致运动神经元应对环境不良刺激的能力下降。这些发现表明应激颗粒异常很可能是介导不同亚型 CMT 的共性致病机制(图 2)。综上,该工作揭示了应激颗粒异常是介导不同亚型 CMT 的共同致病机制,为针对多亚型 CMT 的广谱治疗药物的开发提供了重要理论基础,也为其他疾病遗传异质性的机制研究提供了新的思路。
本文中多色荧光标记的细胞图像都是采用奥伟登(Evident)激光扫描共聚焦 FV3000 拍摄。FV3000 的全真光谱技术可以自由调整标记荧光信号的收集波段,并有效防止不同标记之间的荧光串扰,帮助用户获取更加真实可靠的数据。另外,本文还利用 FV3000 观察了活细胞中的 G3BP1 液滴以及通过 FRAP 实验验证了其相分离特性。FV3000 灵活高效的龙卷风光刺激模式以及追踪运动中的液滴并分析其漂白区域荧光强度变化的功能,是帮助用户进行相分离研究的利器。
参考文献
- K. E. Attfield, L. T. Jensen, M. Kaufmann, M. A. Friese, L. Fugger, The immunology of multiple sclerosis. Nat Rev Immunol 22, 734-750 (2022).
- J. Niu et al., Aberrant oligodendroglial-vascular interactions disrupt the blood-brain barrier, triggering CNS inflammation. Nat Neurosci 22, 709-718 (2019).
3.J. Niu et al., Oligodendroglial ring finger protein Rnf43 is an essential injury-specific regulator of oligodendrocyte maturation. Neuron 109, 3104-3118 e3106 (2021).
- Saxena, S. and P. Caroni, Selective neuronal vulnerability in neurodegenerative diseases: from stressor thresholds to degeneration. Neuron, 2011. 71(1): p. 35-48.
- Goldman, S.M., Environmental Toxins and Parkinson's Disease. Annual Review of Pharmacology and Toxicology, 2014. 54(1): p. 141-164.
- Protter, D.S.W. and R. Parker, Principles and Properties of Stress Granules. Trends in Cell Biology, 2016. 26(9): p. 668-679.
- Kedersha, N., P. Ivanov and P. Anderson, Stress granules and cell signaling: more than just a passing phase? Trends Biochem Sci, 2013. 38(10): p. 494-506.
- Wolozin, B. and P. Ivanov, Stress granules and neurodegeneration. Nat Rev Neurosci, 2019. 20(11): p. 649-666.
- Li, Y.R., et al., Stress granules as crucibles of ALS pathogenesis. J Cell Biol, 2013. 201(3): p. 361-72.
- Murakami, T., et al., ALS/FTD Mutation-Induced Phase Transition of FUS Liquid Droplets and Reversible Hydrogels into Irreversible Hydrogels Impairs RNP Granule Function. Neuron, 2015. 88(4): p. 678-90.
- Motley, W.W., K. Talbot and K.H. Fischbeck, GARS axonopathy: not every neuron's cup of tRNA. 2010. 33(2): p. 59-66.
- Antonellis, A., et al., Functional analyses of glycyl-tRNA synthetase mutations suggest a key role for tRNA-charging enzymes in peripheral axons. J Neurosci, 2006. 26(41): p. 10397-406.
- Nangle, L.A., et al., Charcot-Marie-Tooth disease-associated mutant tRNA synthetases linked to altered dimer interface and neurite distribution defect. Proc Natl Acad Sci U S A, 2007. 104(27): p. 11239-44.