文献速递|Nature Communications:TRIM25 通过相分离调控抗病毒应激颗粒形成及先天免疫应答
仪景通
2024 年 5 月 15 日,四川大学生物治疗全国重点实验室贾大课题组与合作者在 Nature communications 杂志 ( IF = 16.6 (2023) / JCR 分区: Q1 ) 在线发表了题为「TRIM25 predominately associates with anti-viral stress granules」的研究论文。该工作利用 G3BP1 邻近蛋白生物素化标记实验发现 TRIM25 是抗病毒 SG 的有效标记物。课题组成员发现 TRIM25 会独立发生 LLPS 现象,而 dsRNA 的存在会显著增强这种反应。Poly(I:C) 处理和 RNA 病毒感染都会引发 TRIM25 和 G3BP1 的共相分离,从而显著提高 TRIM25 对底物的泛素化活性,其中许多底物都定位于 SGs 中。TRIM25 和 G3BP1 的共相分离对激活 RIG-I 信号通路和限制 RNA 病毒感染至关重要。该研究不仅为抗病毒信号通路的调控提供了新的见解,而且为研究应激特异性 SG 亚型的组成、动态和功能建立了一个研究范式。

该研究首先采用了一种邻近生物素化标记(BioID)方法(图 1)来鉴定 poly(I:C) 刺激下的 G3BP1 相互作用网络。在 937 个差异蛋白中,有 181 个属于以前鉴定的 SG 蛋白成分,包括许多 SG 核心蛋白,如 HDAC6 和 DDX3X。有趣的是,TRIM25 在所有蛋白中增加最为显著,它是一个泛素化依赖性抗病毒先天免疫反应的驱动蛋白,经 poly(I:C) 处理后富集了 130 倍(图 1)。这意味着,poly(I:C) 处理会刺激 TRIM25 被招募到 SG(即抗病毒 SG)中。
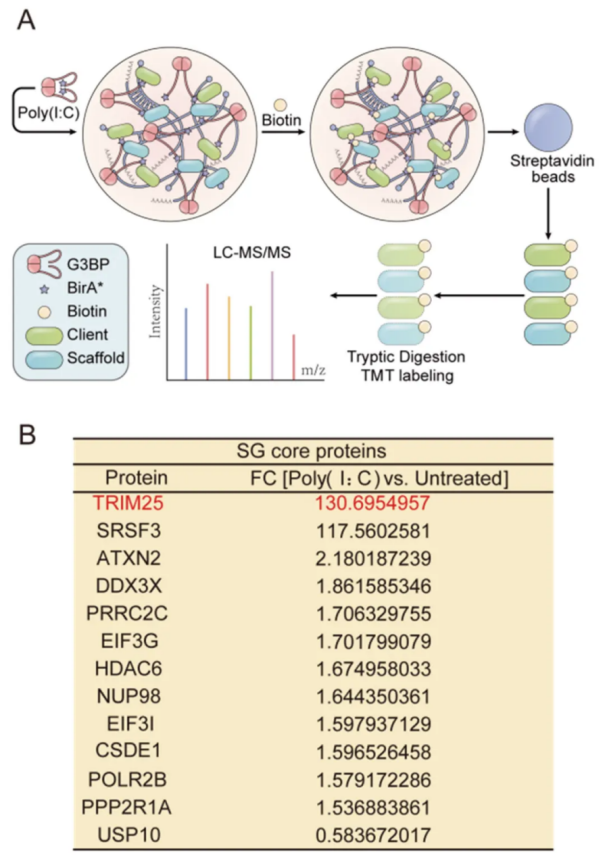
图 1. G3BP1 的邻近蛋白标记组鉴定到 TRIM25 是受 poly(I:C) 处理富集的 SG 核心蛋白。
(A) G3BP1 BioID 方法与基于 TMT 的定量蛋白质组学相结合的示意图;(B) 如 (A) 中所确定的,由 poly(I:C) 处理诱导的 SGs 核心蛋白列表。
随后,研究人员为了探究 poly(I:C) 处理导致的 TRIM25 被招募到 SG 中是否有特异性,使用各种应激诱导剂,系统地处理了过表达 GFP-TRIM25 的 HeLa 细胞:RNA 病毒入侵(仙台病毒,SeV)、外源 dsRNA 应激(poly(I:C))、氧化应激(亚砷酸钠)、ER 应激(毒胡萝卜素)、翻译抑制(嘌呤霉素)、蛋白酶体抑制(MG132)、能量耗竭(CCCP)、热休克和渗透压应激(山梨醇)。并使用四川大学华西第二医院技术平台奥伟登(Evident)FV3000 激光共聚焦显微镜检测 TRIM25 与 G3BP1 颗粒的共定位状态。不出所料地,所有诱导剂都轻易地诱导 G3BP1 阳性颗粒的形成。有趣的是,虽然在多种条件下都能观察到 TRIM25 点状聚集,但只有当细胞感染 SeV 或用 poly(I:C) 处理时,TRIM25 和 G3BP1 才会形成共定位的点状物(图 2)。
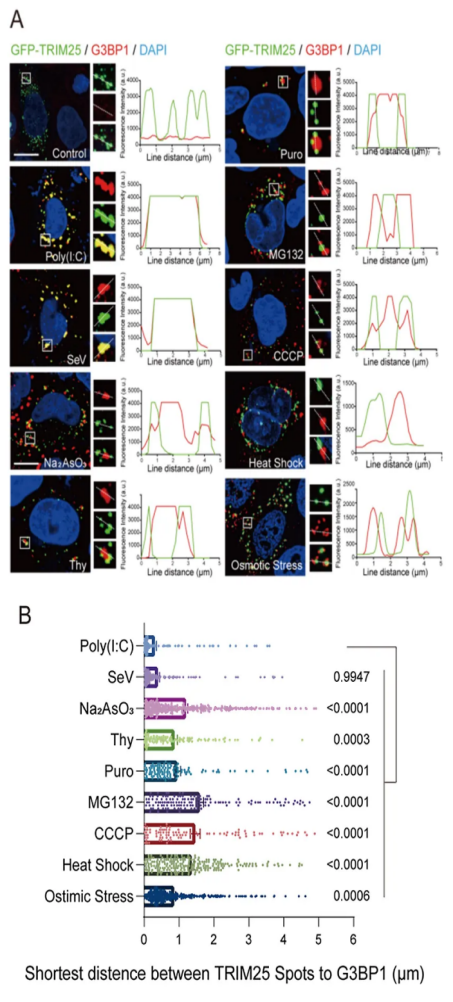
图 2. TRIM25 仅在 poly(I:C) 和 SeV 处理下与 G3BP1 共定位。
(A) 具有代表性的荧光显微镜图像显示了在各种应激条件下 TRIM25 与 HeLa 细胞中内源性 G3BP1 的共定位;(B) TRIM25 和 G3BP1 病灶之间的最短距离。在 HeLa 细胞中,各种应激类型如(A)所示,在所有应激类型中,Sev 感染和 poly(I:C) 处理导致的距离最短。
然后,为了确定 TRIM25-G3BP1 相互作用是如何促成其共相分离发生的,研究人员构建了一系列 TRIM25 截短突变体,并将「PTFG」鉴定为 TRIM25 结合 G3BP1 所需的最小氨基酸片段(数据未展示)。将 mCh-TRIM25(WT 或 ∆PTFG)和 GFP-G3BP1 共转染到 HeLa 细胞中,并使用四川大学生物治疗全国重点实验室平台奥伟登(Evident)SpinSR 转盘共聚焦(奥伟登(Evident)现已推出全新 IXplore IX85 SpinSR 转盘共聚焦显微镜)快速成像和快速超高分辨率系统进行活细胞成像,观察 TRIM25 液滴和 SGs 的动态特征。TRIM25 WT 和 G3BP1 液滴在 poly(I:C) 转染后不到 5 小时就出现了,并显示出很强的共定位(图 3)。相比之下,TRIM25 ∆PTFG 液滴的形成明显延迟,直到 poly(I:C) 处理后 8 小时才被观察到(图 3)。TRIM25 ∆PTFG 与 G3BP1 之间的共相分离倾向远低于 TRIM25 WT 与 G3BP1(图 3)。免疫荧光实验进一步证实了这些观察结果(图 3)。
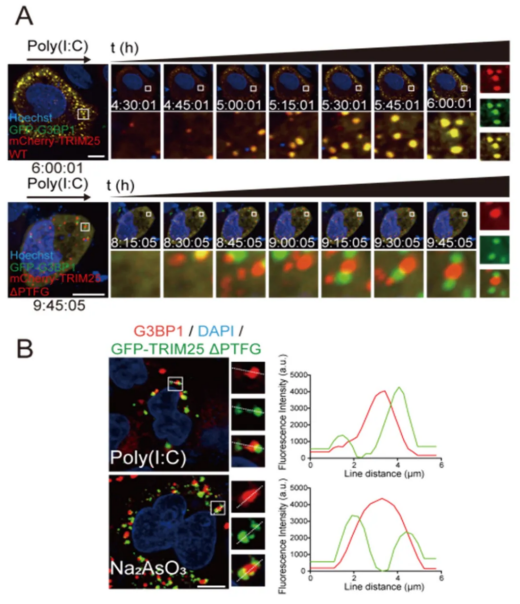
图 3. PTFG 序列是 TRIM25 与 G3BP1 形成共相分离所必需的。
(A) 转染 poly(I:C) 后 G3BP1(绿色)和 TRIM25 WT 或 ∆PTFG(红色)点状颗粒形成的延时显微照片,以及转染后 6 小时或 10 小时斑点的放大图像。比例尺:10 µm。插图:白色框内区域的放大图;(B) TRIM25 的 PTFG 基序是与 HeLa 细胞中的 G3BP1 共定位所必需的。细胞转染了 GFP-TRIM25 ∆PTFG 而不是 TRIM25 WT。比例尺:10 μm。
最后,研究人员发现 TRIM25 和 G3BP1 的共相分离对调节 RIG-I 信号通路至关重要。使用定量 RT-PCR (qPCR) 方法测定干扰素通路中多个关键基因的 RNA 水平。研究人员发现经 poly(I:C) 处理后,TRIM25 WT 能显著增强 IFNα、IFNβ、IFNγ 和 ISG56 的表达。相反,转染 TRIM25 PTFGAAAA 或∆PTFG 后,这些 IRF3 依赖性基因的表达则不被增强(图 4)。
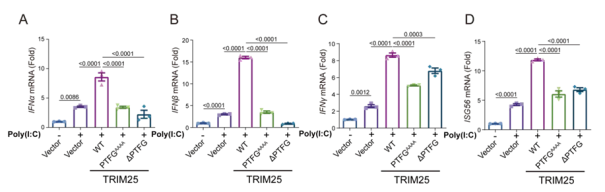
图 4. TRIM25-G3BP1 共相分离激活 RIG-I 介导的先天免疫 (A-D) 用 TRIM25 WT、TRIM25 PTFGAAAA 或∆PTFG 转染 HEK293T 细胞,然后用 poly(I:C) 处理 12 小时。用 qPCR 测定 IFNα (A)、IFNβ (B)、IFNγ (C) 和 ISG56 (D) 的 mRNA 水平。
综上,本文作者通过邻近标记 G3BP1 蛋白互作组结合活细胞成像与无膜细胞器的亚细胞定位分析的方法将 TRIM25 鉴定为应激颗粒中承担抗病毒功能的重要成分。该工作构建了一个研究应激颗粒亚型的研究框架,有助于开发更有针对性的疗法来治疗与应激有关的疾病。
本文中多色荧光标记的细胞图像都是采用奥伟登(Evident)激光扫描共聚焦 FV3000 拍摄。FV3000 的全真光谱技术可以自由调整标记荧光信号的收集波段,并有效防止不同标记之间的荧光串扰,帮助用户获取更加真实可靠的数据。另外,本文还利用 FV3000 观察了活细胞中的 G3BP1 液滴以及通过 FRAP 实验验证了其相分离特性。FV3000 灵活高效的龙卷风光刺激模式以及追踪运动中的液滴并分析其漂白区域荧光强度变化的功能,是帮助用户进行相分离研究的利器。
四川大学生物治疗全国重点实验室贾大研究员与四川大学基础与法医学院 Peng Bai 为本文的共同通讯作者。硕士生尚泽华,博士生张思韬、王瑾瑞为本文共同第一作者,苏州大学博士生周莉莉、四川大学华西生物治疗国重创新班本科生张欣悦也为本研究做出重要贡献。本研究还得到了周芳芳、杨培国、Daniel D. Billadeau、张令强等教授的大力支持,并得到了李丕龙教授的指导和帮助。