酶活性分析法检定蛋白质:表现出来的酶GUS可以水解其基质衍生物pNPG,所产生的黄色生成物p-nitrophenol,可供活性测定 (Jefferson et al, 1986);
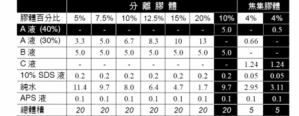
SDS 平板胶片铸造︰1) 整理出两组玻璃片及白板铸胶组合,先用酒精拭净,并选择合适的间隔条(0.75 mm) 组合起来。请熟悉铸胶三明治组合的正确组装方式,以免灌入的胶液漏出来。2) 三明治组合后直立站好,准备所要浓度的SDS 胶体溶液如表4.2. 两片0.75mm 厚的平板胶片约需10 mL 分离胶体溶液,以及5 mL 焦集胶体溶液。APS液到最后才加入,未加APS 以前可在真空中抽去溶液中的气体……
蛋白质经SDS-PAGE后,胶片浸入转印缓冲液,蛋白质可被转印到硝化纤维纸(nitrocellulose) 上,先经尿素洗去SDS,并使蛋白质回复原态抗原性,可使用抗体进行免疫染色 (Towbin et al, 1979)。
蛋白质折叠软件
Western-Blotting方法:膜的准备:将PVDF膜切成条浸在甲醇中,室温条件下在摇床上摇1min,去除甲醇后加入1×TBST备用。B. 膜转印:1. 细胞或组织裂解液进行SDS-PAGE电泳2. 用夹心法电转至PVDF膜3. 海绵和滤纸浸泡在转印缓冲液预湿润……
固相多肽合成就是不断地在固相载体上加入α-氨基和侧链基团被保护的氨基酸。FMOC基团是用来保护α-氨基中的N的,去除保护基团后,再加入第二个氨基酸。产生的多肽通过一个连接臂将C端连接在树脂上,它可以被裂解下来。通常情况下,在多肽从树脂上裂解下来的同时去除侧链保护基团,一般采用哌啶去FMOC保护基团,肽树脂的裂解和侧链保护基团去除一般用强酸,比如三氟乙酸,N,N-二甲基甲酰胺(DMF)是树脂去保护、氨基酸反应和洗涤的首选溶剂。
众所周知,膜蛋白在细胞间接触、表面识别、信号转导、酶活性和运输方面都扮演着重要的角色。由于它们功能多样,也就成为理想的药物靶点。然而,膜蛋白的生化和结构研究一直都很缓慢。Protein Database的统计数据表明,在成功解析出三维结构的蛋白中,膜蛋白只占1%,这与膜蛋白占总蛋白的1/3的总量的差别巨大。由此也可以看出膜蛋白研究确实困难重重。
该方法是双缩脲法的发展,包括两步反应:(1)在碱性条件下,蛋白质与铜作用生成蛋白质—铜络合物。(2)此络合物将试剂磷钼酸—磷钨酸(FolIn试剂)还原,混合物深蓝色(磷钼蓝和磷钨蓝混合物),颜色深浅与蛋白质含量成正比。此方法操作简便,灵敏度比双缩脲法高100倍,定量范围为5~100μg蛋白质。FolIn试剂显色反应由酪氨酸、色氨酸、半胱氨酸引起,因此样品中若含有酚 ...
LoWry法是双缩脲法(BIureT)和福林酚法(Folin-酚)的结合与发展。其原理是蛋白质溶液用碱性铜溶液处理后,碱性铜试剂与蛋白质中的肽键作用产生双缩脲反应,形成铜—蛋白质的络合盐。再加入酚试剂后,在碱性条件下,这种被作用的蛋白质上的酚类基团极不稳定,很容易还原酚试剂中的磷钨酸和磷钼酸(PHosPHoMolyBdATe & PHosPHoTungsTATe),使之生成磷钨蓝和磷钼蓝的混合物。这种溶液蓝色的深浅与蛋白的含量成正相关,所以可以用于蛋白质含量的测定。LoWry法除使肽链中酪氨酸、色氨酸和半胱氨酸等显色外,还使双缩脲法中肽键的显色效果更强烈,其显色效果比单独使用酚试剂强3~15倍,约是双缩脲法的100倍。由于肽键显色效果增强,从而减少了因蛋白质种类不同引起的偏差。LoWry法适于微量蛋白的测定,对多个样品同时测定较为方便。但对不溶性蛋白和膜结合蛋白必须进行预处理(如加入少量的SDS)。
有三种常用的非变性聚丙烯酰胺凝胶电泳方法:blue native(BN-PAGE),clear native(CN-PAGE),quantitative preparative native continuous(QPNC-PAGE)。在一个典型的native PAGE方法中,复合物被CN-PAGE或BN-PAGE分离。然后可以用其它分离方法如SDS-PAGE或等电聚焦做进一步分离。随后切割凝胶,蛋白复合物每一个部分都被分开。蛋白的每个条带可以消化后做肽链指纹图谱或重新测序。这样就可以提供一个蛋白复合物中单个蛋白的重要信息。
细胞中有大约30%的蛋白质是膜蛋白,不过人们现在还不是很清楚这些膜蛋白的原子结构。到目前为止,在PDB(Protein Data Bank)的结构数据库中只有不到1%的资料是膜蛋白的结构数据。这不是说膜蛋白的结构不重要,相反,膜受体蛋白非常重要,它们是大部分药物的作用靶点。但由于一直缺乏很好的膜蛋白大量可溶性表达技术,因此也就得不到足够的蛋白结晶体用于结构分析。即使是结构基因组学(文后小词典)这项旨在分析每一个蛋白家族结构的学科,也因为存在技术难题而没有将研究重点放在膜蛋白上。现在,经过传统结构生物学家和结构基因组学家的不懈努力,蛋白表达、溶解和结晶这一系列的技术瓶颈都得到了突破,并且已经出现了部分成果。
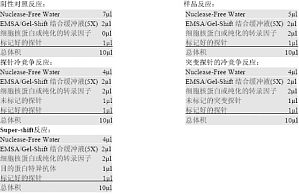
1. 探针的标记:(1) 如下设置探针标记的反应体系:待标记探针 (1.75pmol/微升) 2微升T4 Polynucleotide Kinase Buffer (10X) 1微升nuclease-Free Water 5微升ATP(3,000Ci/mmol at 10mCi/ml) 1微升T4 Polynucleotide Kinase (5-10u/微升) 1微升总体积 10 ...
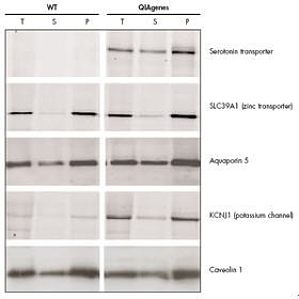
Western Blot 印迹法是把通过电泳分离的蛋白质组分从凝胶转移至一种固相支持物,通过抗体与附着于固相支持物的靶蛋白的抗原表位发生特异性反应进行检测。Western Blot 既可以定性,又可以半定量,是初步鉴定靶蛋白表达的最方便也是最通用的方法。
动物细胞或组织的蛋白质的抽提步骤
微管蛋白的可溶性表达及纯化
1. Resolve sample proteins and controls via polyacrylamide gel electrophoresis. Transfer proteins to nitrocellulose using standard methods. 2. Remove the blot from the transfer apparatus and soak in T ...
SDS—聚丙烯酰胺凝胶电泳
聚酮的生物合成基本原理
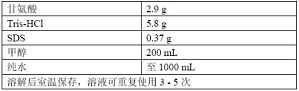
1. 溶液准备: 转印缓冲液:0.025M Tris base , 0.192 M甘氨酸 , 30%甲醇 10×TBST:250mM Tris-HCl ( pH 8.0 ) , 1.25M NaCl , 0.5%Tween20 封闭液:1×TBST , 3%脱脂奶粉 洗涤液:1×TBST 2. 实验程序: A. 膜的准备: 将PVDF膜切成条浸在甲醇中,室温条件 ...
由于用X光晶体衍射和NMR核磁共振技术测定蛋白质的三维结构,以及用生化方法研究蛋白质的功能效率不高,无法适应蛋白质序列数量飞速增长的需要,因此近几十年来许多科学家致力于研究用理论计算的方法预测蛋白质的三维结构和功能,经过多年努力取得了一定的成果。 蛋白质三维结构的预测方法通常包括:同源性建模和从头开始的预测方法。对数据库中已知结构的序列的比对是预测未知序列三级结构的主要方法,也即同源建模的方法。 ...