简介
尽管现在很多一步法构建载体的试剂盒说明书中都提到可以使用 PCR 产物直接进行连接,不需要进行胶回收纯化,但是在有些情况下,体系中的杂质会降低片段与载体的连接效率。对于难以连接的片段,纯化后的连接效率会大大提高。
原理
与基因组 DNA 纯化或质粒 DNA 纯化类似,从琼脂糖凝胶中或 PCR 体系、酶切体系中回收纯化 DNA 也可以使用硅胶膜纯化技术来进行纯化。片段 DNA 可以被硅胶膜选择性吸附,并且在高盐缓冲液下漂洗去除杂质,并使用低盐缓冲液进行洗脱。
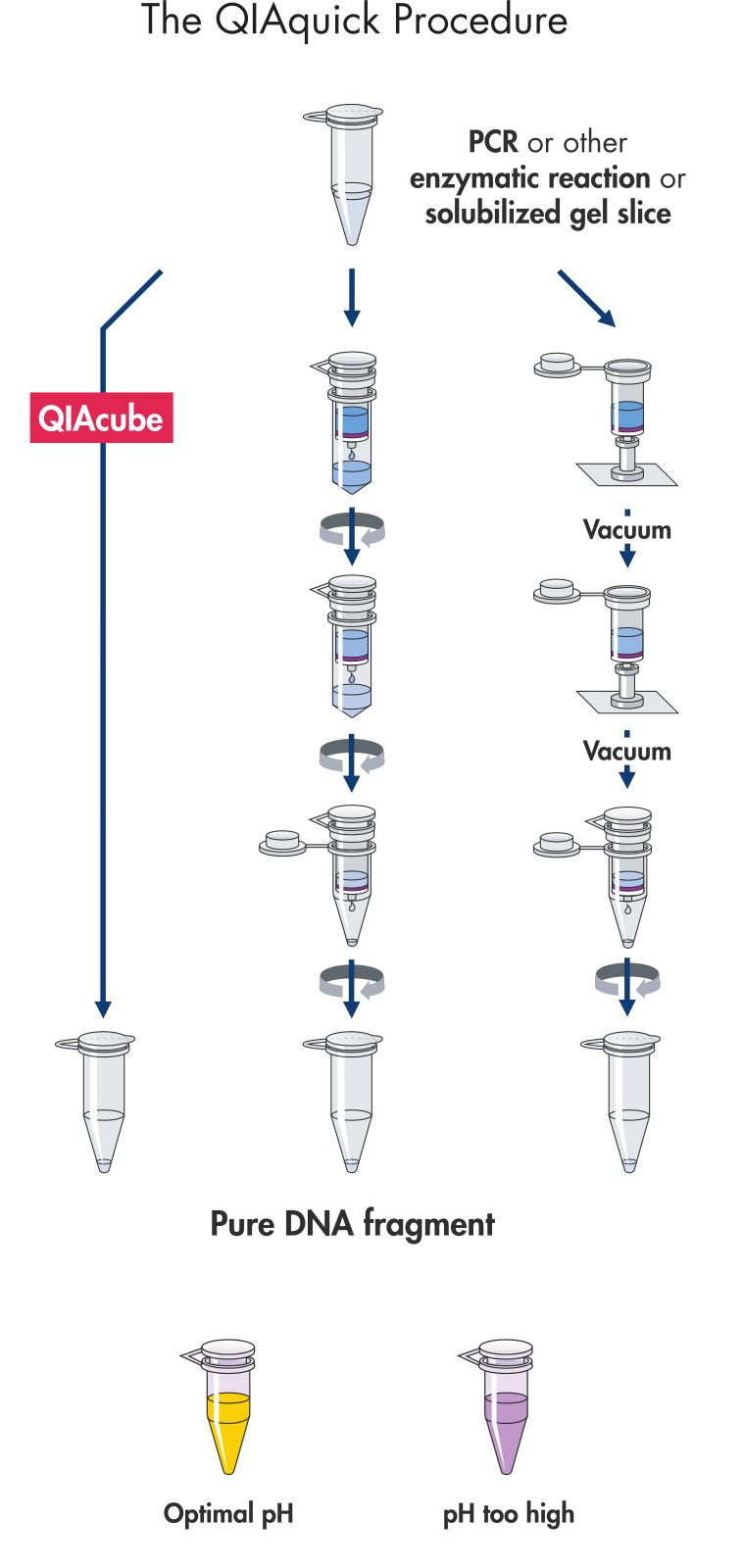
例如,使用 QIAquick 纯化程序可以从琼脂糖凝胶(最多 400 mg)或酶切体系以及 PCR 体系中去除核苷酸、酶、盐、琼脂糖、溴化乙锭和其他杂质,从而得到纯化后的 DNA 片段。简单快速的结合-洗涤-洗脱程序和 30–50 µl 的洗脱体积,可纯化得到 70 bp 至 10 kb 的 DNA,回收效率高达 95%。
材料与仪器
QIAquick Gel Extraction Kit(QIAGEN)/
QIAquick PCR Purification Kit(QIAGEN);
一次性手套;10 μl、200μl 无菌枪头;
1.5 ml EP 管;
镊子、刀片;
异丙醇、3M 乙酸钠;
震荡涡旋仪、电泳仪、切胶仪;
加热模块或水浴锅;
步骤
实验开始前准备工作:
将 96-100% 乙醇加入到 PE 缓冲液中;
所有离心步骤均在微量离心机中以 17,900 x g(13,000 rpm)的速度进行;
以电泳后的凝胶样品为例:
1) 取洁净、锋利的刀片将 DNA 目的片段从琼脂糖凝胶上切下,转移凝胶至一透明干净的 EP 管中;
2) 对含有凝胶切块的 EP 管进行称量,加入 3 倍体积的 QG Buffer (eg:100 mg 凝胶~100uL,所以加入 300 μl QG Buffer)(注意:对于>2% 的凝胶,加入 6 倍体积的 QG Buffer);
3)50℃ 孵育 10 min(或者至到凝胶融化),期间每 2~3 min 用震荡涡旋仪震荡一次以帮助溶解凝胶(如果混合物的颜色为橙色或紫色,则加入 10μl 3M 乙酸钠,pH 5.0,并混合,混合物变黄);
4) 向样品中加入 1 凝胶体积的异丙醇并混合;
5) 将硅胶模纯化柱放入提供的 2 ml 收集管,随后将样用移液枪转移到 硅胶模纯化柱上并离心 1 分钟;弃掉流出液,将硅胶模纯化柱放回同一管中。如果样品体积 >800 μl,可按照该步骤再次操作一遍;
6) 洗涤,将 750 μl PE 缓冲液添加到硅胶模纯化柱中并离心 1 分钟;丢弃流出液,将硅胶模纯化柱放回同一管;
7) 将硅胶模纯化柱放入干净的 1.5 ml 微量离心管中;
8) 洗脱,加入 50 μl EB 缓冲液(10 mM Tris·Cl,pH 8.5)或无酶水到硅胶模纯化柱膜中心,静置 1 分钟;
9) 用干净的 1.5 ml 或 2 ml 无菌离心管收集纯化后的片段 DNA,后续 DNA 可保存在-20℃;
注意事项
a. 每种胶回收试剂盒中回收柱的承载量有限,避免胶块过大超过回收柱承载量,导致 DNA 回收率效率低;
b. 切胶时紫外照射时间过长,容易导致 DNA 片段断裂,损伤的 DNA 难以与回收柱结合,导致效率下降。解决方案:尽量使用 302nm 长波长紫外灯(对 DNA 损伤小),并缩短照射时间(从切胶到放入溶胶 buffer 控制在 30 秒内),或使用蓝光染料及蓝光切胶仪;
c. 琼脂糖凝胶浓度不合适会导致 DNA 回收效率低:凝胶浓度过高(如 > 2%)会导致 DNA 片段嵌入过紧,难以从胶中释放;浓度过低(如 < 0.8%)则凝胶易碎,切胶时易混入杂质,且 DNA 扩散严重。解决方案:根据目的片段大小调整凝胶浓度(100-500bp 用 1.5-2%,500-2000bp 用 1-1.5%,2000-10000bp 用 0.8-1%),确保 DNA 条带清晰且易于释放;
d. 溶胶不彻底导致琼脂糖未完全溶解,DNA 无法充分释放到溶液中。建议严格按试剂盒比例添加溶胶 buffer,50-60℃ 水浴加热溶胶,期间每隔 2-3 分钟颠倒混匀一次,直至胶块完全溶解。
e. 不同试剂盒对特定长度的 DNA 回收率不同,例如 QIAquick Gel Extraction Kit 可以可纯化得到 70 bp 至 10 kb 的 DNA,回收效率高达 95%;MinElute PCR Purification Kit 可以洗脱纯化 70bp-4kb 的 DNA 产物,根据目的片段长度选择合适的试剂。
内容来源:QIAGEN 凯杰
来源:丁香实验