相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 提供商:
云舟生物科技(广州)股份有限公司
- 服务名称:
定制载体、对照载体
Cas9是一类RNA引导的DNA核酸酶的成员,它们是天然原核免疫系统的一部分,可赋予对外来遗传元素(如质粒和噬菌体)的抗性。在细胞内,Cas9酶与引导RNA(gRNA)形成复合物,通过与基因组中同源的18-22nt靶序列直接相互作用提供靶向特异性。gRNA与靶位点的杂交定位Cas9,然后切割基因组中的靶位点。
为了实现CRISPR介导的基因靶向,靶细胞必须同时共表达Cas9和靶位点特异性gRNA。这可以通过表达来自同一载体(又名多合一载体)的Cas9和gRNA序列或使用单独的载体来驱动Cas9和gRNA表达(分别为仅Cas9和仅gRNA载体)来实现。使用一体化载体表达Cas9和gRNA的优势在于,它提供了使用单一载体将CRISPR介导的基因编辑所需的所有组分递送到细胞的机会,这在技术上是直接的。使用单独的载体表达Cas9和gRNA需要将靶细胞与两个单独的载体共转导,这在技术上可能具有挑战性,因为并非所有细胞都会同时使用gRNA和Cas9载体转导。使用单独载体的另一种方法是转导具有所需gRNA序列稳定表达高水平Cas9的细胞或生物体。但是,这种方法可能相当耗时且劳动密集。我们的AAV CRISPR载体通过使用单个AAV载体表达Cas9和所需的gRNA序列来帮助规避上述挑战。
我们的AAV CRISPR载体设计用于处理源自金黄色-葡萄球菌的SaCas9,与源自化脓性链球菌的传统SpCas1相比,其短>9 kb。与SpCas9相比,SaCas9具有明显的优势,SpCas9由于其大尺寸和AAV载体的小载货量而在基于AAV的应用中的使用有限。SaCas9在功能上与SpCas9在两个主要方面有所不同 - 首先,SaCas9需要与SpCas9所需的不同的gRNA支架序列。与SaCas9相容的gRNA称为SagRNA。其次,SaCas9识别的PAM序列是NNGRR(首-选NNGRRT),而SpCas<>识别的PAM是NGG(首-选)和NAG(不太优选)。
AAV CRISPR载体首先在大肠杆菌中构建为质粒。然后将其与辅助质粒一起转染到包装细胞中,其中两个倒置末端重复序列(ITR)之间的载体区域被包装成活病毒。放置在两个ITR之间的gRNA和Cas9表达盒与病毒基因组的其余部分一起被引入靶细胞中。人类U6启动子驱动用户选择的gRNA序列的表达,该序列将Cas9引导至感兴趣的DNA靶位点。
野生型AAV基因组是一种线性单链DNA(ssDNA),两端有两个ITR形成发夹结构。因此,它也被称为ssAAV。为了在宿主细胞中表达ssAAV载体上的基因,ssDNA基因组需要首先通过两条途径转化为双链DNA(dsDNA):1)以现有的ssDNA基因组为模板,以3' ITR为启动位点,通过宿主细胞的DNA聚合酶机制合成第二链DNA;2)正负链ssAAV基因组之间分子间dsDNA的形成。前者是主导途径。
AAV基因组DNA在宿主细胞核中形成游离体连接体。在非分裂细胞中,这些连接体可以在宿主细胞的一生中保留。在分裂细胞中,AAV DNA通过细胞分裂的稀释效应而丢失,因为游离体DNA不会与宿主细胞DNA一起复制。AAV DNA可以随机整合到宿主基因组中,但极为罕见。这在许多基因治疗环境中是可取的,在这些环境中,载体整合的潜在致癌作用可能引起重大关注。
AAV的一个主要实际优势是,在大多数情况下,AAV可以在生物安全1级(BSL1)设施中处理。这是由于AAV本质上缺乏复制,产生很少或没有炎症,并且没有引起已知的人类疾病。由于在宿主生物中的免疫原性低,我们的AAV CRISPR载体是基于CRISPR的体内应用的完美工具。
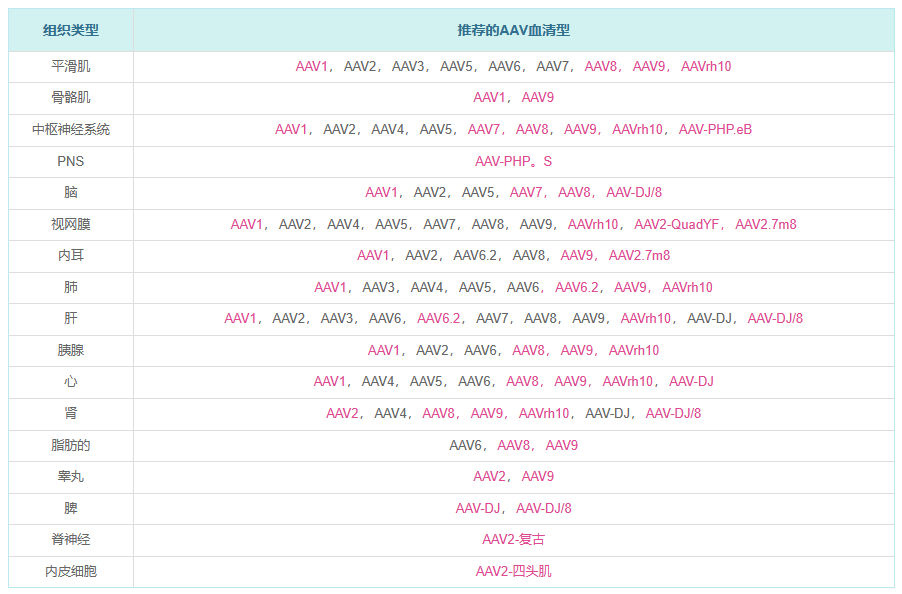
在自然界中已经鉴定出许多AAV菌株。它们根据病毒表面衣壳蛋白的不同抗原性分为不同的血清型。不同的血清型可以使病毒具有不同的组织嗜性(即感染的组织特异性)。当我们的AAV载体被包装成病毒时,通过使用不同的衣壳蛋白进行包装,可以将不同的血清型赋予病毒。我们目前为AAV载体系统提供的血清型包括 - 血清型1,2,3,4,5,6,6.2,7,8,9,rh10,DJ,DJ / 8,P-HP.eB,P-HP。S,AAV2-复古和AAV2-QuadYF。下表列出了不同的AAV血清型及其组织嗜性。
按血清型列表
| 血清型 | 组织嗜性 |
|---|---|
| AAV1 | 平滑肌、骨骼肌、中枢神经系统、脑、肺、视网膜、内耳、胰腺、心脏、 肝脏 |
| AAV2 | 平滑肌、中枢神经系统、大脑、肝脏、胰腺、肾脏、视网膜、内耳、睾丸 |
| AAV3 | 平滑肌、肝脏、 肺 |
| AAV4 | 中枢神经系统、 视网膜、肺、肾、心脏 |
| AAV5 | 平滑肌、中枢神经系统、脑、肺、视网膜、心脏 |
| AAV6 | 平滑肌、心脏、 肺、胰腺、脂肪、肝脏 |
| AAV6.2 | 肺、肝、内耳 |
| AAV7 | 平滑肌、视网膜、中枢神经系统、大脑、肝脏 |
| AAV8 | 平滑肌、中枢神经系统、脑、视网膜、内耳、肝脏、胰腺、心脏、肾脏、脂肪 |
| AAV9 | 平滑肌、骨骼肌、肺、肝、心脏、胰腺、 中枢神经系统、视网膜、内耳、睾丸、肾脏、脂肪 |
| AAVrh10 | 平滑肌、肺、肝、心脏、胰腺、中枢神经系统、视网膜、肾脏 |
| AAV-DJ | 肝、心、肾、脾 |
| AAV-DJ/8 | 肝、脑、脾、肾 |
| AAV-P-HPs.eB | 中枢神经系统 |
| AAV-P-HPs。S | PNS |
| AAV2-复古 | 脊神经 |
| AAV2-四头肌 | 内皮细胞,视网膜 |
| AAV2.7m8 | 视网膜,内耳 |
亮点
安全: AAV是最安全的病毒载体系统。AAV本质上缺乏复制,并且不知道会导致任何人类疾病。
宿主基因组破坏风险低:转导到宿主细胞后,AAV载体在细胞核中保留为游离体DNA。缺乏与宿主基因组的整合可能是体内人类应用的理想特征,因为它降低了可能导致癌症的宿主基因组破坏的风险。
高病毒滴度: 我们的AAV载体可以包装成高滴度病毒。当通过我们的病毒包装服务获得AAV病毒时,滴度可以达到>1013每毫升基因组拷贝数(GC/毫升)。
广义向性:当将我们的AAV载体包装成适当的血清型时,可以使用我们的AAV载体轻松转导来自人,小鼠和大鼠等常用哺乳动物物种的各种细胞和组织类型,但某些细胞类型可能难以转导,具体取决于所使用的血清型(参见下面的缺点)。
体外和体内有效性:我们的载体通常用于转导活体动物的细胞,但它也可以在体外有效使用。
难以转导某些细胞类型: 我们的AAV载体系统可以转导许多不同的细胞类型,包括包装成适当血清型的非分裂细胞。然而,不同的AAV血清型对不同的细胞类型具有嗜性,并且某些细胞类型可能难以被任何血清型转导。
技术复杂性:使用病毒载体需要在包装细胞中产生活病毒,然后测量病毒滴度。与传统质粒转染相比,这些程序在技术上要求很高且耗时。这些需求可以通过在订购载体时选择我们的病毒包装服务来缓解。
PAM 要求: 我们的AAV CRISPR载体旨在与源自金黄色-葡萄球菌的SaCas9配合使用。SaCas9介导的CRISPR靶向取决于PAM序列的存在,NNGRR(首-选NNGRRT)位于gRNA识别序列的紧邻3'端。
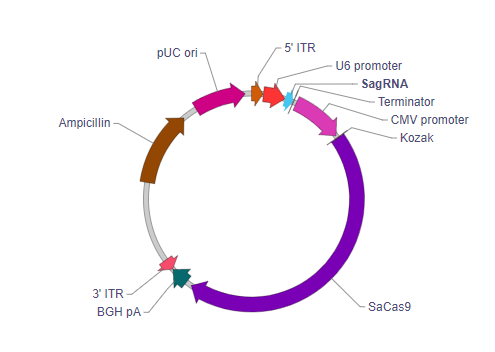
5' ITR: 5' inverted terminal repeat. In wild type virus, 5' ITR and 3' ITR are essentially identical in sequence. They reside on two ends of the viral genome pointing in opposite directions, where they serve as the origin of viral genome replication.
U6 Promoter: Drives expression of the downstream SagRNA sequence. This is the promoter of the human U6 snRNA gene, an RNA polymerase III promoter which efficiently expresses short RNAs.
Guide sequence: Specifies the target sequence for the SaCas9 nuclease.
gRNA scaffold: Structural portion of the gRNA to allow complexing with SaCas9.
Terminator: Terminates transcription of the gRNA.
CMV promoter: Human cytomegalovirus immediate early enhancer/promoter. It drives the ubiquitous expression of the downstream SaCas9 gene.
Kozak: Kozak consensus sequence. It is placed in front of the start codon of the ORF of interest because it is believed to facilitate translation initiation in eukaryotes.
SaCas9: SaCas9 nuclease derived from Staphylococcus aureus.
BGH pA: Bovine growth hormone polyadenylation signal. It facilitates transcriptional termination of the upstream ORF.
3' ITR: 3' inverted terminal repeat. See description for 5’ ITR.
Ampicillin: Ampicillin resistance gene. It allows the plasmid to be maintained by ampicillin selection in E. coli.
pUC ori: pUC origin of replication. Plasmids carrying this origin exist in high copy numbers in E. coli.
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验| 引用 | 主题 |
|---|---|
| 科学。339:819 (2013) | 使用CRISPR/Cas9系统进行基因组编辑的描述 |
| Genome Biol. 16:257 (2015) | Characterization of Staphylococcus aureus Cas9 |
| Nature. 520:186 (2015) | In vivo genome editing with SaCas9-based AAV vectors |
诺奖得主 Science 发文:基因编辑诞生 10 年,未来将如何改变世界?
免疫通路的功能,用于预防病毒感染。(图 1A)随着研究的深入,科学家们揭示了 CRISPR 系统如何使用从序列转录的 RNA 分子阵列引导 Cas 蛋白切割,从而破坏病毒 DNA 或 RNA。 CRISPR-Cas9 基因编辑技术就是通过人工设计的 sgRNA(guide RNA)来识别目的基因组序列,并引导 Cas9 蛋白酶进行有效切割 DNA 双链,形成双链断裂,损伤后修复会造成基因敲除或敲入等,最终达到对基因组 DNA 进行修饰的目的。 图 1. 基于 CRISPR 的适应性免疫提供了可编
折叠,在细胞内形成聚集体并产生神经毒性。尽管对 HD 发病机制的理解取得了重大进展,但仍然没有有效的治疗方法。 使用病毒 AAV9-mini-cmv-spCas9, AAV9-control-gRNA-RFP,AAV9-HTT-gRNA-RFP-20Q 注射方式 脑立体定位注射,耳静脉注射 注射剂量 (1)脑立体定位注射:表达 gRNA 和 Cas9 的病毒以 1:2 的比例混合,将 30μL 的混合病毒(总共 1-1.5E+12vg)注入猪纹状体的两侧(每侧15μL),注射
生物界一系列惊人的发现改变了这个学科,也让生物学家们以前所未有的方式对细胞上下其手。当然,这要感谢原核生物们进化出的这一套稀奇古怪的免疫系统。一系列的研究揭示出了细菌这一免疫系统的运作方式,并很快挖出名为 Cas9 蛋白的幕后黑手,一个受 RNA 引导的 DNA 内切酶。疯狂的科学家们很快发现了 Cas9 蛋白编辑基因组的潜在能力,并做出了一系列的探索。 两年前,一些研究表明通过 Cas9 蛋白和向导 RNA 的在真核细胞中共表达,可以实现位点特异性的 DNA 编辑,到如今上千
 技术资料
技术资料暂无技术资料 索取技术资料