相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 技术资料
- 保存条件:
-20℃
- 保质期:
6个月
- 英文名:
Human E - selectin G98T gene polymorphisms detection kit (pcr-rlfp)
- 库存:
10
- 供应商:
沪震生物
- 规格:
次
人E-选择素G98T基因多态性检测试剂盒(PCR-RLFP)每个标准品的OD值减去空白孔的OD值后作图,如设置复孔,则应取其平均值计算。以标准品的浓度为横坐标,OD值为纵坐标,绘出标准曲线。亦可以OD值为横坐标,标准品的浓度为纵坐标,绘出标准曲线。
英文名称:Human E - selectin G98T gene polymorphisms detection kit (pcr-rlfp)
规格:40次/50次/100次
1、什么是定量PCR?
以参照物为标准,对PCR终产物进行分析或对PCR过程进行监测,从而达到评估样本中靶基因的拷贝数,称为定量PCR。定量PCR的可行性定量一般是在PCR扩增的指数期进行的。
2、定量PCR定量的理论依据是什么?
特定的待扩增基因片段起始含量越大,则指数扩增过程越短,当扩增速率趋于稳定后,则无论原来样品中起始模板含量多少,最终扩增片段的含量通常是一样的。
理想的扩增结果:Y=X×2n 其中Y代表扩增产物量, X代表PCR反应体中的原始模板数 n为扩增次数;理论上PCR扩增效率为100%,PCR产物随着循环的进行成指数增长,但实际上:DNA的每一次复制都不完全,即每一次扩增中,模板不是呈2的倍增长;实际应为:Y= X(1+E)n ,其中E 代表扩增效率:E = 参与复制的模板/总模板,通常E≤1,E在整个PCR扩增过程中不是固定不变的。通常X 在 1~105拷贝、循环次数n≤30时,E 相对稳定,原始模板以相对固定的指数形式增加,适合定量分析,这也就是所谓的指数期;随着循环次数n的增加(>30次),E值逐渐减少,Y 呈非固定的指数形式增加,最后进入平台期。
3、荧光定量PCR定量的理论模式又是什么?
PCR是对原始待测模板核酸的一个扩增过程,任何干扰PCR指数扩增的因素都会影响扩增产物的量,使得PCR扩增终产物的数量与原始模板数量之间没有一个固定的比例关系,通过检测扩增终产物很难对原始模板进行准确定量。近年来研究人员通过大量的实践,研究了相对准确的定量PCR方法,即荧光定量PCR。
PCR扩增通式: ① Tn=T0(1+E)n
② Tn=Tn-1(1+E)n 注:[0
其中E表示扩增效率,n为循环数,Tn表示在n个周期后PCR产物的数量,Tn-1表示在n-1个周期后PCR产物的数量,T0为原始模板数量。设定PCR到达指数扩增期时,产生一定的荧光(荧光依赖于某一循环扩增产物的总量,即特定的拷贝数K,为常数,大约在1010左右)高于背景为仪器所识别,此时的循环数为CP(crossing point),也就是K= T0(1+E)CP,取对数即:
lg K=lg T0+CP*lg(1+E)
CP=- 1/lg(1+E)*lg T0 +lgk/lg(1+E)
人E-选择素G98T基因多态性检测试剂盒(PCR-RLFP)由于对一特定的PCR而言,E与K均为常数,故上式为循环数(CP)对原始模板拷贝数的对数(lg T0)一次方程,其标准形式y=kx+b,该直线的斜率为- 1/lg(1+E),在横坐标上的截距为lgk/lg(1+E),也是荧光定量PCR所谓的标准曲线。例如下图为单管实时荧光定量RT-PCR的标准曲线:
目前荧光定量PCR均采用外标定量
外标法定量PCR扩增效率的计算,由于标准曲线的斜率(Slope)为- 1/lg(1+E),可知E=10-1/Slope-1 ,如从标准曲线中知道Slope=-3.337,则可推知扩增效率E=101/3。337-1=0.99,也有作者将(1+E)直接视为扩增效率E,则E=10-1/Slope,求得的E值均在1—2之间,有时也有大于2的结果,如下图所示。另外也可直接根据系列稀释外标在该次实时荧光PCR的结果来大略分析扩增效率的高低,例如系列10倍稀释外标在PCR扩增时有N2=N0En2, N3=(10*N0)En3,在扩增到指数期时荧光值相同则代表此点的终末拷贝数相同,即N2=N3,En2-n3=10,取对数得到⊿ngE=1, E=101/⊿n,E=2,⊿n=3.32; E=1.8,⊿n=3.91.反之亦然。
根据PCR扩增过程中是否加入某种标记物、标记物的种类以及最后检测的信号的不同可分为四种类型:①直接定量检测法, ②同位素标记定量,③酶标记定量检测法,④荧光定量PCR技术
荧光定量PCR 主要原理发射波长与受体荧光染料光染料吸收供体荧光传递的能量而激发出另一波长的荧光,同时将供体荧光淬灭。SYBR Green I 检测模式
SYBR Green I 是一种能与双链DNA 结合发光的荧光大增强。因此, SYBR Green I的检测出PCR体系存在的双链DNA数量。SYBR Green I 的最大吸收波长约为497nm,发射波长最大约为520nm。PCR扩增程序一般为94℃~55℃~72℃三步法,40个循环。
SYBR Green I 的缺点:由于SYBR Green I没有特异性,不能识别特定的双链,只要是双链就会结合发光,对PCR反应中的非特异性扩增或引物二聚体也会产生荧光,通常本所以在临床上使用可能会有假阳性发生。 SYBR Green I的优点:SYBR Green I的优点是因为其缺点产生,由于它能所有的双链DNA相结合,所以对不同模板不需特别定制不同的这对科研是很有利的,因此国内外在科研中使用比较普遍。
5、为什么要用荧光定量PCR技术进行定量?它与传统的定量PCR有什么不同?
如前所述的,传统的定量PCR有很多,主要是倍比稀释法、内参照法、竞争法、PCR-ELISA法,但这些定量PCR技术的难点主要在于:(1)如何确定PCR正处于线性扩增范围内(只有在此范围内PCR产物信号才与初始模板的拷贝数成比例)。(2)一旦线性扩增范围确定以后,如何找到一个合适的方法检测结果。为了保证线性,研究者要扩增一系列梯度稀释的cDNA或者对每个基因的扩增循环数作适当的调整;有的研究者加一个竞争性模板,有的做限制性的稀释梯度分析,或者加一个PCR模拟(mimic)反应,即用相似的引物与目标产物共扩增,而扩增产物的检测通常在跑胶以后通过染料、放射活性或者探针进行检测。(3)大多数是终点检测,即PCR到达平台期后进行检测,而PCR经过对数期扩增到达平台期时,检测重现性极差。同一个模板在96孔PCR仪上做96次重复实验,所得结果有很大差异(如下图所示),因此无法直接从终点产物量推算出起始模板量;虽然加入内标后,可部分消除终产物定量所造成的不准确性。但即使如此,传统的定量方法也都只能算作半定量、粗略定量的方法,所以传统定量PCR的缺点是:劳动强度大、定量不准确、重复性差。
人E-选择素G98T基因多态性检测试剂盒(PCR-RLFP)而荧光定量PCR有如下显著的优点:
1、特异性好,使用特异性探针对定量分子进行识别,具有很高的准确性。同时,靶序列由引物和探针双重控制,特异性好、假阳性低。 2、灵敏度高,荧光PCR检测技术是综合了PCR技术、荧光标记技术、激光技术、数码显象技术为一体的技术,因此它的检测灵敏度很高。3、线性关系好、线性范围宽,由于荧光信号的产生和每次扩增产物成一一对应的关系,通过荧光信号的检测可以直接对产物进行定量;定量范围可在0-1010拷贝/毫升。4、操作简单、安全、自动化程度高、防污染。扩增和检测可以在同一管内检测,不需要开盖,不易污染;同时扩增和检测一步完成,不需要后期处理,不再需要担心放射性污染。5、速度快、高通量,可在2-3小时完成96个样品的定量分析。
6、荧光定量PCR为什么使用外标定量,而不是内标定量?
A、内标对实时荧光定量PCR的影响若在待测样品中加入已知起始拷贝数的内标,则PCR反应变为双重PCR,双重PCR反应中存在两种模板之间的干扰和竞争,尤其当两种模板的起始拷贝数相差比较大时,这种竞争会表现得更为显著。但由于待测样品的起始拷贝数是未知的,所以无法加入合适数量的已知模板作为内标。也正是这个原因,传统定量方法虽然加入内标,但仍然只是一种半定量的方法。
B、荧光定量PCR无需内标定量实时荧光定量PCR技术有效地解决了传统定量只能终点检测的局限,实现了每一轮循环均检测一次荧光信号的强度,并记录在电脑软件之中,通过对每个样品Ct值的计算,根据标准曲线获得定量结果。实时荧光定量PCR无需内标是建立在两个基础之上的:
(1)Ct值的高度重现性 PCR循环在到达Ct值所在的循环数时,刚刚进入真正的指数扩增期(对数期),此时微小误差尚未放大,因此Ct值的重现性极好,即同一模板不同时间扩增或同一时间不同管内扩增,得到的Ct值是恒定的。
(2)Ct值与起始模板的线性关系由于Ct值与起始模板的对数存在线性关系,可利用标准曲线对未知样品进行定量测定,因此,实时荧光定量PCR是一种采用外标准曲线定量的方法。美国Texas大学的科研人员进行了外标法定量和内标法定量的方法学比较,得出的结论是:内标法作为定量或半定量的手段是不可靠的,而外标准曲线的定量方法是一种准确的、值得信赖的科学方法。
7、为什么要用定量PCR而不是定性PCR?
在实验生物学及临床医学的一些场合,由单纯PCR所提供的阳性或阴性结果还远远不够,在阐述许多问题的本质时,基因及其表达的定量起着至关重要的作用。定量PCR常用来研究发病机制、估计病毒的负荷量、监测临床治疗进展或用于诊断遗传缺陷等。通过对靶基因量的检测,将其与疾病的临床表现、临床分型以及各种标志酶的值联系起来,为疾病的诊断和药物疗效监测提供科学的依据。与非定量PCR分析方法不同,定量PCR分析的操作程序有助于评估污染的情况,即测出污染的程度,即使负对照产生了正的信号,只要这些信号比实验样品的低得多,依据这样的结果,至少可以推测出实验中所得出的信号是真实的。在一定程度上消除了单纯PCR过于敏感、假阳性率高的缺点。
8、如何设计荧光定量PCR实验方案?
1)、大量阅读相关的背景资料后,根据自己所要研究的基因名称,在genebank中找到相应的基因序列。(www.ncbi.nlm.nih.gov) 2)、用引物设计软件Primer5.0、Oligo6.0或beacon designs3.0进行引物探针的设计;(该软件可在www.shinegene.org.cn下载)
引物设计通常遵守如下原则:
A、引物与模板的序列要紧密互补。
B、引物与引物之间避免形成稳定的二聚体或发夹结构。
C、引物不能在模板的非目的位点引发DNA 聚合反应(即错配)。
D、引物长度通常在20-25bp,Tm值在55-65℃,GC含量在40%-60%,产物大小在100-250bp之间。
E、引物的3’端避免使用碱基A;引物3’端避免出现3 个以上连续相同的碱基。
F、为避免基因组的扩增,引物设计最好能跨两个外显子。
探针设计通常遵守如下原则:
A、探针位置尽可能地靠近上游引物。
B、探针长度通常在20-30bp,Tm值在65-70℃,通常比引物高5-10℃,GC含量在40%-70%。
C、探针的5’端应避免使用碱基G。
D、整条探针中,碱基C的含量要明显高于G的含量。
3)、为确保引物探针的特异性,最好将设计好的序列在blast中核实一次,如果发现有非特异性互补区,建议重新设计引物探针。(www.ncbi.nlm.nih/blast)
4)、根据仪器特点和个人的喜好,选择标记的荧光素种类。如:FAM、Texas red、LC-Red640,LC-Red705等,同时确定荧光定量PCR的方法,选择Taqman或beacon等,可参考前面所述。
5)、选择高品质的引物探针合成商,如闪晶生物等。
6)、外标准品的制备:一种是化学合成目的基因,它的优点是纯度高、定量准确,缺点是受化学合成工艺的限制,只能合成120bp以下的长度;一种是将PCR扩增产物直接梯度稀释,它的优点是方便、简单,缺点是不准确、不稳定;另一种是将PCR产物克隆到载体上,然后抽提出质粒,经过测量浓度和拷贝数的换算,可准确定量,它的优点是稳定、准确。如果是转基因食品,则要求转基因食品与非转基因食品按一定的比例混合做成标准品。稀释液可以是TE或者是闪晶生物提供的DNA保存液。拷贝数=(质量÷分子量)×6.0×1023。通常外标由4个点到5个点组成,模板的浓度分别为107/ml、106/ml、105/ml、104/ml、103/ml。
7)、合成好的引物探针,最好用双蒸水稀释成25pmol/ul的浓度,然后放-20℃保存,还应该注意避光保存探针。如果是配成25pmol/ul的浓度,那么所加水的量是(ul): (OD数×33)÷分子量×40000
8)、PCR反应液的配制 1×PCR buffer、0.3-0.5pmol/ul的引物、0.1-0.3pmol/ul的探针、2.5-4.0mM的Mg2+、1-2U的Taq酶、0.2-0.4mM的dNTPs、0.2-1U的UNG酶、0.3-0.6mMdUTP、通常取2-5ul的模板、反应总体积通常为20-50ul(以上所有的浓度都是指终浓度)
9)、PCR扩增程序的设定 在lightcycler上通常是:先50℃2分钟 93℃3分钟,然后93℃5秒 60℃20秒,循环40次,在60℃时,设定荧光检测点。 在其它荧光仪器上,通常是:先50℃2分钟 93℃5分钟,然后93℃20秒 60℃30秒,循环40次,在60℃时,设定荧光检测点。
10)、为确保实验数据的有效性,每次实验都设阴性对照和4个标准品,每个样品都平行做2个复孔。
11)、基线或阀值的设定 通常是以10-15个循环的荧光值作为阀值,也可以以阴性对照荧光值的最高点作为基线。
9、荧光定量PCR常见的几个问题
1)、文献上找到的引物和探针序列能否直接使用?
通常国外的文献可信度比较高,可直接使用;但为了保险起见,最好用blast对引物探针的序列进行必要的验证;或者再进一步用primer软件对引物探针的二级结构和退火温度进行分析,这样更有利于您对整个实验的把握。
2)、在实验之前要进行哪些准备工作?
首先要不加探针做常规的PCR实验,验证引物是否工作、模板是否降解、模板纯度是否合适,同时确定实验的最佳反应体系和反应条件。
3)、标本的采集和处理应该注意什么问题?
根据实验要求和目的,有针对性采集病灶部位的标本;采集好的标本,最好根据每次实验用量,用冻存管分成几小份,放在-80℃保存,以免反复冻融;标本通常分成3类,如细胞组织、分泌物、血清全血;如果是血清,不能有融血现象的发生,否则会影响PCR的扩增;如果是全血,最好不用EDTA作为抗凝剂,选用柠檬酸作为抗凝剂,否则会影响PCR的扩增;如果是组织,最好用蛋白酶K消化;如果是提RNA的标本,更应该防止反复冻融和保持标本的新鲜。
4)、在做荧光定量实验时要注意些什么呢?
A、在操作中,应使用不含荧光物质的一次性手套(经常替换)、一次性移液器吸头(带滤嘴自卸式),并不能用手直接触摸毛细管、离心管吗底部。
B、在试剂准备和标本处理时应使用超净工作台(负压式)或防污染罩,以防止对环境的污染。
C、操作台、移液器、离心机、PCR扩增仪等仪器设备应经常用10%次氯酸或75%乙醇擦拭消毒。每次实验前后用10%次氯酸和70%乙醇擦拭移液器、操作台。
D、实验中涉及的有害有毒的标本及试剂应妥善放置,专人保管;废弃物应置专门容器中,妥善处理。
E、荧光探针应避光保存,加入反应液中后,应尽快配制好反应体系进行扩增。
F、配制反应体系时,应注意移液器的使用方法,所有的液体都要缓慢加至管底,不要加至管壁,所有液体的混匀要用振荡器进行,不能用移液器吹打,反应体系配制完毕后低速离心数秒,避免产生气泡。
G、配制反应体系过程中若需标记,请在试管架或离心机管架上标记,不要直接标记在离心管上。
5)、为什么阳性对照一直没有扩增曲线?
首先确定没有少加漏加反应成分,确定反应条件是否合适,模板是否降解;但也可能是体系有问题,如:镁离子浓度不对、酶浓度不对等;最大的可能是酶不工作或是探针不工作了;
6)、为什么阴性对照一直有扩增曲线出现?
最大的可能是有污染了;但也可能是体系有问题,如:镁离子浓度不对、酶浓度不对等。
7)、如果出现污染该怎么办?
以替换法确定污染从何而来,对症下药,值得注意的是,因荧光定量PCR的敏感度极高,从防止污染的角度出发,最好在体系中加有dUTP,一旦出现污染现象,可以用UNG酶消除;同时将实验室分成4个区,即试剂储存和准备区、标本制备区、扩增反应混合物配制、扩增和产物分析区。
18、酶或探针不工作怎么办?
在有充分证据的情况下,找供应商的责任,所以在买酶和探针时要找有质量保证和信用的供应商,譬如闪晶生物,以免不必要的麻烦。
19、客户需要提供什么?
一般只需要提供基因序列和样品就可以了。
实时荧光定量PCR
1 实时荧光定量PCR技术的方法学
1.1 原理 所谓real-time Q-PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。在real-time 技术的发展过程中,两个重要的发现起着关键的作用:(1)在90年代早期,Taq DNA多聚酶的5′核酸外切酶活性的发现,它能降解特异性荧光记探针,因此使得间接的检测PCR产物成为可能。(2)此后荧光双标记探针的运用使在一密闭的反应管中能实时地监测反应全过程。这两个发现的结合以及相应的仪器和试剂的商品化发展导致real-time Q-PCR方法在研究工作中的运用。
PCR反应过程中产生的DNA拷贝数是呈指数方式增加的,随着反应循环数的增加,最终PCR反应不再以指数方式生成模板,从而进入平台期。在传统的PCR中,常用凝胶电泳分离并用荧光染色来检测PCR反应的最终扩增产物,因此用此终点法对PCR产物定量存在不可靠之处。在real-time Q-PCR中,对整个PCR反应扩增过程进行了实时的监测和连续地分析扩增相关的荧光信号,随着反应时间的进行,监测到的荧光信号的变化可以绘制成一条曲线。在PCR反应早期,产生荧光的水平不能与背景明显地区别,而后荧光的产生进入指数期、线性期和最终的平台期,因此可以在PCR反应处于指数期的某一点上来检测PCR产物的量,并且由此来推断模板最初的含量。为了便于对所检测样本进行比较,在real-time Q-PCR反应的指数期,首先需设定一定荧光信号的域值,一般这个域值(threshold)是以PCR反应的前15个循环的荧光信号作为荧光本底信号(baseline),荧光域值的缺省设置是3~15个循环的荧光信号的标准偏差的10倍。如果检测到荧光信号超过域值被认为是真正的信号,它可用于定义样本的域值循环数(Ct)。Ct值的含义是:每个反应管内的荧光信号达到设定的域值时所经历的循环数。研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小。利用已知起始拷贝数的标准品可作出标准曲线,因此只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。
1.2 荧光化学 目前real-time Q-PCR所使用的荧光化学方法主要有五种,分别是:DNA结合染色,水解探针,分子信标,荧光标记引物,杂交探针。它们又可分为扩增序列特异和非特异的检测两大类。
扩增序列非特异性检测方法的基础是DNA结合的荧光分子,如SYBR green 1等荧光染料。Real-time Q-PCR发展早期就是运用这种最简单的方法,在PCR反应体系中,加入过量SYBR green 1荧光染料,SYBR green 1荧光染料特异性地掺入DNA双链后,发射荧光信号。荧光染料的优势在于它能监测任何dsDNA序列的扩增,不需要探针的设计,使检测方法变得简便,同时也降低了检测的成本。然而正是由于荧光染料能和任何dsDNA结合,因此它也能与非特异的dsDNA(如引物二聚体)结合,使实验容易产生假阳性信号。引物二聚体的问题目前可以用带有熔解曲线(melting curve)分析的软件加以解决。
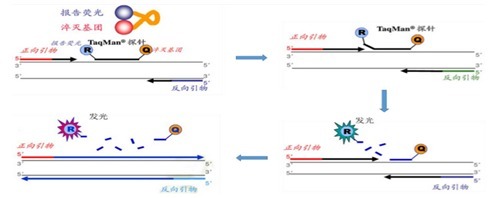
扩增序列特异性检测方法是在PCR反应中利用标记荧光染料的基因特异寡核苷酸探针来检测产物,它又可分为直接法和间接法。间接的方法就是利用水解探针的策略。目前在real-time Q-PCR中最广泛使用的TaqMan系统就是运用了这个原理。PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团,此时5′端荧光基团吸收能量后将能量转移给临近的3′端荧光淬灭基团(发生荧光共振能量转移,FRET),因此探针完整时,检测不到该探针5′端荧光基团发出的荧光。但在PCR扩增中,溶液中的模板变性后低温退火时,引物与探针同时与模板结合。在引物的介导下,沿模板向前延伸至探针结合处,发生链的置换,Taq酶的5′-3′外切酶活性(此活性是双链特异性的,游离的单链探针不受影响)将探针5′端连接的荧光基团从探针上切割下来,游离于反应体系中,从而脱离3′端荧光淬灭基团的屏蔽,接受光刺激发出荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
直接的方法指的是标记荧光的探针与扩增产物结合后即直接产生荧光,分子信标(molecular beacon)就属于这一类,它本质上是一种标记荧光的发夹探针,当探针分子呈发夹结构时,结合在其两端的荧光基团距离上接近,使得产生能量转移效应,而不发生荧光。当互补序列出现时,探针与DNA杂交,探针转变成一个开放的结构,呈线性,报告荧光基团与淬灭荧光基团彼此在空间上产生足够的分离,荧光基团脱离了淬灭基团的影响,从而产生可被检测到的荧光。荧光标记引物是从分子信标的概念变化而产生的一种联合分子探针系统,它把荧光基团标记的发夹结构的序列直接与PCR引物相结合,从而使荧光标记基团直接掺入PCR扩增产物中。目前主要有两种:日出引物(sunrise primes)和蝎子引物(scorpion primes)。杂交探针(hybridization probe)使用两个特异的探针,其中上游的探针的3′端标记有供体荧光素(donor),而下游的探针的5′端标记有受体荧光素(acceptor)。在PCR中模板退火阶段,两探针同时与扩增产物杂交,并形成头尾结合的形式,使供体和受体荧光素距离非常接近,两者产生荧光共振能量转移(FRET,此作用与上述水解探针的方式相反),使得受体荧光基团发出荧光;当两探针处于游离状态时,无荧光产生。由于反应中运用了两个探针,因此增加了方法的特异性,另外也可利用荧光寡核苷酸熔解曲线(melting curve)对与寡核苷酸探针结合的序列进行分析,从中获取有用的信息。
1.3 人E-选择素G98T基因多态性检测试剂盒(PCR-RLFP)定量方法 在real-time Q-PCR中,模板定量有两种策略;相对定量和绝对定量。相对定量指的是在一定样本中靶序列相对于另一参照样本的量的变化。绝对定量指的是用已知的标准曲线来推算未知的样本的量。
1.3.1 标准曲线的法的相对定量 由于在此方法中量的表达是相对于某个参照物的量而言的,因此相对定量的标准曲线就比较容易制备,对于所用的标准品只要知道其相对稀释度即可。在整个实验中样本的靶序列的量来自于标准曲线,最终必须除以参照物的量,即参照物是1*的样本,其它的样本为参照物量的n倍。在实验中为了标准化加入反应体系的RNA或DNA的量,往往在反应中同时扩增一内源控制物,如在基因表达研究中,内源控制物常为一些管家基因(如beta-actin,3-磷酸甘油醛脱氢酶GAPDH等)。
1.3.2 比较CT法的相对定量 比较CT法与标准曲线法的相对定量的不同之处于在于其运用了数学公式来计算相对量,前提是假设每个循环增加一倍的产物数量,在PCR反应的指数期得到CT值来反应起始模板的量,一个循环(CT=1)的不同相当于起始模板数2倍的差异。但是此方法是以靶基因和内源控制物的扩增效率基本一致为前提的,效率的偏移将影响实际拷贝数的估计。
1.3.3 标准曲线法的绝对定量 此方法与标准曲线法的相对定量的不同之处在于其标准品的量是预先可知的。质粒DNA和体外转入的RNA常作为绝对定量标准品的制备之用。标准品的量可根据260nm的吸光度值并用DNA或RNA的分子量来转换成其拷贝数来确定。
2 实时荧光定量PCR技术的应用
Real-time Q-PCR的应用范围很广泛,包括mRNA表达的研究、DNA拷贝数的检测、单核苷酸多态性(SNPs)的测定等。以下就目前real-time Q-PCR在易位基因的检测,细胞因子的表达分析,肿瘤耐药基因表达的研究以及病毒感染的定量监测中的应用作一概述。
2.1 微小残留病变的检测 肿瘤疾病尤其是血液的恶性肿瘤常伴有特异性基因的易位,这种易位往往可以作为监测临床治疗效果的一种肿瘤标志。虽然在过去的几十年里治疗方案的改进已大大地延长了病人的生存期,但是缓解期的病人仍存在复发的危险性。因此微小残留病变(MRD)的检测对于进一步调整治疗方案是至关重要的。Real-time Q-PCR的应用正成为检测肿瘤微小残留分子标志的一种必备的研究工具。通过对肿瘤融合基因的定量测定能指导临床对病人实行个体化的治疗。急性粒细胞性白血病(AML)最常见的染色体异常是交互易位t(8;21) (q 22;q22),在这易位中,AML-1转录因子基因和8号染色体的MTG8基因发生融合,致使正常的AML-1转录调控受到影响,这可能是白血病的病因。目前的研究证明用real-time Q-PCR来检测融合基因有助于对这些病人的MRD进行定量,其作为预后的指标或对治疗方案的评估是有价值的。同样的方法也被用于定量其它的易位融合基因水平,如慢性粒细胞性白血病(CML)的BCR-ABL融合基因;急性淋巴细胞性白血病(ALL)的白血病特异的TEL-AML1融合基因;滤泡状淋巴瘤(FL)的染色体易位t(14;18)(q32;q21)和bcl-2重排等。许多研究都在很大程度上受益于real-time Q-PCR方法的应用,随着技术的发展,Real-time Q-PCR的运用将不断地扩大。
2.2 细胞因子的表达分析 细胞因子是调节蛋白,它通过调节免疫反应(包括淋巴细胞活化、增殖、分化、生存和凋亡)在免疫系统中起着核心作用。许多不同类型的细胞都能分泌这种低分子量的蛋白质,其中包括淋巴细胞、抗原递呈细胞、单核细胞、内皮细胞和成纤维细胞。细胞因子可被分为不同的组;白介素(IL-1~IL-23),干扰素(IFN-α,IFN-γ等),集落刺激因子(CSF),肿瘤坏死因子(TNF),肿瘤生长因子(TGF-β等)和化学因子(MCP-1,MIP-1等)。为了阐明在许多炎症反应,自身免疫性疾病和器官移植排异中的免疫致病途径,细胞因子mRNA表达谱的可靠定量是很重要的。尽管被检样本中细胞因子含量往往极低,然而real-time反转灵PCR(RT-PCR)以其高敏感性和准确性在细胞因子的定量中越来越受到青睐。
2.3 肿瘤耐药基因表达的研究 对化疗药物的耐药是治疗肿瘤病人的主要障碍。由于耐药限制了许多肿瘤的成功治疗,因此研究肿瘤细胞对耐药机制就变得十分重要。目前研究中发现主要的耐药机制有:ATP结合盒基因超家族(ATP-binding cassette superfamily)的膜转运蛋白介导的耐药,这些蛋白包括:MDR-1基因编码的P-糖蛋白(P-gp),多药耐药相关蛋白(MRP),肺耐药相关蛋白(LRP),乳腺癌耐药蛋白(BCRP)等;酶介导的耐药,包括拓扑导构酶(Topo),谷胱甘肽(GSH)及谷胱甘肽-S-转移酶(GST),蛋白激酶C(PKC),脱氧胞嘧啶核苷激酶(deoxycytidine kinase)等,凋亡基因介导的耐药,如bcl-2家族,p53基因,c-myc等。多药耐药(MDR)是多因素,多种机制共同作用的结果。real-time反转录PCR(RT-PCR)是了解肿瘤耐药,指导临床治疗策略的有用手段,它能观测用药前后及复发时肿瘤细胞的耐药基因mRNA表达变化,从而及时调整治疗方案和评价疾病的预后。
3 存在的问题及应用前景
在real-time Q-PCR技术中,无论是相对定量还是标准曲线定量方法仍存在一些PCR定量方法均有的问题有待解决。在标准曲线定量中,标准品的制备是一个必不可少的过程。目前由于无一统一标准,各个实验室所用的生成标准曲线的样品各不相同,致使实验结果缺乏可比性。此外,用real-time Q-PCR来研究mRNA时,受到不同RNA样本存在不同的逆转录(RT)效率的限制。在相对定量中,其前提是假设内源控制物不受实验条件的影响的,合理地选择合适的不受实验条件影响的内源控制物也是实验结果可靠与否的关键。另外,与传统的PCR技术相比,Real-time Q-PCR的不足之处是:(1)由于运用了封闭的检测,减少了扩增后电泳的检测步骤,因此也就不能监测扩增产物的大小;(2)因为荧光素种类以及检测光源的局限性,从而相对地限制了real-time Q-PCR的复合式(multiplex)检测的应用能力;(3)目前real-time Q-PCR实验成本比较高,从而也限制了其广泛的应用。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 技术资料
技术资料暂无技术资料 索取技术资料
人E-选择素G98T基因多态性检测试剂盒(PCR-RLFP)
¥980 - 2360










