细胞外囊泡通过GSDMD孔移植促进旁细胞焦亡
2025-11-25 13:02点击次数:108
关键词:由gasdermins(GSDM)介导的细胞焦亡在感染和炎症中起着至关重要的作用。细胞焦亡会引发炎症分子的释放,包括损伤相关分子模式(DAMP)。然而,控制炎症的焦亡的后果——尤其是白细胞介素(IL)-1细胞因子和DAMPs之外的焦亡——尚不清楚。在这里,研究者展示了焦亡在体外和体内从焦亡细胞到旁观者细胞的细胞间传播。研究者确定了由焦亡细胞释放的细胞外囊泡(EV)是幼稚细胞裂解死亡的传播者,并促进炎症。DNA-PAINT超分辨率和免疫电镜显示由焦亡细胞释放的EV上的GSDMD孔结构。重要的是,焦亡EV将GSDMD孔移植到旁观者细胞的质膜上并杀死它们。总的来说,研究者证明GSDMD孔的细胞间囊泡移植会传播焦亡,揭示了一种控制疾病相关旁观者细胞死亡的多米诺骨牌效应。该研究于2025年1月发表在《Cell》,IF 42.5分。
技术路线:
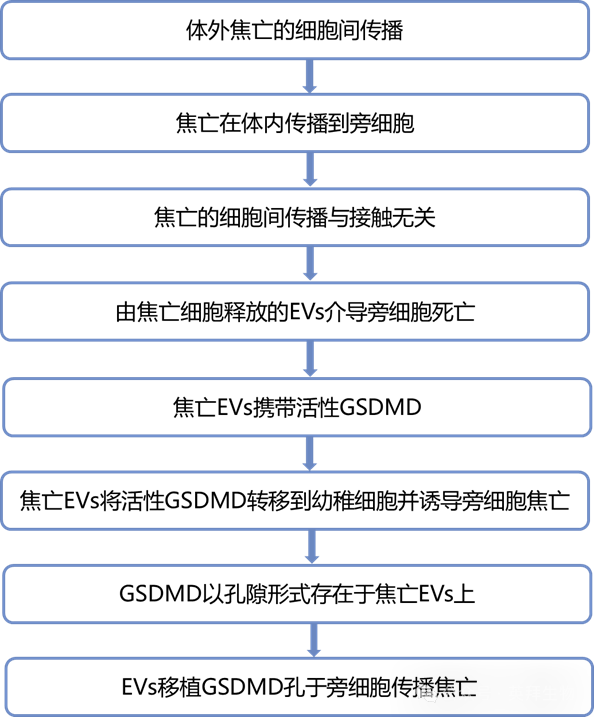
主要研究结果:
1、体外焦亡的细胞间传播
研究者首先探讨焦亡是否能够传播至旁观者细胞。当与用 Nigericin(一种 NLRP3 激活剂)刺激的野生型(WT)CD45.1⁺骨髓来源巨噬细胞(BMDMs)共培养时,CD45.2⁺Nlrp3⁻/⁻ BMDMs 发生细胞死亡(图 1A 和 1B)。由于 Nlrp3⁻/⁻ BMDMs 对 Nigericin 诱导的焦亡具有抵抗性,它们的死亡并非直接由 Nigericin 引起,而是由经历 Nigericin 诱导焦亡的 CD45.1⁺WT BMDMs 引起的旁观者死亡。为避免炎症激活剂对旁观者细胞的任何直接影响,研究者采用了一种不依赖炎症体配体的焦亡系统,因为 GSDMD-NT 的诱导表达足以触发焦亡。Gsdmd⁻/⁻ iBMDMs 表达四环素转录激活因子(Tet3G)并稳定地重建了带有蓝色荧光蛋白(BFP)标记的全长 GSDMD(GSDMD-FL)或 GSDMD-NT,以实现其四环素(Doxycycline, Dox)诱导表达(图 1C)。此后,这些巨噬细胞分别被称为 iBMDM-iGSDMD-FL 和 iBMDM-iGSDMD-NT,其中 iGSDMD 表示诱导性 GSDMD。Dox 诱导了 GSDMD-FL 和 GSDMD-NT 的表达(图 1C),并且如预期那样,iBMDM-iGSDMD-NT 细胞发生了焦亡(图 1D)。
利用诱导性 GSDMD-NT 表达,研究者可以在细胞群体中选择性地引发特定细胞的焦亡,并研究旁观者细胞的死亡。为此,用 Dox 刺激的 iBMDM-iGSDMD-NT 细胞与用 CellBrite488 标记的 WT BMDMs 共培养,并在含有 DRAQ7(一种细胞膜不可渗透的染料,可在细胞膜通透化后染色细胞核)的培养基中进行时间序列显微镜观察(图 1E)。如预期那样,iBMDM-iGSDMD-NT 细胞表达 BFP 并在早期阶段(图 1F 中的 2-6 小时;视频 S1 和 S2 中的白色箭头)因焦亡而变成 DRAQ7⁺。引人注目的是,与 iBMDM-iGSDMD-NT 细胞共培养的 CellBrite488 标记的 WT BMDMs 在后期(图 1F 中的 8-12 小时;视频 S1 和 S2 中的青色箭头)也变成DRAQ7⁺。相比之下,与未发生焦亡的 iBMDM-iGSDMD-FL 细胞共培养的CellBrite488标记的WT BMDMs 保持 DRAQ7⁻(图 1G;视频 S3 和 S4)。成像流式细胞术验证了与 Dox 刺激的 iBMDM-iGSDMD-NT 细胞共培养的 CellBrite488 标记的 WT BMDMs 发生焦亡(图 1H 和 S1A)。iBMDM-iGSDMD-NT 细胞首先获得 DRAQ7 染色,随后共培养的 WT BMDMs 也出现染色,这一动力学过程表明焦亡向旁观者细胞的传播。
2、焦亡在体内传播到旁细胞
接下来,研究者在三个模型中检验体内旁观者焦亡的发生。首先,研究者通过腹腔注射(i.p.)将表达 AF647 标记脂多糖(LPS)的大肠杆菌(E. coli)注入 WT 小鼠体内,并评估未感染的腹腔细胞(即旁观者细胞)的细胞死亡(图 S1B)。引人注目的是,相当比例的未感染旁观者腹腔细胞呈 PI⁺(图 1I)。其次,将用 PBS 或 Dox 刺激的 CellBrite488 标记的 iBMDM-iGSDMD-NT 细胞注入 WT 小鼠的腹腔,并评估 CellBrite488⁻腹腔细胞(即旁观者)的细胞死亡(图 S1C)。从接受 Dox 刺激的 iBMDM-iGSDMD-NT 细胞的小鼠中,CellBrite488⁻细胞出现细胞死亡(图 1J),表明存在旁观者死亡。最后,在将 FITC-LPS 电穿孔的 CD45.1⁺WT BMDMs 注入同种异体 CD45.2⁺Gsdmd⁻/⁻ 小鼠的腹腔后(图 S1D),CD45.2⁺腹腔细胞在 Gsdmd⁻/⁻ 小鼠中发生焦亡(图 1K)。由于 GSDMD 缺陷细胞不会发生细胞质 LPS 诱导的焦亡,观察到的 CD45.2⁺细胞死亡(即旁观者)最有可能是由焦亡的 CD45.1⁺BMDMs 引起的。值得注意的是,在大肠杆菌感染模型中,AF647-LPS⁻旁观者细胞死亡的细胞类型包括免疫细胞(巨噬细胞和单核细胞)和非免疫细胞(图 S1E)。在 CD45.1⁺BMDM 转移模型中,FITC-LPS⁻CD45.2⁺旁观者细胞死亡的细胞类型包括巨噬细胞、单核细胞和中性粒细胞(图 S1F)。综合这些模型的数据表明,体内多种细胞类型中发生了旁观者焦亡。
3、焦亡的细胞间传播与接触无关
研究者接下来探讨焦亡是否通过细胞接触依赖或非依赖的方式传播。为此,研究者使用了将焦亡细胞和未受影响细胞分隔开的转孔板。具体而言,iBMDM-iGSDMD-NT 细胞被放置在转孔板的上层,而不会因 Dox 诱导焦亡的 WT BMDMs 被放置在下层(图 S2A)。在 Dox 诱导 iBMDM-iGSDMD-NT 细胞在转孔板中发生焦亡后,下层的旁观者 BMDMs 发生了焦亡(图 S2B 和 S2C)。此外,来自 Dox 刺激的 iBMDM-iGSDMD-NT 细胞的上清液能够杀死未受影响的 BMDMs,表明焦亡上清液具有溶细胞活性(图 S2D 和 S2E)。同样,未受影响的 RAW 巨噬细胞(天然缺乏 ASC)在与用 Nigericin 刺激的 WT BMDMs 的上清液孵育后发生细胞死亡(图S2F 和 S2G)。这些结果表明,焦亡通过分泌因子以非接触依赖的方式在细胞间传播。
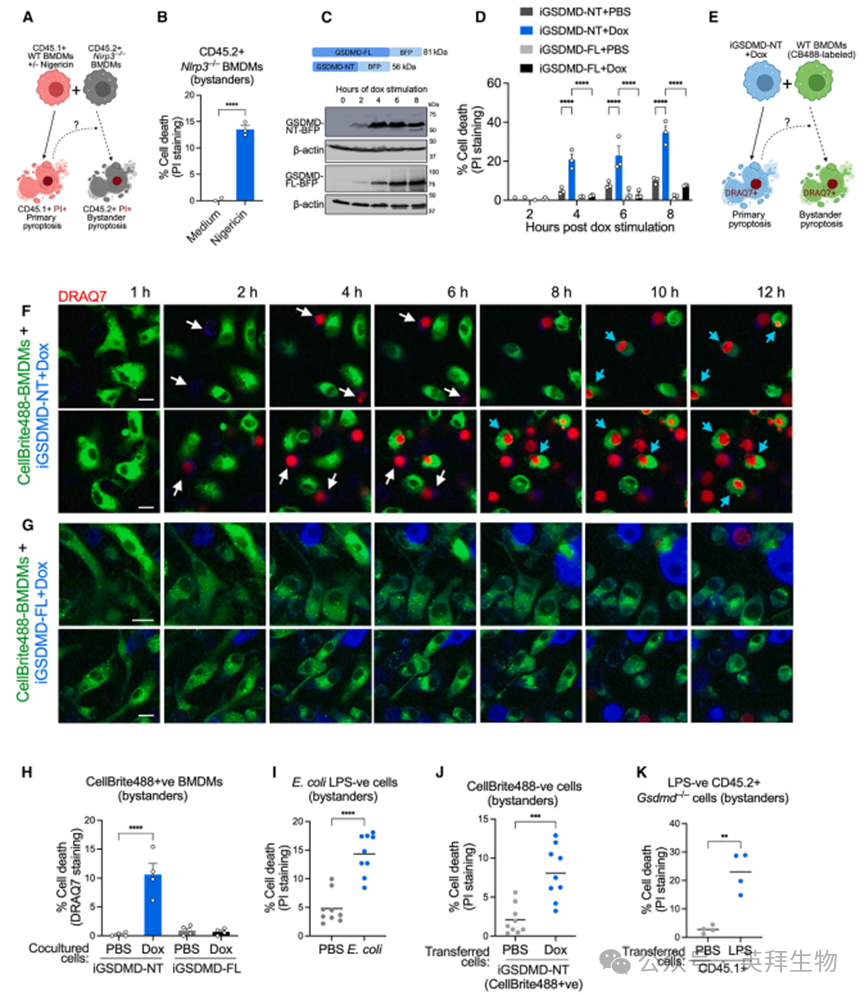
图1:焦亡的细胞间传播发生在体外和体内
4、由焦亡细胞释放的EVs介导旁细胞死亡
为确定焦亡上清液中诱导细胞死亡的因素,研究者通过尺寸排阻色谱法(SEC)对焦亡上清液进行分级,并筛选具有溶细胞活性的分级。这种方法鉴定出一个能够杀死未受影响 BMDMs 的分级(图 2A 和 2B),SEC 凝胶的洗脱谱表明该分级富含细胞外囊泡(EVs)——介导细胞间通讯的纳米结构。研究者使用电子显微镜(EM)确认了该分级中存在 EVs(图 2C 和 S3A)。这一观察结果促使研究者测试焦亡上清液的溶细胞活性是否包含在 EVs 中。通过超速离心从焦亡上清液中分离出 EVs,并验证其典型的 EV 标志物和结构(图 2D 和 2E)。引人注目的是,通过超速离心和 SEC 从焦亡上清液中分离出的 EVs 能够在未受影响的 WT BMDMs 中诱导细胞死亡(图 2F-2I,S3B 和 S3C)。同样,从用 Nigericin 诱导焦亡的 WT BMDMs(而非不会因 Nigericin 诱导焦亡的 Gsdmd⁻/⁻ 和 Nlrp3⁻/⁻ BMDMs)中分离出的 EVs 能够触发未受影响 WT BMDMs 的细胞死亡(图 2J 和 2K)。HeLa 和 HEK293T 细胞也对 EV 介导的死亡敏感,表明许多旁观者细胞类型易受 EV 传播的死亡影响(图 2L-2O)。值得注意的是,通过超速离心从焦亡上清液中去除 EVs 后,上清液失去了引起细胞死亡的能力(图 2P)。这些数据表明,EVs 是焦亡上清液裂解细胞活性的充分和必要条件。
接下来,将焦亡 EVs 注射到 Gsdmd⁻/⁻ 小鼠的腹腔中——选择该品系是为了消除受体小鼠 GSDMD 的任何混杂效应,并评估腹腔细胞的死亡情况。焦亡 EVs 而非对照 EVs 诱导了 Gsdmd⁻/⁻ 小鼠腹腔细胞的死亡(图 2Q)。此外,对注射对照和焦亡 EVs 的 Gsdmd⁻/⁻ 小鼠的脾脏进行转录组分析显示,焦亡 EVs 上调了与细胞死亡和炎症相关的许多通路,如焦亡、细胞因子风暴和急性期反应(图 2R、2S 和 S3D)。此外,焦亡 EVs 在 Gsdmd⁻/⁻ 小鼠中诱导了组织损伤,这从血浆中 LDH 水平升高可以明显看出(图 2T)。旁观者焦亡通常发生在由 PAMPs 引起的炎症微环境中。为了模拟这种微环境并了解旁观者焦亡对正在进行的炎症的影响,用非致死剂量的 LPS 预处理的 Gsdmd⁻/⁻ 小鼠被注射了对照和焦亡 EVs。Gsdmd⁻/⁻ 小鼠被用于排除受体小鼠因细胞质 LPS 诱导的原发性焦亡的混杂效应。焦亡 EVs 显著增强了炎症反应,这从血浆中 IL-6、肿瘤坏死因子(TNF)和半乳凝素-1 水平升高可以明显看出(图 S3E-S3G),而没有在小鼠中引起致死性(图 S3H)。这些结果表明,虽然 EV 驱动的旁观者焦亡在没有原发性焦亡的情况下不足以对小鼠造成致死性,但它仍然促进了炎症反应。
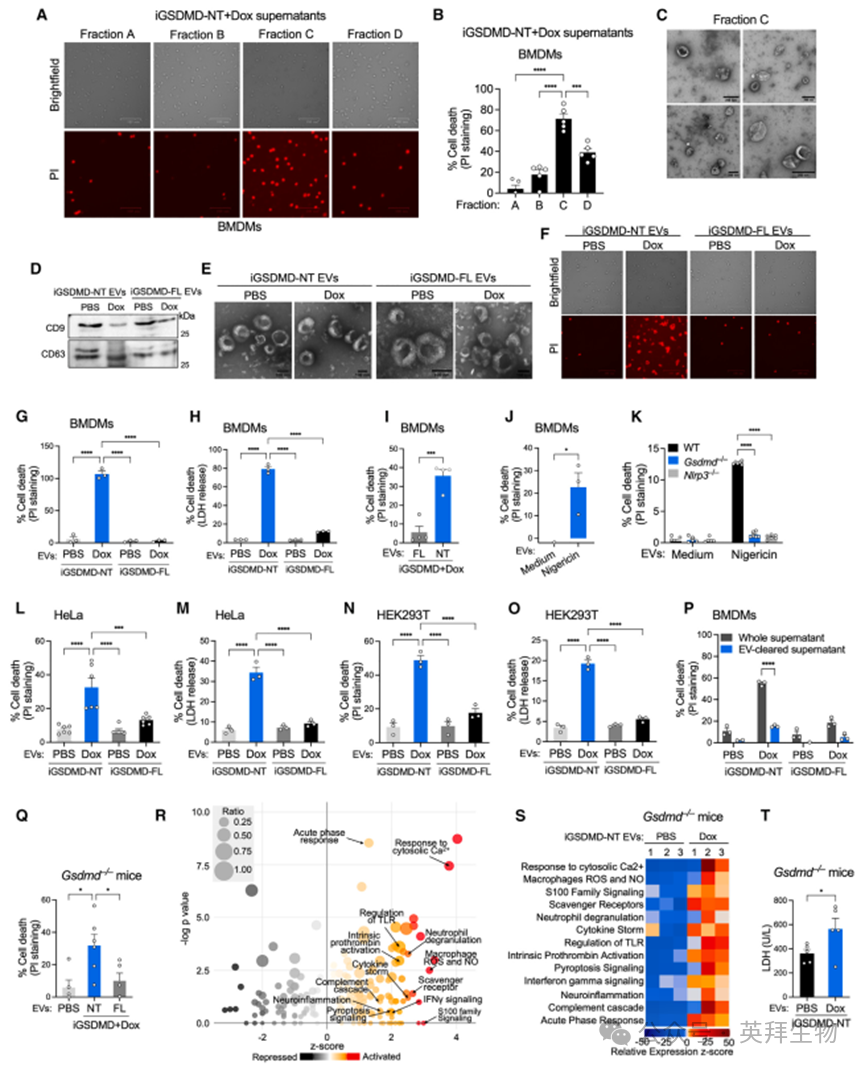
图2:焦亡EVs介导焦亡的细胞间传播
5、焦亡EVs携带活性GSDMD
为理解焦亡 EVs 如何传播焦亡,研究者考虑了焦亡 EV 相关的损伤相关分子模式(DAMPs)是否可能激活受体细胞中的炎症体从而导致细胞死亡。排除这种可能性后,焦亡 EVs 在 WT 和 Nlrp3⁻/⁻ BMDMs 以及 RAW 巨噬细胞中诱导了相当的细胞死亡(图 3A 和 S3I)。尽管焦亡 EVs 中存在活性 caspase-1,它们在 WT 和 Gsdmd⁻/⁻ 细胞中诱导了相当的死亡(图 S3K)。因此,焦亡 EV 中的 caspase-1 似乎对旁观者杀伤是可有可无的,因为即使 EV 中的 caspase-1 仍需要受体细胞中的 GSDMD 才能杀死它们。同样,从 Dox 刺激的 iBMDM-iGSDMD-NT 细胞中分离出的 EVs 也能在 Gsdmd⁻/⁻ BMDMs 中诱导溶细胞死亡(图 3A)。这与 HEK293T 细胞——无炎症体信号能力的细胞——对焦亡 EVs 的杀伤敏感是一致的(图 2N 和 2O)。这些观察结果表明,焦亡 EVs 的活性并不依赖于 DAMPs 激活的炎症体,也不依赖于受体细胞的炎症体机制。鉴于即使受体细胞中的 GSDMD 对焦亡 EV 诱导的死亡也是可有可无的,研究者怀疑焦亡 EVs 是否携带活性 GSDMD 并将其传递给受体细胞,从而以细胞外源性方式导致它们的溶解。支持这一点的是,研究者在从 iBMDM-iGSDMD-NT 细胞释放的焦亡 EVs 中通过免疫印迹法检测到了 GSDMD-NT(图 3B)。同样,成像流式细胞术揭示了从焦亡细胞中分离出的 CD9/CD63/CD81⁺ EVs 中显著的 GSDMD-NT-BFP 信号(图 3C、3D 和 S3L-S3N)。
引人注目的是,对 Dox 刺激的 iBMDM-iGSDMD-NT 细胞进行 GSDMD 免疫金标记并进行电子显微镜成像,识别出焦亡细胞释放的 EVs 上的 GSDMD-NT(图 3E)。此外,对从 Dox 刺激的 iBMDM-iGSDMD-NT 细胞中分离出的 EVs 进行 GSDMD 免疫金标记并进行电子显微镜成像,显示焦亡 EVs 上的 GSDMD-NT 定位(图 3F)。同样,从用 Nigericin 刺激的 WT iBMDMs 中分离出的 EVs 也携带了 GSDMD-NT(图 3G)。从体内 LPS 诱导的非典型炎症体激活后的血浆中纯化的 EVs 也含有 GSDMD-NT(图 3H)。因此,对焦亡细胞及其 EVs 的独立检测表明,体外和体内 EVs 上/内存在活性 GSDMD。此外,基于 BFP 的定量显示,在焦亡细胞腹腔内转移后,腹腔中 GSDMD⁺ EVs 的数量高于血液(图 S3O 和 S3P)。这一快照分析并未计算所有 GSDMD⁺ EVs,而只是在该时间点可回收的那部分,因为 EVs 不断被引流到循环中并被传播。尽管如此,在体内焦亡细胞释放的 GSDMD⁺ EVs 达到了可能足以引起大量旁观者死亡的水平。
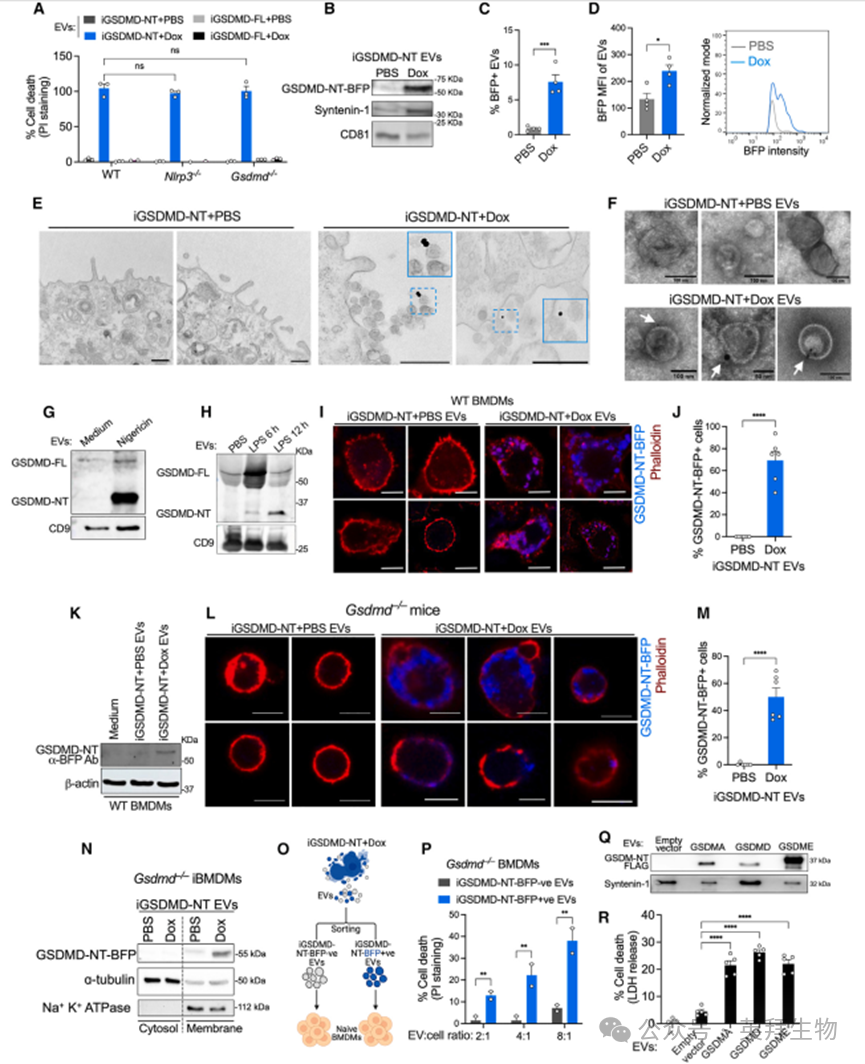
图3:焦细胞释放的EVs通过GSDMD杀死旁观者细胞
6、焦亡EVs将活性GSDMD转移到幼稚细胞并诱导旁细胞焦亡
接下来,研究者研究焦亡 EVs 是否将它们的活性 GSDMD 转移到未受影响细胞。共聚焦显微镜检测到在用焦亡 EVs 刺激的巨噬细胞中存在 iGSDMD-NT-BFP 信号。引人注目的是,iGSDMD-NT 信号主要定位于受体细胞的细胞膜上(图 3I 和 S4A)。表现出 iGSDMD-NT-BFP 信号的 EV 刺激巨噬细胞也发生了焦亡(DRAQ7⁺)(图 S4B)。同样,通过免疫印迹法在焦亡 EV 处理的巨噬细胞裂解物中检测到 iGSDMD-NT-BFP(图 3K)。此外,在用 iGSDMD-NT-BFP EVs 注射的 Gsdmd⁻/⁻ 小鼠的腹腔细胞中检测到 iGSDMD-NT-BFP(图 3L 和 3M)。因此,这些数据表明焦亡 EVs 将 GSDMD-NT 转移到了未受影响细胞。值得注意的是,在 Gsdmd⁻/⁻ iBMDMs 中,GSDMD-NT 被发现在细胞膜部分而非细胞质部分(图 3N)。免疫电镜也揭示了在用 iGSDMD-NT EVs 处理的 Gsdmd⁻/⁻ BMDMs 中,GSDMD-NT 定位于细胞膜(图 S4D)。
焦亡 EV 将 GSDMD-NT 转移到旁观者细胞并杀死它们,表明旁观者细胞的死亡是由 GSDMD-NT 介导的。为测试这一点,研究者根据 BFP 荧光将 Dox 处理的 iBMDM-iGSDMD-NT 细胞释放的 EVs 分选为 GSDMD-NT⁺ 和 GSDMD-NT⁻ EVs,并评估它们对未受影响的 Gsdmd⁻/⁻ BMDMs 的溶细胞活性(图 3O)。虽然用 GSDMD-NT⁺ EVs 刺激的 Gsdmd⁻/⁻ BMDMs 发生了细胞死亡,但用 GSDMD-NT⁻ EVs 刺激的细胞没有(图 3P)。此外,即使在最低剂量的 GSDMD-NT⁺ EVs(EV-to-cell 比率为 2:1)下,未受影响的细胞也显著死亡,而更高剂量的 EVs(EV-to-cell 比率为 4:1 和 8:1)杀死了更大比例的未受影响细胞(图 3P)。因此,只有来自同一焦亡细胞群体的 GSDMD-NT⁺ EVs 而非 GSDMD-NT⁻ EVs 引起受体细胞死亡,将受体细胞的死亡归因于 GSDMD-NT。总之,这些数据表明,焦亡细胞释放的 EVs 通过活性 GSDMD 触发旁观者焦亡。
从过表达活性 GSDMA 和 GSDME 并发生焦亡的 HEK293T 细胞中分离的 EVs 含有 GSDMA 和 GSDME(图 3Q),并且能够杀死未受影响的细胞(图 3R)。此外,从坏死细胞中分离的 EVs 含有活性 MLKL,即坏死的执行者,并诱导旁观者细胞死亡(图 S4E 和 S4F)。这些数据表明,携带成孔蛋白并杀死旁观者细胞是发生焦亡和坏死的细胞释放的 EVs 的共同特征。
7、GSDMD以孔隙形式存在于焦亡EVs上
GSDMD-NT 可能以单体或更高阶结构的形式被加载到焦亡EV 脂质双层上或进入其腔室。因此,研究者试图确定 GSDMD 在焦亡 EVs 上的定位和构象。对焦亡细胞和它们释放的 EVs 进行免疫电镜分析,显示 GSDMD 染色位于 EVs 的外边缘(图 3E 和 3F)。与 EV 表面定位的 GSDMD 一致,胰蛋白酶处理焦亡 EVs 减少了 GSDMD 信号(图 4A 和 S4G)和旁观者杀伤(图 4B)。此外,通过DSS交联后进行免疫印迹分析发现,焦亡 EVs 中存在 GSDMD 寡聚物(图 4C 和 4D)。
为精确确定焦亡 EVs 上 GSDMD 的结构构象,对 iBMDM-iGSDMD-NT EVs 和对照 EVs 进行了抗 tagBFP 纳米抗体携带 DNA 码头链的染色,并进行了 DNA-PAINT 超分辨率显微镜分析——正如研究者最近用于解析焦亡细胞质膜上 GSDMD 结构那样。GSDMD-NT-BFP 染色与 DNA-PAINT 定位相关(图 4E),并且在 iBMDM-iGSDMD-NT EVs 中,超分辨率的 GSDMD-NT 结构密度高于对照 EVs(图 4F)。引人注目的是,研究者在 iBMDM-iGSDMD-NT EVs 中观察到了环状、弧状和线条状的 GSDMD-NT 纳米结构(图 4G 和4H)。这些弧和环结构的 EV 相关 GSDMD-NT 在形状和大小上与焦亡细胞质膜上可视化的结构相似,表明这些是焦亡中功能性 GSDMD 结构。这一结果表明,GSDMD 以孔的形式存在于焦亡细胞释放的 EVs 上。为验证这一点,将焦亡 EVs 用 C12E8 去垢剂处理以提取 GSDMD 孔。随后对去垢剂提取物进行免疫电镜分析,揭示了 GSDMD-NT 阳性的孔状结构(图 4I)。综上所述,这些数据表明焦亡 EVs 携带以孔形式存在的 GSDMD。

图4:焦亡EVs含有GSDMD孔,并将GSDMD孔移植到旁观者细胞上
8、EVs移植GSDMD孔于旁细胞传播焦亡
考虑到焦亡 EVs 上的 GSDMD 孔,GSDMD 在焦亡 EV 处理的未受影响细胞的细胞膜中的主要定位,以及 EVs 与受体细胞细胞膜融合的能力,研究者假设焦亡 EVs 将 GSDMD 孔移植到未受影响细胞的细胞膜上,从而导致它们的死亡。为探索这一点,将来自 Dox 诱导的 iBMDM-iGSDMD-NT 和 iBMDM-iGSDMD-FL 细胞的 EVs 与封装有 6-羧基荧光素(6-FAM)的脂质体混合,并监测荧光染料的释放。来自 Dox 诱导的 iBMDM-iGSDMD-NT 细胞的 EVs 导致脂质体泄漏(图 4J)。双硫仑能够共价修饰 GSDMD-NT 的 Cys192,并阻断 GSDMD-NT 片段在膜上的插入和组装,但不影响预先存在的 GSDMD 孔。重要的是,研究者观察到双硫仑并未抑制由 GSDMD-NT-EVs 引起的脂质体泄漏(图 4K),这与研究者的数据一致,即 GSDMD-NT 孔已经存在于 EVs 上。与之相符的是,焦亡 EVs 诱导未受影响细胞死亡的能力并未受到 EVs 或受体细胞用双硫仑预处理的影响(图 4L、4M 和 S4I)。
此外,研究者通过将重组 GSDMD 与 caspase-11 孵育生成带有 GSDMD 孔的脂质体。这些带有 GSDMD 孔的脂质体随后通过重力色谱法纯化,以去除自由的 GSDMD。然后,将这些带有 GSDMD 孔的脂质体与新鲜脂质体或 BMDMs 在双硫仑存在的情况下共同孵育,以进一步测试 GSDMD 孔是否可以从一个脂质双层转移到另一个脂质双层。支持这一观点的是,带有 GSDMD 孔的脂质体诱导了新鲜脂质体的泄漏以及 WT BMDMs 的溶细胞死亡,且这一过程不受双硫仑影响(图 4N 和 4O)。相比之下,外源添加的自由活性 GSDMD 并未导致 WT BMDMs 的细胞死亡,表明与 EVs 相关联的 GSDMD 孔而非单体 GSDMD-NT 导致了旁观者焦亡(图 4O)。此外,根据这一 EV 介导的孔移植模型,焦亡 EVs 可以通过将 GSDMD 孔插入它们的细胞膜来杀死未受影响细胞,而无需细胞摄取 EVs。支持这一点的是,焦亡 EV 诱导的细胞死亡在用细胞松弛素 D 或拉特克林 B 预处理以抑制 EV 内化的细胞中仍然保持完整(图 4P)。相比之下,细胞松弛素 D 和拉特克林 B 抑制了弗朗西斯菌诱导的焦亡。综合上述发现,支持研究者的假设,即焦亡 EVs 将 GSDMD 孔移植到旁观者细胞上,导致它们以细胞外源性方式死亡。
结论:
由于GSDMs对质膜内侧的磷脂酰肌醇具有亲和力,而对质膜外侧的磷脂酰肌醇没有亲和力,普遍认为 GSDMs 只能在细胞内侧形成孔道,从而杀死细胞。然而,研究者的研究发现,焦亡细胞释放的 EVs 上携带的 GSDMD 孔可以整合到旁观者细胞的质膜中,触发它们的细胞外源性溶解。这些存在于 EVs 上的 GSDMD 孔保持可移植性和细胞毒性。这一 GSDMD 孔移植模型得到了多条证据的支持,包括 EVs 上存在 GSDMD 孔、旁观者细胞死亡对双硫仑(一种抑制 GSDMD 孔形成的化合物)不敏感,以及 GSDMD 孔负载的脂质体能够使未受影响的脂质体和细胞发生溶解。尽管焦亡细胞通过细胞因子、DAMPs 和 ASC 焦点等影响旁观者细胞,但焦亡细胞通过 EVs 将 GSDMD 孔传递给旁观者细胞并驱动其死亡,代表了一种不同的后果。这种焦亡的传播性或许可以解释在脓毒症中观察到的广泛的旁观者细胞死亡。由于广泛细胞死亡与更差的预后相关,旁观者焦亡具有病理学意义,或许可以作为治疗靶点。
参考文献:
Wright SS, Kumari P, Fraile-Ágreda V, Wang C, Shivcharan S, Kappelhoff S, Margheritis EG, Matz A, Vasudevan SO, Rubio I, Bauer M, Zhou B, Vanaja SK, Cosentino K, Ruan J, Rathinam VA. Transplantation of gasdermin pores by extracellular vesicles propagates pyroptosis to bystander cells. Cell. 2025 Jan 23;188(2):280-291.e17. doi: 10.1016/j.cell.2024.11.018. Epub 2024 Dec 31. PMID: 39742811; PMCID: PMC12272064.

本周
本月
本年
单个细胞也能提取核酸?超全干货教你微量样本发高分(含完整电子版宝典资料))
LetPub发布最新SCI影响因子查询及期刊投稿分析系统
应用gentleMACS™灌流技术从脂肪肝小鼠模型高效分离肝细胞与非实质细胞
草甘膦(glyphosate)酶联免疫分析(ELISA)试剂盒使用说明书
ELISpot试剂盒限时特惠!一口价低至500元,加赠免费读板服务
LetPub完整SCI影响因子、期刊分区查询系统
Elabscience® 从原料到标记,打造属于中国自己的流式抗体品牌
链脲佐菌素 (Streptozotocin,STZ)-糖尿病动物模型造模
淋巴细胞百分比偏低原因解析
11月Cell重磅:新线粒体细胞死亡方式!或将引爆国自然新热点!先天免疫和代谢信号通过线粒体周膜裂解诱导线粒体依赖性膜裂解
- 促销公告
- 更多 ›
你可能感兴趣的产品
- 细胞焦亡(pyroptosis)
- 细胞焦亡检测
- GSDMD siRNA/GSDMD siRNA/GSDMD siRNA
- GSDMD antibody| GSDMD抗体
- Pyroptosis (细胞焦亡)
- GSDMD抗体;GSDMD Polyclonal Antibody
- GSDMD
- GSDMD抗体GSDMD兔多抗抗体GSDMD_HUMAN antibody抗体GSDMD Antibody抗体
- GSDMD antibody|GSDMD抗体 FNab03670
- Human GSDMD Antibody-Human GSDMD Antibody
- GSDMD抗体 | Anti-GSDMD Polyclonal Antibody
- GSDMD重组兔单抗 GSDMD Rabbit mAb


