【核糖体碰撞-经典研究】 |细胞中的"交通堵塞"竟能决定生死?科学家揭示核糖体碰撞如何调控细胞命运
2025-09-22 16:04点击次数:593
关键词:广州卿泽生物科技有限公司导读:
想象一下,当我们的身体遭遇寒冷、饥饿或紫外线伤害时,细胞内部会发生什么?科学家们发现,细胞在面对这些压力时,会启动一系列精妙的应激反应机制。其中,两种关键通路尤为引人注目:
1. SAPK(应激激活蛋白激酶)通路:包括p38和JNK两种激酶,前者让细胞暂停生长,后者则可能启动"自杀"程序;
2. GCN2介导的整合应激反应(ISR):通过磷酸化eIF2α来全局降低蛋白质合成,给细胞喘息的机会。
特别有趣的是,这两种通路都能被靶向核糖体的抗生素(如茴香霉素)激活,但具体机制一直是个谜。与此同时,科学家们发现核糖体在翻译mRNA时如果发生"追尾"(碰撞),会触发质量控制机制。那么,这种"交通堵塞"是否就是细胞感知压力的通用信号呢?
科学问题:核糖体碰撞如何成为细胞命运的"指挥家"?

文章索引:
标题:Ribosome Collisions Trigger General Stress Responses to Regulate Cell Fate.
发表期刊:Cell
发表时间:2020.07
作者团队:约翰霍普金斯大学医学院 Rachel Green团队
IF:42.5
DOI:10.1016/j.cell.2020.06.006.
研究结果
(1)核糖体碰撞激活SAPKs(p38/JNK)
研究表明核糖体碰撞参与了mRNA特异性的质量控制(QC),那核糖体毒性应激反应(RSR)是由普遍延伸缓慢的核糖体激活,还是由核糖体碰撞所激活的呢?
作者通过一系列精巧的实验设计,系统性地揭示了核糖体碰撞与SAPK(p38/JNK)磷酸化激活之间的因果关系。首先建立了理论模型(图1A),将核糖体状态分为未处理(正常翻译)、中等剂量抑制剂(产生部分核糖体停滞和碰撞)和高剂量抑制剂(所有核糖体同步停滞)三种情况。
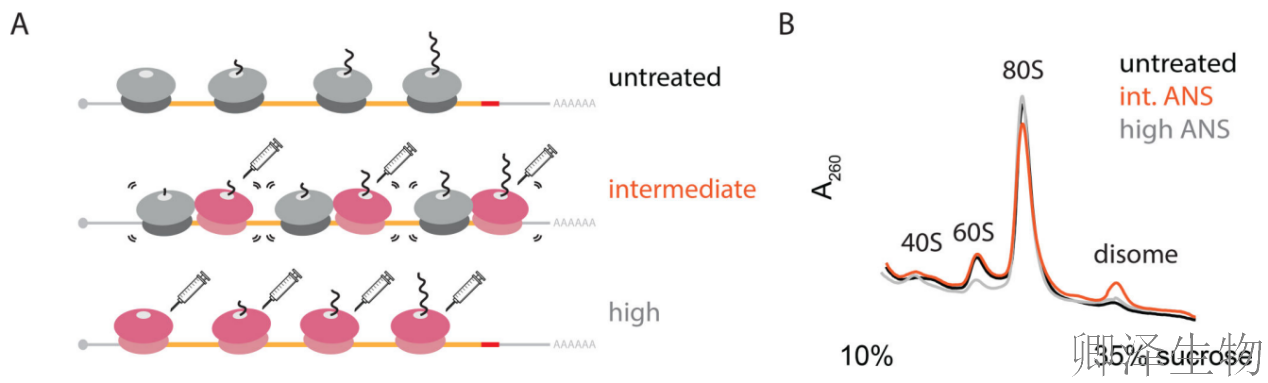
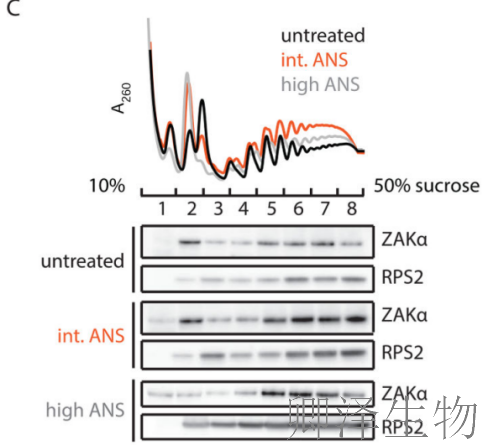
RNase消化后的Polysome profiling分析(图1B)显示,中等剂量茴香霉素(ANS,1 mg/L)处理时,抗RNase消化的核糖体二聚体(disome)显著增加,而高剂量(100 mg/L)反而减少,这直接证明了中等剂量条件下核糖体碰撞的积累。
与此对应,免疫印迹分析(图1C)显示p38和JNK的磷酸化水平在中等剂量ANS处理时达到峰值,高剂量时反而降低,表明SAPK的激活需要核糖体碰撞而非单纯的翻译停滞。
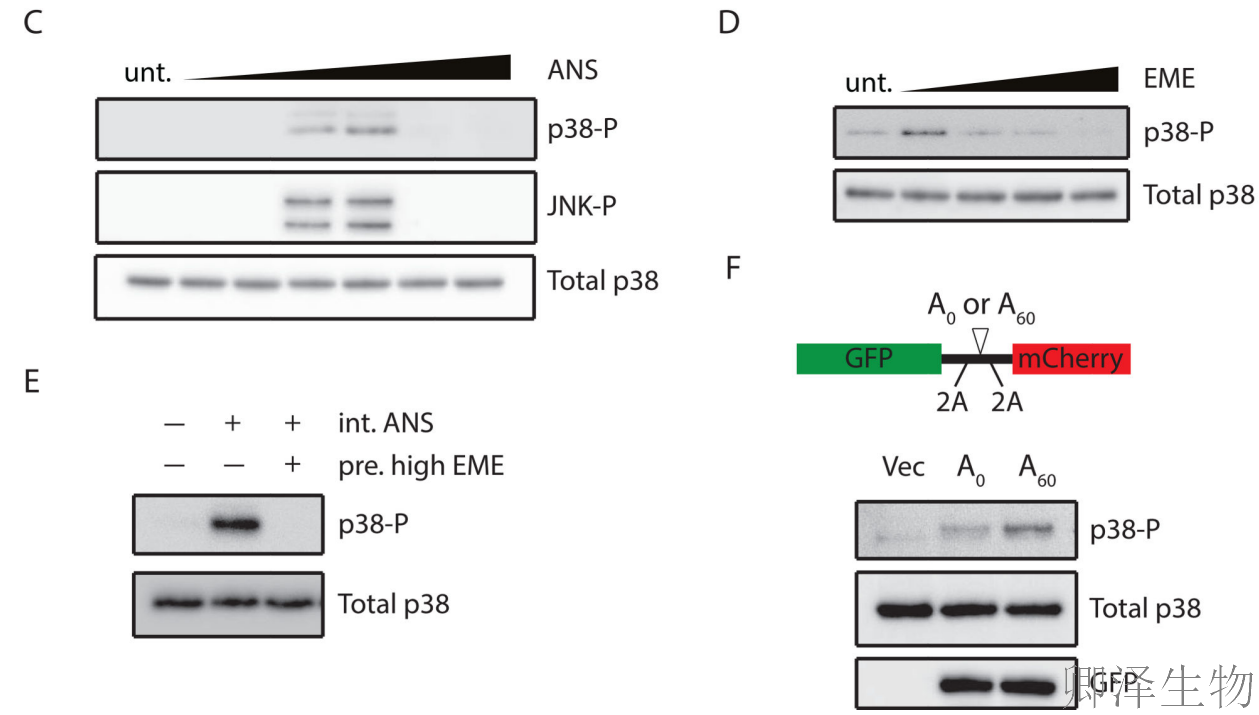
作者使用另一种延伸抑制剂EME进行了验证实验(图1D),发现同样的响应模式,排除了药物特异性的可能。其次,作者发现用高剂量EME预处理细胞以使所有核糖体均匀停滞,可以阻止后续添加中等剂量ANS引发的p38磷酸化,这表明需要处于主动延伸状态的核糖体才能形成碰撞积累。
最后,通过遗传学方法(图1F),作者构建了含poly(A)60序列的报告基因(A60),其转染可诱导p38磷酸化,而对照载体(Vec)或无停滞序列的报告基因(A0)效果较弱。这进一步证实特定mRNA序列引起的核糖体碰撞足以激活SAPK通路。
这一系列实验环环相扣,从化学抑制到遗传操控,从生物化学证据到信号检测,全面证实了核糖体碰撞是SAPK通路激活的关键触发因素。
(2)ZAK对于核糖体碰撞诱导的SAPK激活是必需的
一项先前的研究确定了MAPKKK-ZAK是将RSR与SAPK激活连接起来的上游激酶。因此,在本节中,作者阐明了ZAKα亚型特异性、结构域要求和自磷酸化特征。
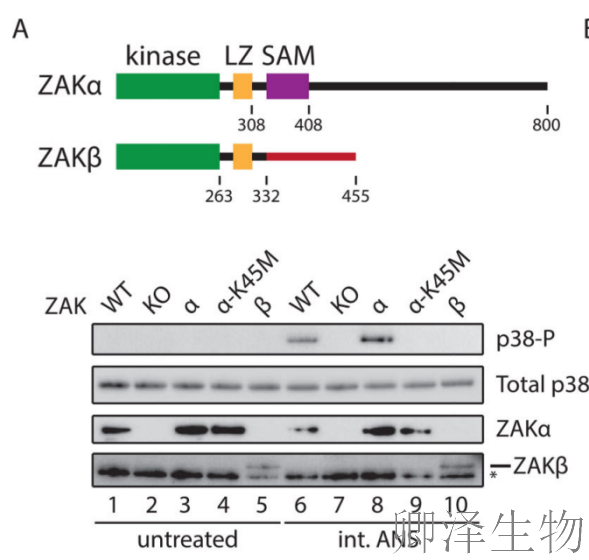
关键发现一:ZAKα亚型特异性激活
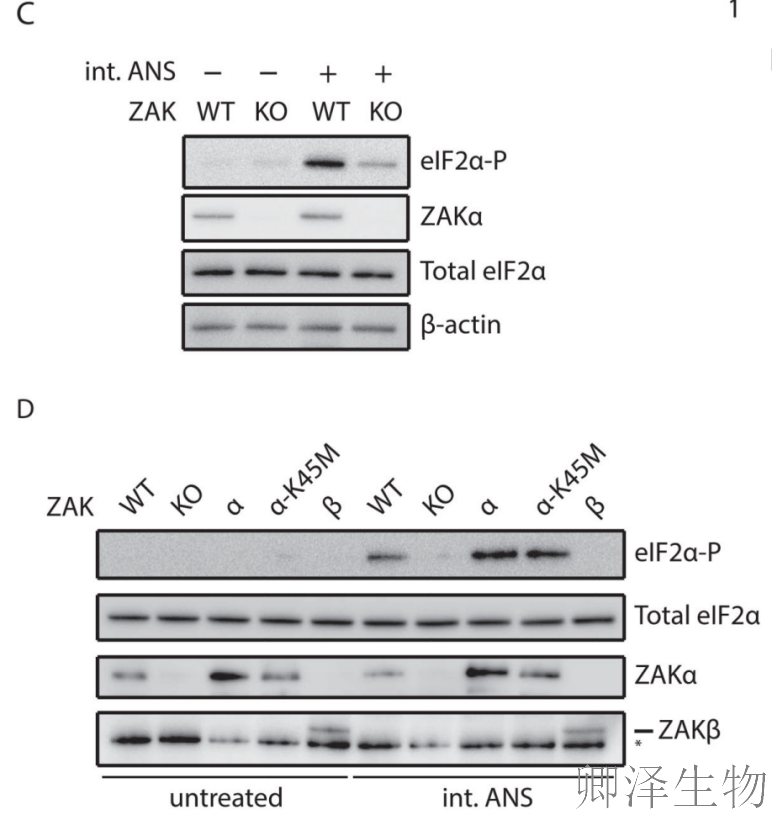
作者比较了ZAK两种亚型的功能差异(图2A)。实验显示:在ZAK敲除(KO)细胞中,ANS诱导的p38磷酸化完全消失;仅回补ZAKα能恢复p38磷酸化,而ZAKβ则不能,ATP结合缺陷突变体(K45M)丧失激活能力。这些结果证明ZAKα是介导核糖体碰撞信号的特异性亚型,且其激酶活性不可或缺。
关键发现二:C端结构域的关键作用
通过构建系列缺失突变体(图2B),研究人员发现:删除C端80个氨基酸(ZAKα 1-720)仅轻微减弱信号传导,删除151个氨基酸(ZAKα 1-649)则完全丧失功能。
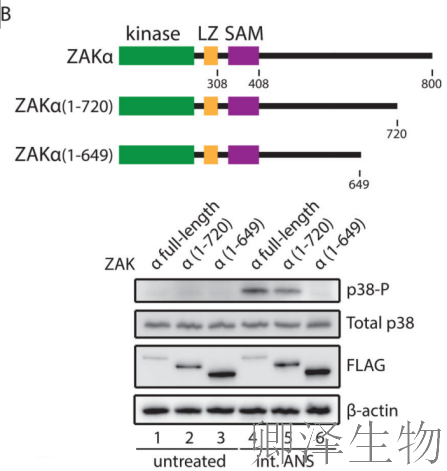
这表明ZAKα C端存在一个约70个氨基酸(649-720位)的关键区域,对信号传导至关重要。
关键发现三:剂量依赖的磷酸化响应
使用Phos-tag凝胶技术,作者捕捉到ZAKα磷酸化的动态变化:中等剂量ANS(1 mg/L)处理时,ZAKα磷酸化显著增强(图2C),但高剂量(100 mg/L)时磷酸化水平回落。EME处理也呈现类似但稍弱的磷酸化模式(图2D)。
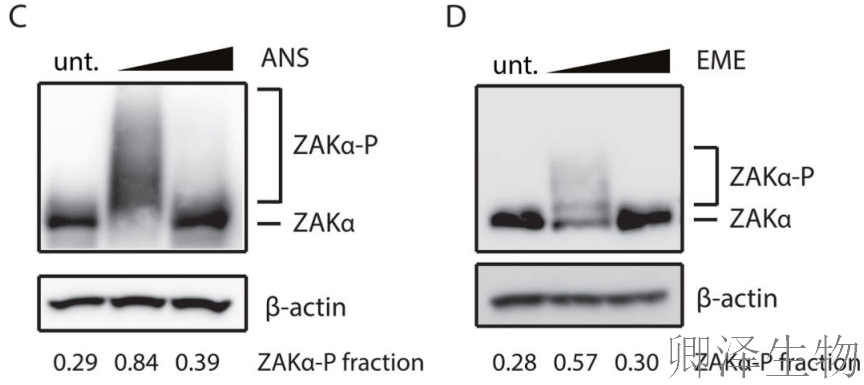
这种"钟形曲线"响应与p38激活模式高度一致,暗示ZAKα磷酸化是信号传导的关键步骤。
关键发现四:自磷酸化机制
通过精妙的遗传学设计,研究人员揭示了ZAKα的激活机制:K45M突变完全阻断磷酸化(图2E),证明激酶活性是自磷酸化的前提。在表达内源ZAKα的细胞中,外源FLAG-ZAKα的磷酸化严格依赖其自身激酶活性(图2F)。
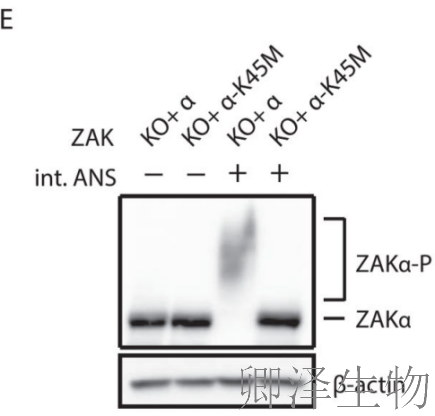
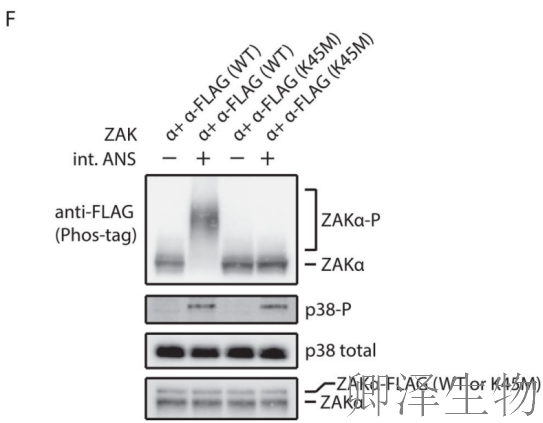
这些结果确凿证明ZAKα通过cis自磷酸化机制激活,是其作为分子传感器的核心特征。
(3)ZAKα与碰撞核糖体结合,并通过自磷酸化激活
ZAKα是否直接与正在延伸的核糖体结合?作者通过多维度实验揭示了ZAKα作为核糖体碰撞传感器的精确工作机制,展现了其与不同状态核糖体的动态相互作用。
关键发现一:ZAKα特异性结合延伸中的核糖体
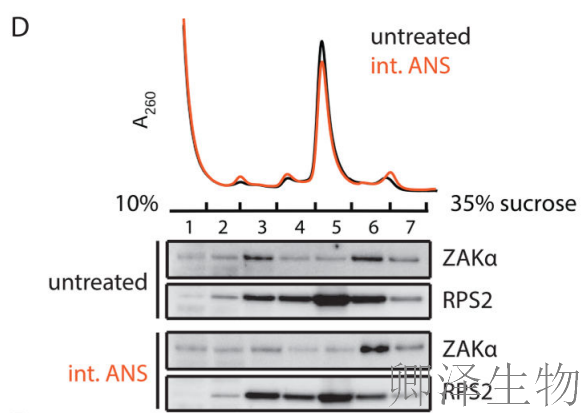
Polysome profiling实验结合WB发现:ZAKα和其激酶死亡突变体K45M都能结合单核糖体和多聚核糖体,而ZAKβ则完全不结合核糖体。C端截断实验显示,删除80个氨基酸(1-720)仅轻微减弱结合,而删除151个氨基酸(1-649)则完全丧失结合能力。
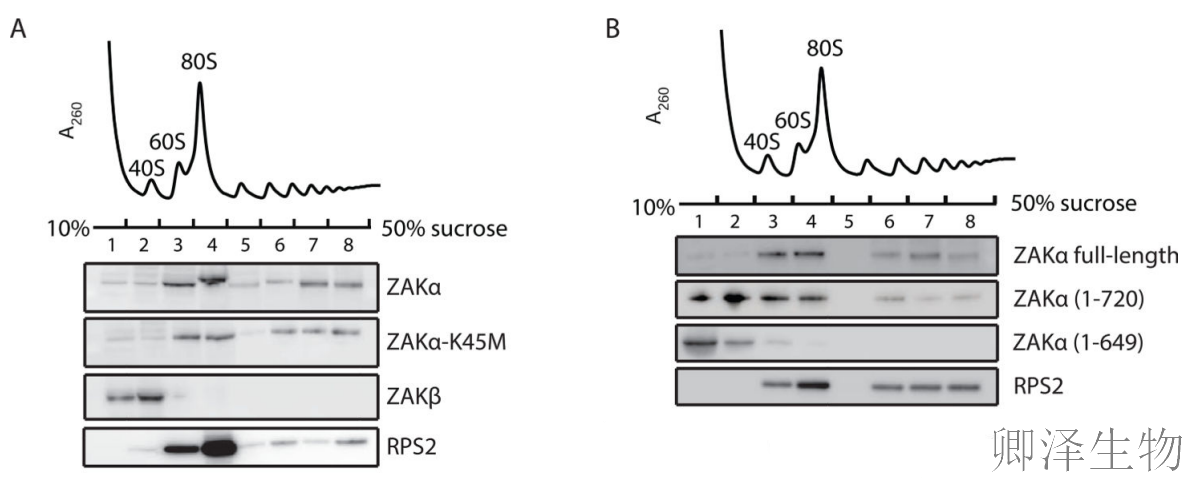
关键发现二:ZAKα偏好性结合碰撞的二聚体核糖体
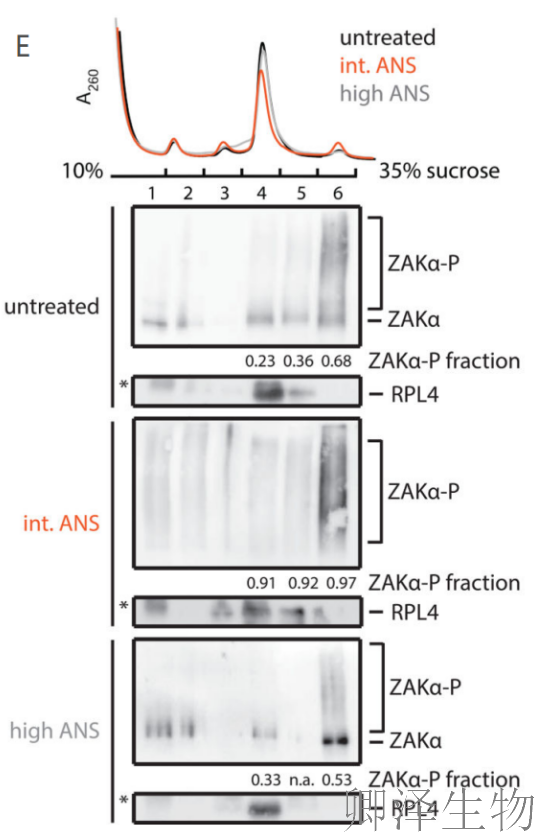
ZAKα与核糖体的关联是否在ANS刺激后发生变化?作者发现无论是否进行中等剂量或高剂量的ANS刺激,ZAKα都会与单体核糖体和多聚核糖体结合(图3C)。如果ZAKα能够感知核糖体碰撞并激活核糖体应激反应(RSR),那么,与单体核糖体相比,ZAKα更倾向于与发生碰撞的核糖体结合。当通过RNase处理使多聚核糖体解聚后(图3D),无论ANS剂量如何,ZAKα更倾向于与二聚体核糖体共同沉淀。
Phos-tag凝胶分析可监测ZAKα磷酸化,结构显示,二聚体结合形式的ZAKα磷酸化程度最高(图3E)。
关键发现三:全基因组水平揭示ZAKα的碰撞位点偏好
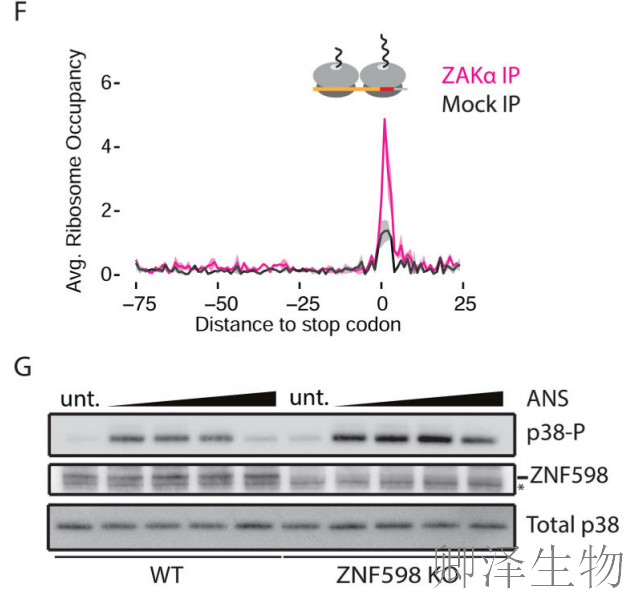
为了进一步定义zakα-核糖体关联,作者在ZAKα-FLAG OE细胞中进行了选择性核糖体分析。结果显示:ZAKα特异性富集在终止密码子位置的核糖体二聚体上(图3F),此外在已知会引起核糖体停滞的肽段序列(如P-P和P-D二肽)处也观察到显著富集。
关键发现四:ZAKα与质量控制机制的相互关系
核糖体碰撞可触发ZNF598(E3泛素连接酶)识别复合核糖体下游的mRNA特异性质量控制事件。在ZNF598(核糖体质量控制关键因子)敲除细胞中:p38磷酸化对ANS的响应更为敏感(图3F)。表明当质量控制机制缺失时,核糖体碰撞积累增加。
(4)核糖体碰撞触发GCN2介导的eIF2α磷酸化
细胞应激通常下调翻译起始,通过激活特定的基因表达程序来允许细胞恢复。系统揭示了核糖体碰撞如何通过ZAKα依赖性机制激活GCN2介导的eIF2α磷酸化,展现了应激反应中两条关键通路的交叉调控。
关键发现一:eIF2α磷酸化的"钟形曲线"响应
通过ANS剂量梯度实验发现(图4A):中等剂量ANS(0.5 mg/L)处理时eIF2α磷酸化达到峰值,高剂量(100 mg/L)处理时磷酸化水平回落。mTOR磷酸化不受影响,表明特异性激活,这种与p38相似的响应模式暗示核糖体碰撞是共同触发因素。
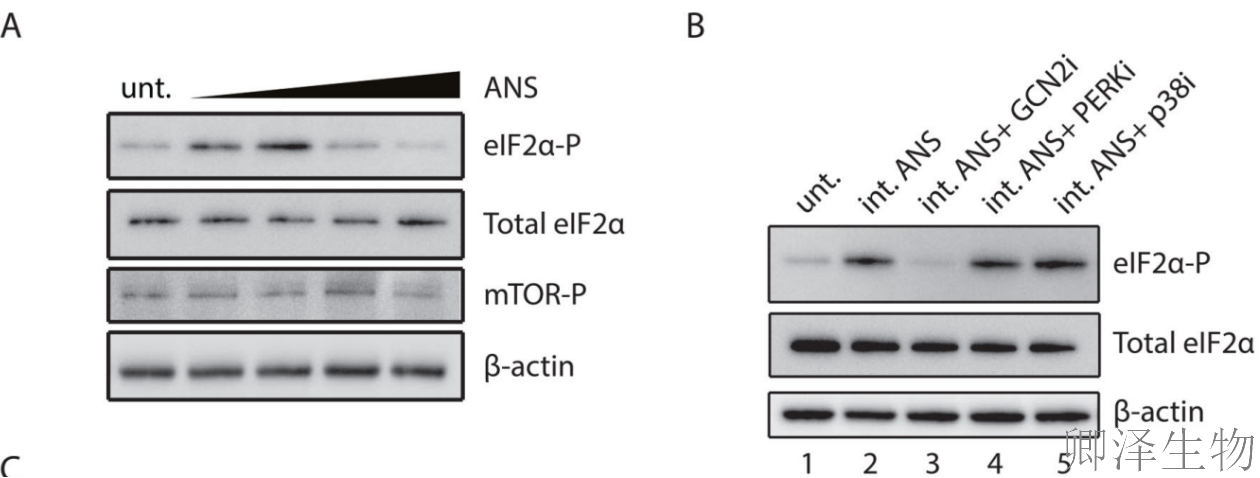
关键发现二:GCN2特异性介导磷酸化
使用特异性抑制剂证明(图4B):GCN2抑制剂完全阻断eIF2α磷酸化,PERK抑制剂则无影响,且p38抑制剂也不影响磷酸化。表明这是独立于SAPK通路的GCN2特异性激活。
关键发现三:ZAKα的桥梁作用
ZAKα是否对核糖体碰撞诱导的gcn2介导的eIF2α磷酸化至关重要?
在中等剂量的ANS下,ZAK KO细胞与WT细胞相比,eIF2α磷酸化明显降低(图4C)。互补分析表明,ZAKα和ZAKα- k45m恢复了eIF2α磷酸化的降低,但ZAKβ没有恢复(图4D)。表明ZAKα作为支架蛋白发挥作用,不依赖其激酶活性。
关键发现四:GCN1-核糖体结合依赖ZAKα
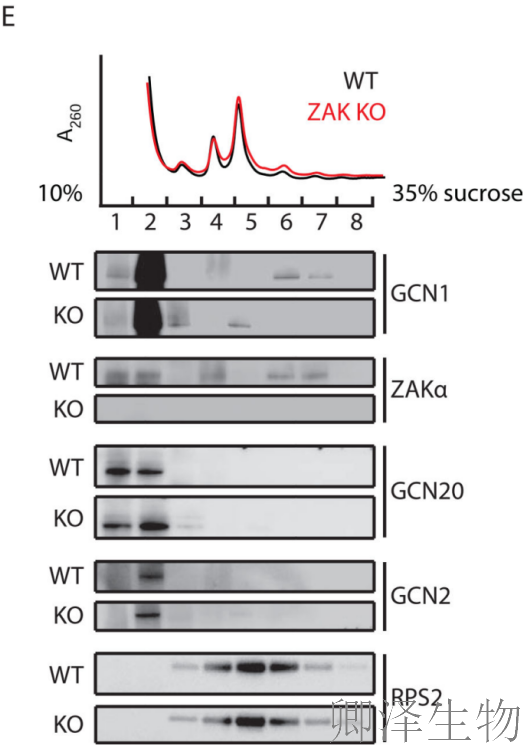
鉴于ZAKα和ZAKα- k45m都与核糖体相关(图3A),假设ZAKα在这种情况下的作用可能是结构或结合相关的,而不是催化作用。Polysome profiling分析显示(图4E):GCN1(GCN2激活因子)与核糖体二聚体结合,这种结合在ZAK敲除细胞中显著减弱。提示ZAKα促进GCN复合体与碰撞核糖体的结合。
(5)氨基酸缺乏导致核糖体碰撞,触发RSR
接下来,作者评估了核糖体碰撞诱导的应激激活机制对一般的细胞应激的影响,如氨基酸饥饿。
关键发现一:谷氨酰胺饥饿激活p38磷酸化
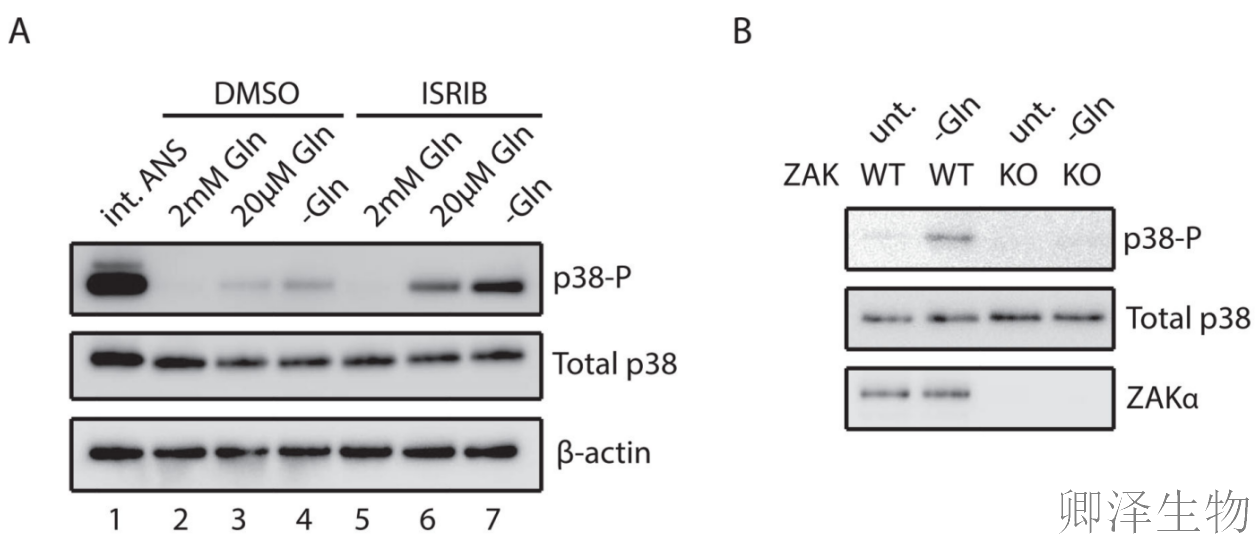
当谷氨酰胺浓度降低(2→0.02→0 mM)时,p38磷酸化逐渐增强,但激活程度明显低于中等剂量ANS处理(图5A)。使用ISRIB(阻断整合应激反应的化合物)后,p38磷酸化显著增强,表明氨基酸饥饿本身会引发适度的核糖体碰撞,而阻断ISR会加剧碰撞积累。
关键发现二:ZAKα依赖性激活
那ZAKα及其磷酸化是否对氨基酸饥饿反应中p38的激活是必要的?
作者发现野生型细胞在谷氨酰胺饥饿时显示明显的p38磷酸化,但ZAK敲除细胞中这种激活完全消失(图5B),证明氨基酸饥饿引发的信号传导严格依赖ZAKα。
关键发现三:ZAKα磷酸化动态变化
当细胞在谷氨酰胺匮乏的培养基中生长时,ZAKα磷酸化略有增加(图5C, 2-4通道),当饥饿细胞用ISRIB预处理时,ZAKα磷酸化进一步增加(图5C, 5-7通道)。这些结果表明,通过核糖体碰撞激活SAPK信号,ZAKα在感知细胞氨基酸水平中的作用。
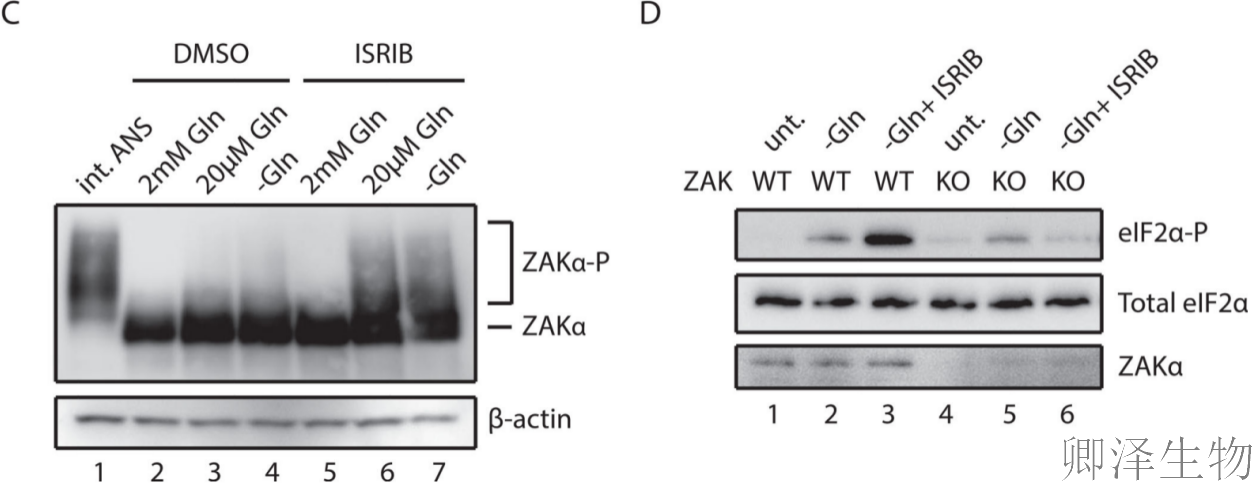
关键发现四:双通路调控模式
eIF2α磷酸化分析显示(图5D):在单纯谷氨酰胺饥饿时,ZAK敲除不影响eIF2α磷酸化,但在ISRIB存在下,ZAK敲除显著减弱磷酸化,揭示两种GCN2激活机制:通过不带电tRNA直接激活(不依赖ZAKα)或通过ZAKα增强的核糖体碰撞激活。
(6)紫外线照射损伤mRNA,引发核糖体碰撞和RSR
紫外线照射在短时间(分钟)内诱导RSR和eIF2α磷酸化。而且,紫外线照射会在DNA或者RNA中诱导嘧啶二聚体。那紫外线照射诱导的全局mRNA损伤是否会导致转录组范围内的核糖体碰撞和随后的ZAKα依赖性p38/JNK和eIF2α磷酸化。
首先,作者使用Polysome profiling分析来监测紫外线照射下核糖体的碰撞,并观察到UV处理显著增加抗RNase的核糖体二聚体(disome)积累(图6A),表明UV辐射确实导致核糖体碰撞的广泛发生。
为了获得体内核糖体动力学的更高分辨率,作者对未经处理和紫外线照射的细胞进行了Ribo-seq分析。UV处理细胞中短足迹(22nt,A位点空置)比例显著增加,长足迹(31nt,A位点占据)比例相应减少,提示UV导致核糖体在解码步骤被广泛阻滞。密码子占据分析显示(图6C):含相邻嘧啶的密码子(如CUU、UCU)在UV处理后显著富集,这些位点正是UV诱导的嘧啶二聚体形成热点,揭示mRNA损伤与翻译停滞的直接关联。
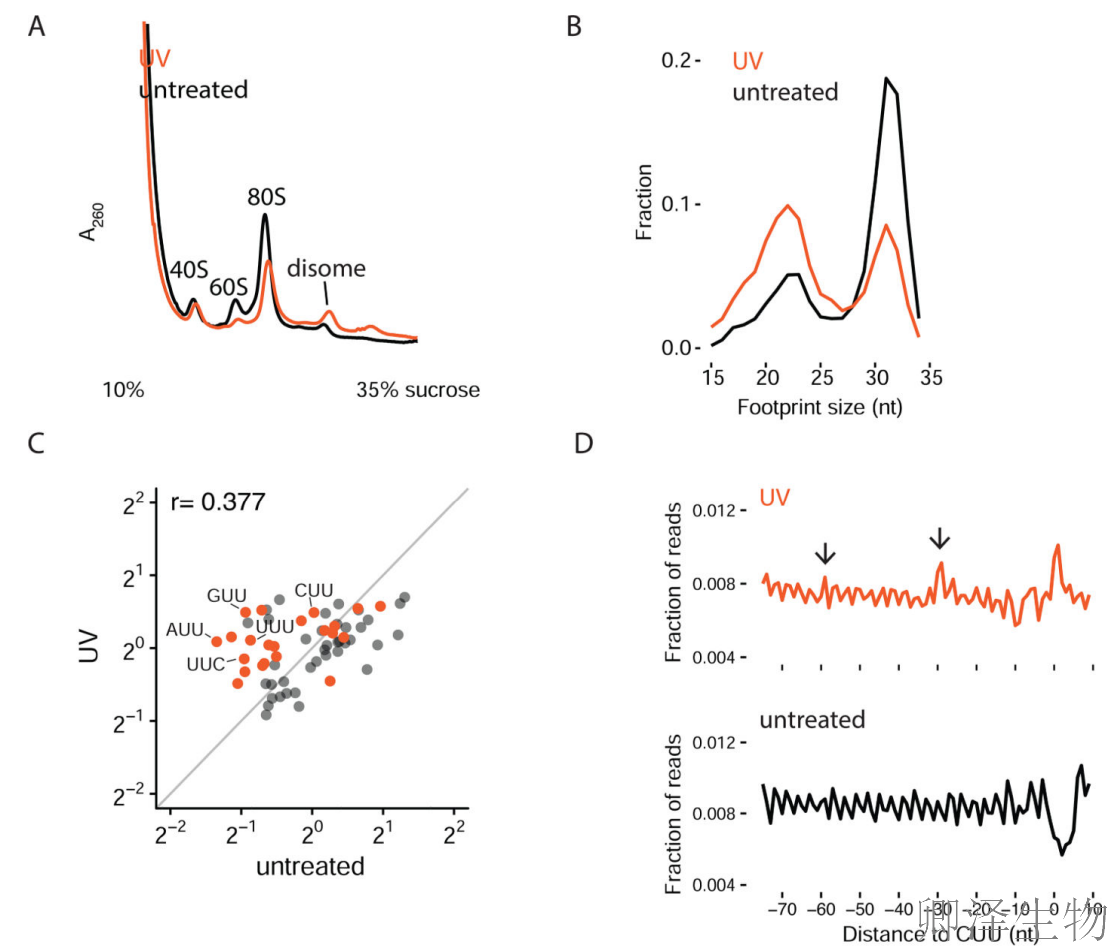
另外,在CUU密码子的meta分析中观察到(图6D):主停滞峰位于CUU密码子处,上游约30nt和60nt处出现次级峰,反映前导核糖体碰撞形成的特征性"排队"现象。
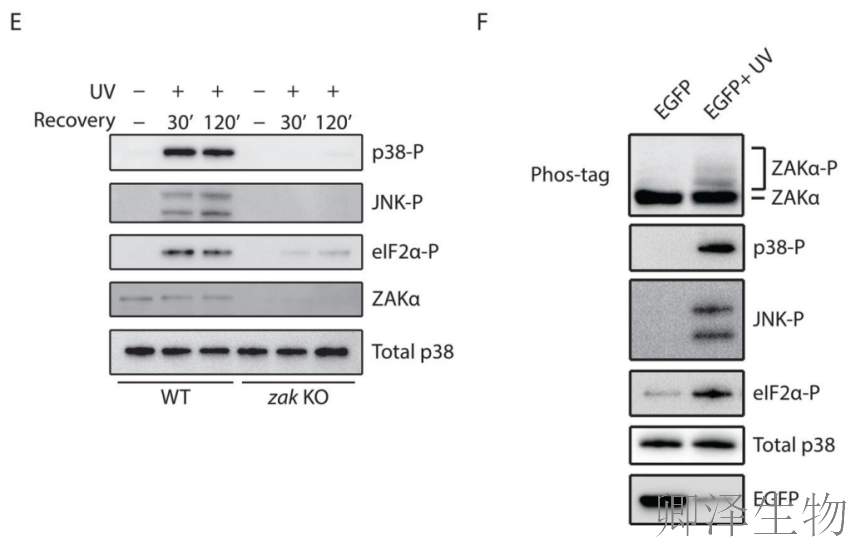
接下来,作者探讨了RSR和eIF2α磷酸化对ZAK的依赖性。事实上,p38/JNK和eIF2α磷酸化都以ZAK依赖的方式被紫外线照射激活(图6E)。最后,通过转染UV处理的EGFP mRNA(图6F)发现,仅mRNA损伤就足以激活ZAKα及其下游通路,排除DNA损伤或核糖体直接损伤的必要性。因此确立了mRNA损伤-核糖体碰撞-应激反应的因果链条。
研究结论
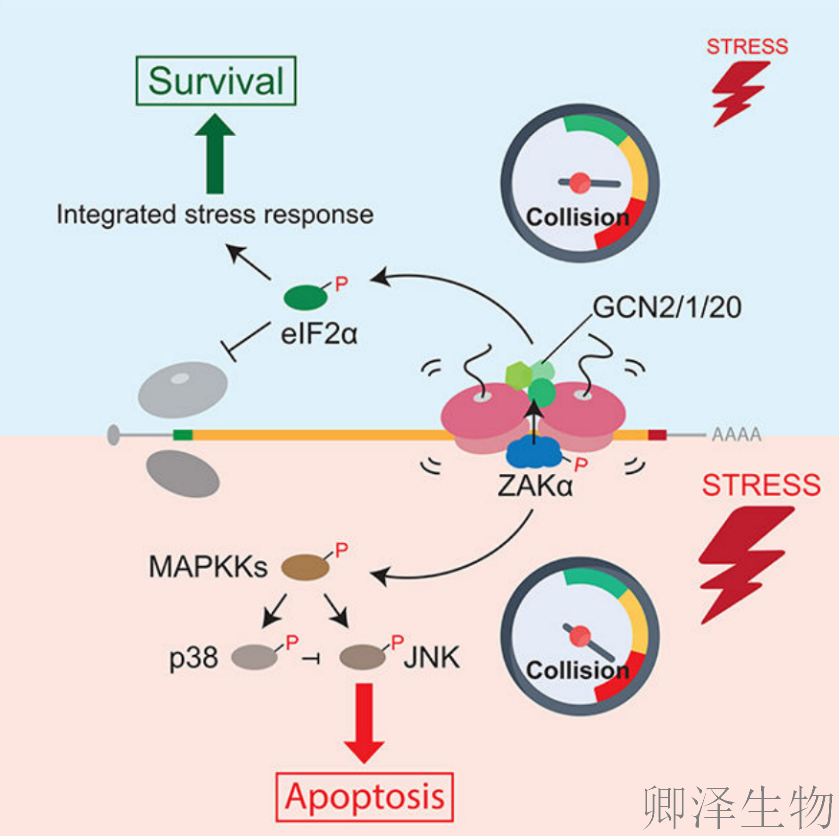
这项研究揭示了核糖体碰撞在信号转导中的作用。利用翻译延伸抑制剂和一般的细胞应激条件,包括氨基酸饥饿和紫外线照射,作者发现核糖体碰撞激活了SAPK(应激激活蛋白激酶)和GCN2介导的应激反应途径。MAPKKK ZAK作为核糖体碰撞的哨兵,是SAPK(p38/JNK)和GCN2信号通路早期激活所必需的。选择性核糖体分析和生物化学表明,虽然ZAK通常与多体mRNA上的延长核糖体相关,但它特异性地在碰撞核糖体的最小单元二体上自动磷酸化。总之,这些结果为翻译稳态的扰动如何调节细胞命运提供了分子见解。
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)

本周
本月
本年
单个细胞也能提取核酸?超全干货教你微量样本发高分(含完整电子版宝典资料))
LetPub发布最新SCI影响因子查询及期刊投稿分析系统
应用gentleMACS™灌流技术从脂肪肝小鼠模型高效分离肝细胞与非实质细胞
草甘膦(glyphosate)酶联免疫分析(ELISA)试剂盒使用说明书
ELISpot试剂盒限时特惠!一口价低至500元,加赠免费读板服务
LetPub完整SCI影响因子、期刊分区查询系统
Elabscience® 从原料到标记,打造属于中国自己的流式抗体品牌
链脲佐菌素 (Streptozotocin,STZ)-糖尿病动物模型造模
淋巴细胞百分比偏低原因解析
11月Cell重磅:新线粒体细胞死亡方式!或将引爆国自然新热点!先天免疫和代谢信号通过线粒体周膜裂解诱导线粒体依赖性膜裂解
- 促销公告
- 更多 ›
你可能感兴趣的产品
- UVISEL 研究级经典型椭偏仪
- 蛋白质组的经典研究路线
- Emtricitabine是核苷逆转录酶抑制剂 (NRTI), 在PBMC细胞中的EC50 值为0.01 μM。它可用于 HIV 感染的研究。
- FyMeso人间充质干细胞无血清培养基(chemical defined)
- 冷冻研磨仪/低温冷冻研磨仪/组织研磨仪
- 美国PE耗材配件珀金埃尔默GC色谱耗材
- 外泌体提取纯化试剂盒(组织、细胞上清、血液、尿液等)
- RNA快速提取试剂盒(带DNA清除柱 )
- BVC professional 真空吸液系统(废液处理器)
- 链酶蛋白酶浓缩液(20X)
- 氘灯Waters 486 D2 lamp 2000时
- Merck默克化学试剂一级代理


