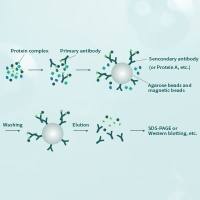
CO-IP之后的蛋白质和磁珠分离的方法相关问题
丁香实验
最近在做准备做co-IP的实验,但是有一个问题就是,平时的co-IP很多都是做完之后直接加SDS上样缓冲液煮沸,使我们的蛋白质和磁珠分离,那我如果需要用蛋白去做别的实验,需要保持它的结构和活性的话,就不能用这个方法,那么还有什么别的好方法么,如果是用标签蛋白多肽(用的标签抗体做的IP)去作为一个竞争性的溶液去把我的目的蛋白分离下来的话,那这个多肽溶液的浓度是多少比较适合?
分享
29 个回答
小布丁瑶瑶
有帮助
0.5-4微克/mg 总蛋白即可 一般抗体浓度都很高 1:200-1:500左右
dxyhsx123
有帮助
有专用的洗脱液可以洗脱分离的。另外就是建议利用克隆,表达纯化蛋白,这种量大方便实验。
JCorona
有帮助
如果要保持蛋白质的结构与活性以便进行后续实验的话,建议使用克隆的方法直接获得高纯度蛋白产物;或者使用亲和层析的方法进行纯化。
lzy必有我师
有帮助
1.样本+抗体先反应,然后加磁珠;2.抗体+磁珠先反应,然后放入样本中;3.样本+抗体+磁珠同时反应。推荐使用第一种和第二种,差别不大。不推荐用第三种,第三种方式虽然可以减少反应时间,但有实验表明同时加入三个组分的方式会使最终的结果变差。
dxy_bq4uxnd
有帮助
如果需要保持结构和活性,建议在加入SDS上样缓冲液之间吸取一部分蛋白保存,剩余蛋白再加入SDS上样缓冲液。
dxy_w4oj7yoe
有帮助
去一部分beads直接加loading煮样做wb 剩下的beads洗脱得到目的蛋白,多肽浓度参照商品说明使用,或者不放心的话可以先做个预实验试几个浓度梯度,不过体内直接拉下来的蛋白量通常都很低,生化实验建议直接用大肠杆菌或昆虫或哺乳动物细胞过表达蛋白,再进行纯化和后续相关实验
于小闹0808
有帮助
多肽浓度在200-500ug左右,另外可以在配洗脱液的时候加一个洗脱的步骤,效果会更好
内科小护士
有帮助
浓度500ug/ml差不多,标签抗体目前比较成熟,参考竞争性多肽说明书用量估计效果不会差。
医往情深丁香园
有帮助
一般不推荐CO-IP。考虑换原核、真核表达体系,直接纯化获得蛋白。 如果用这种方法,本身磁珠的结合就是依赖抗体-抗原,要考虑非特异性结合。
vae1476
有帮助
其实co-up 更多用于分析相互作用,如果为了拿到蛋白样本,可以考虑换原核、真核表达体系,直接纯化获得蛋白。
一支肾上腺素
有帮助
一般有三种反应顺序:1.样本+抗体先反应,然后加磁珠;2.抗体+磁珠先反应,然后放入样本中;3.样本+抗体+磁珠同时反应。推荐使用第一种和第二种,差别不大。不推荐用第三种,第三种方式虽然可以减少反应时间,但有实验表明同时加入三个组分的方式会使最终的结果变差。
是小杨同学
有帮助
我觉得首先要避免使用过于剧烈的手段纯化,然后避免过度搅拌,多肽浓度大概是在200-500ug左右
bamboopiggy
有帮助
如果想洗脱下来,进一步做结构和活性的话,建议用标签蛋白来做,因为洗脱要用到标签蛋白的多肽来进行,会比目的蛋白的多肽片段好获得。我用的是sigma的flag tag peptide,终浓度是500ug/ml,49ul+30ul两次来进行洗脱的。
dxy_rlratyf3
有帮助
其他方法:使用凝血酶等特定位点剪切蛋白酶将磁珠上的蛋白完整剪切下来,需要co-ip的抗体存在特定氨基酸序列而抗原蛋白没有。浓度应该约等于或略高于靶蛋白的浓度。
小白野蛮成长
有帮助
取一部分蛋白煮沸 其余负八十保存 多肽浓度可以在500左右
dxy_pni5ki46
有帮助
我之前做pulldown用的生物素化抗体,洗脱可以用生物素,用标签蛋白的话用标签多肽也是可以的,浓度一般远大于你的目的蛋白的结合量,应该至少需要能使磁柱偶联的抗体饱和,然后才能开始竞争性洗脱下目的蛋白,可以根据磁珠说明书上的蛋白结合量算算大概用量。多洗脱几次测测蛋白浓度。另外做蛋白纯化的时候洗脱抗原可以用三乙醇胺缓冲液:50mmol/L三乙醇胺,ph 11.5,0.1% Triton X100,0.15mol/L NaCl,并不破环蛋白活性
jey1235
有帮助
Co-IP一般只适用于小量蛋白的定性分析。题主想要获取蛋白就涉及到蛋白纯化,一般不推荐CO-IP。考虑换原核、真核表达体系,直接纯化获得蛋白。
如果执意用这种方法,本身磁珠的结合就是依赖抗体-抗原,要考虑非特异性结合。使用竞争肽的量一般是目标蛋白产量/磁珠结合效率的5-10倍。这里同样要考虑竞争肽的竞争效率。
如果只是普通贴壁细胞的一般水平的话,经过这么多步骤纯化,相信无法获得大量目标蛋白。
依然建议直接换用大肠杆菌/昆虫/哺乳细胞表达体系会更有效。
zxb597
有帮助
加入高浓度的甘油、加人稳定性基质, 甚至加入其他蛋白质 有利于蛋白质的长期稳定性,或者蛋白酶抑制剂。
Guoood
有帮助
直接加SDS loading 煮沸洗脱方法效率确实是最高,但同时也会使抗体分解出重轻链,也会影响下游实验的进行。我用的是酸性洗脱法,用50-60ul pH2.8的tris-gly 溶液孵育5min,洗脱后加5ul ph8.8 tris中和即可用于后续实验。至于竞争性多肽洗脱还没试过,标签抗体目前比较成熟,参考竞争性多肽说明书用量估计效果不会差,希望对你有用。
大番茄abcde
有帮助
没有,可以在做COIP的时候,就取适量,剩余的组织用于其他实验。说明上一般会有一个推荐的比例,可以从低到高补加抗体从而远一个合适的浓度
相关产品推荐
相关问答
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序