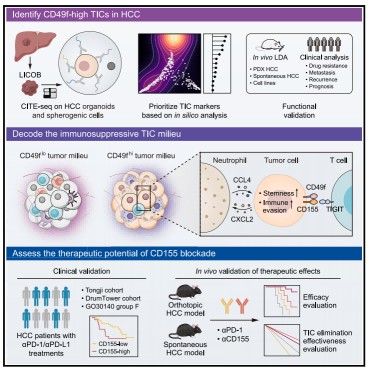
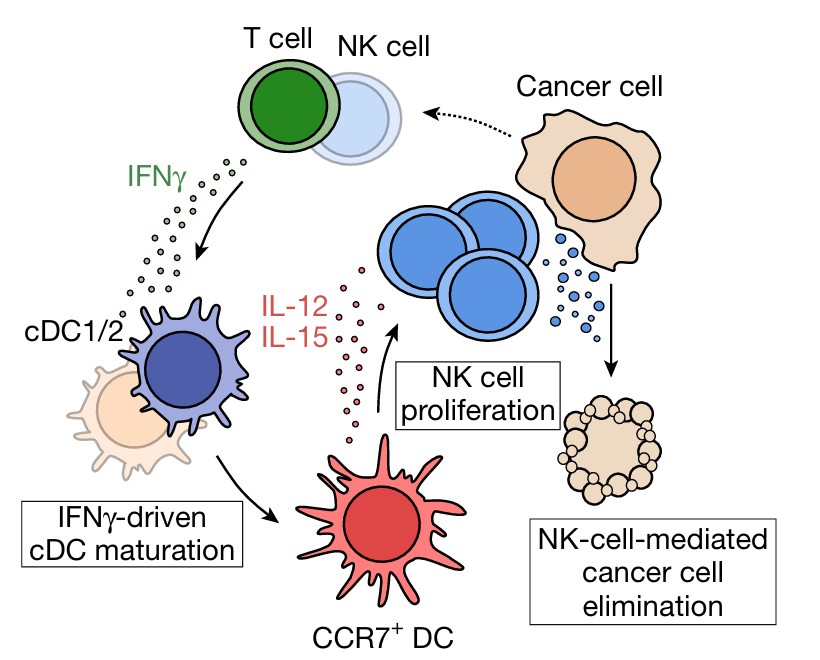
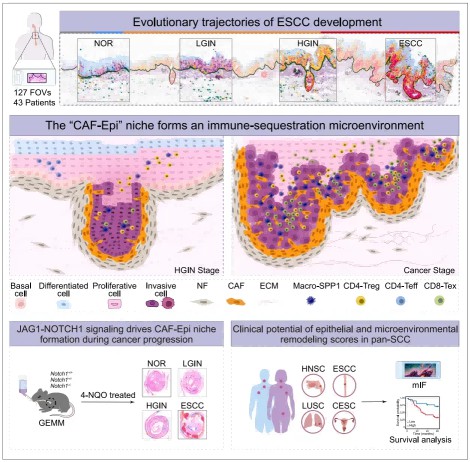
肿瘤领域研究方向之肿瘤微环境
百奥智汇
肿瘤微环境(TumorMicroenvironment,TME)作为肿瘤发生、发展及转移的核心调控单元,具有深刻的生物学意义。其构成极为复杂,涵盖肿瘤细胞、免疫细胞(如 T 细胞、B 细胞、巨噬细胞等)、基质细胞(如成纤维细胞、内皮细胞等)、神经细胞,以及细胞外基质(ECM)和各类信号分子(包括细胞因子、趋化因子、生长因子等)。TME 不仅为肿瘤细胞提供物理支架,更通过精密的细胞间通讯(如配体-受体介导的信号传递)及复杂的信号网络,全方位调控肿瘤的生物学行为。例如,免疫细胞可被肿瘤细胞募集并发生表型极化,进而抑制抗肿瘤免疫应答;基质细胞则能通过分泌功能性因子或重塑 ECM 的理化特性,推动肿瘤的侵袭与转移进程。此外,TME 的空间拓扑结构(如三级淋巴结构的存在形式与定位)也对肿瘤免疫应答效率及患者预后具有显著影响。
因此,系统解析肿瘤微环境的组成特征、功能分工及其与肿瘤细胞的动态互作机制,对于开发新型免疫治疗、靶向治疗策略以及精准预测治疗响应,均具有不可或缺的理论与临床价值。接下来,我们将通过具体案例,阐述如何利用单细胞与空间组学技术解析肿瘤微环境的相关生物学问题。
案例一:
单细胞技术联合空间转录组揭示胶质瘤微环境中髓系细胞的免疫调节程序

发表期刊:Nature
影响因子:48.5
发表时间:2025 年 2 月
研究疾病:胶质瘤
样本类型:肿瘤组织、外周血
样本数量:85 例肿瘤组织样本、17 例外周血样本;23 张组织切片
样本分组:原发胶质瘤 vs 复发性胶质瘤;线粒体突变型 vs 野生型;肿瘤组织 vs 外周血
应用技术:Seq-Well 单细胞测序技术、单细胞 RNA 测序(scRNA-seq)、空间转录组学(Spatial transcriptomics)、单核染色质可及性测序(snATAC-seq)
研究背景
在胶质瘤等实体肿瘤中,髓系细胞是构建免疫抑制性微环境的关键参与者,且与患者预后不良密切相关。肿瘤相关髓系细胞可通过调控恶性细胞的分子状态、影响肿瘤浸润性 T 细胞功能,以及招募和抑制其他髓系细胞等方式参与肿瘤进展。然而,目前对调控这些功能的特定细胞类型及表达程序的认知仍存在局限:其一,髓系细胞状态及表达程序的定义缺乏共识;其二,人类胶质瘤中髓系细胞的起源尚未明确;其三,髓系细胞与其他恶性及非恶性细胞间的互作如何塑造肿瘤生态位及免疫微环境的机制仍待解析。本研究通过全面解析人类胶质瘤中髓系细胞的特征,旨在克服上述研究局限性。
研究路线
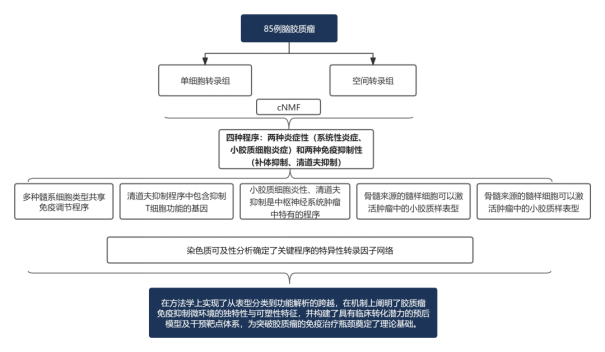
研究结论
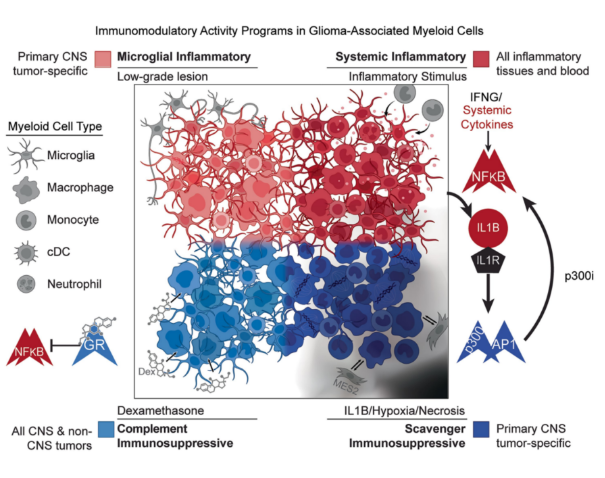
图 1.85 例人类胶质瘤样本的髓系细胞转录组图
本研究通过scRNA-seq分析 85 例人类胶质瘤样本的髓系细胞转录组,并结合共识非负矩阵分解(cNMF)算法解析基因表达程序,同时整合线粒体 DNA 谱系追踪、空间转录组及类器官共培养实验探究细胞起源与微环境互作机制。结果显示,胶质瘤髓系细胞主要表达四类免疫调节程序,两种炎症性程序:系统性炎症程序、小胶质细胞炎症程序;两种免疫抑制性程序:补体抑制程序、清道夫抑制程序。
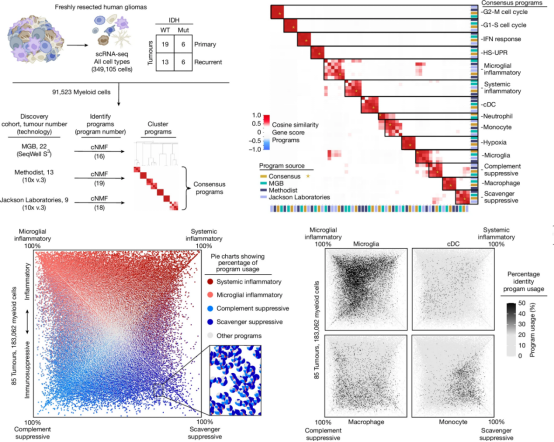
图 2. 使用 cNMF 解析基因表达程序并量化比较不同类型的免疫调节程序在细胞中的相对表达差异图
有趣的是,这些程序与细胞类型或发育起源无关(如外周血单核细胞可转化为小胶质细胞样表型),而主要由微环境因子驱动,包括缺氧、IL-1β、TGF-β及地塞米松等。。跨肿瘤类型分析显示,系统性炎症与补体抑制程序在非中枢神经系统肿瘤中亦存在,而小胶质细胞炎症和清道夫抑制程序为原发性脑肿瘤特有,且后者在非肿瘤脑组织中缺失。四种程序的相对表达丰度与免疫治疗响应及患者生存显著相关:系统性炎症程序高表达的髓系细胞可能通过 IL-1β信号促进免疫激活,而清道夫抑制程序则通过 VSIG4、CD163 等基因介导 T 细胞功能抑制。
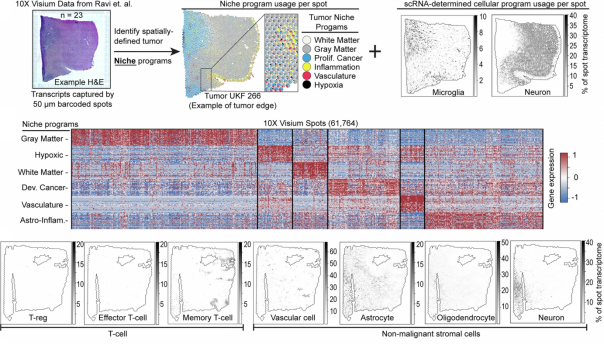
图 3. 空间组学解析髓系细胞和神经胶质瘤生态位的空间关联
调控网络解析显示:补体抑制程序富集 C1Q 家族基因及 VSIG4,且与小胶质细胞身份基因共表达;清道夫抑制程序则与 LYVE1、MRC1(CD206)等吞噬受体相关。类器官模型验证证实,外周血单核细胞可被肿瘤微环境重编程为具有免疫抑制特征的髓系细胞,体现其高度表型可塑性。
研究意义
本研究突破了传统以细胞起源或类型为分类标准的认知框架,揭示了胶质瘤髓系细胞的泛肿瘤免疫调节模式,证实其免疫调节程序主要受微环境信号调控。该发现为开发靶向髓系细胞表型的精准治疗策略(如调控缺氧通路或抑制 IL-1β信号)提供了重要理论依据,同时为理解肿瘤微环境中髓系细胞的功能多样性及可塑性开辟了新视角。
案例二:空间多组学研究揭示肿瘤相关成纤维的保守空间亚型和细胞邻域特征

发表期刊:Cancer cell
影响因子:45.8
发表时间:2025 年 5 月
研究疾病:泛癌
样本类型:癌组织
样本数量:8 例(CosMx)、16 例(MERSCOPE)、6 例(Visium)、5 例(Xenium)、7 例(COMET)、70 例(CODEX)、2070 例(IMC)
样本分组:以癌种分组
应用技术:COSMx 、MERSCOPE、Xenium、Visium、COMET、CODEX、IMC
研究背景:
癌症相关成纤维细胞(CAFs)是一类多功能的细胞群体,对塑造肿瘤微环境(TME)和影响治疗反应至关重要。尽管 CAFs 长期以来被视为有前景的治疗靶点,但针对它们的治疗尝试面临重大挑战,某些干预措施甚至意外加速了癌症进展。单细胞 RNA 测序(scRNA-seq)对 CAFs 研究越来越深入,但仍缺乏其空间背景信息,而这对于揭示塑造 CAFs 表型和功能的空间组织与互作机制至关重要。该研究旨在利用多种空间组学技术解决这一问题。
研究路线:
研究结论:
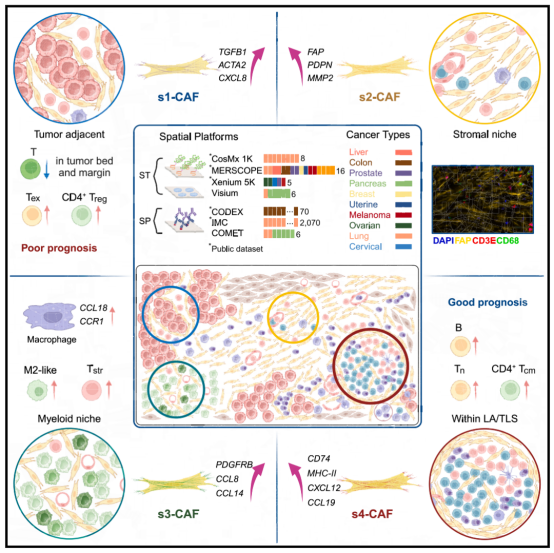
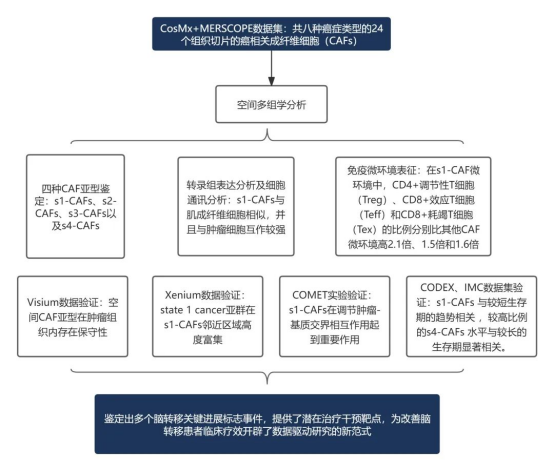
图 4. 利用 CosMx 和 MERSCOPE 技术对八种癌症类型的 24 个组织切片的癌相关成纤维细胞(CAFs)的全面空间转录组分析图
本研究发现队列采用 CosMx 和 MERSCOPE 技术对非小细胞肺癌(NSCLC)、乳腺癌、结肠癌、前列腺癌、子宫癌、卵巢癌、肝癌和黑色素瘤共八种癌症类型的 24 个组织切片的癌相关成纤维细胞(CAFs)进行了全面空间转录组分析,通过对中 570 余万个细胞的解析,鉴定出四种具有独特空间组织模式、邻近细胞组成及互作特征的空间 CAF 亚型即 s1-CAFs、s2-CAFs、s3-CAFs 以及 s4-CAFs。
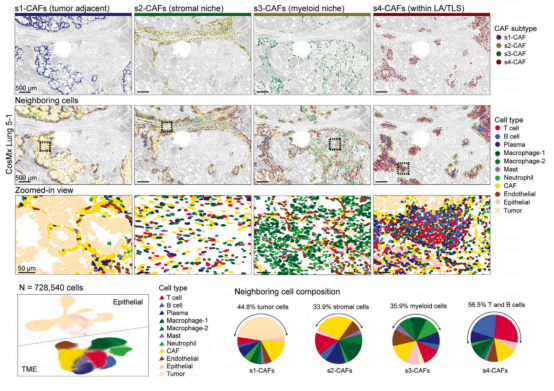
图 5. 使用 Cosmx 解析肿瘤微环境中不同 CAFs 亚型空间组织模式及及其邻域组成图
进一步检测 CosMx 数据集中不同癌症相关成纤维细胞(CAF)微环境内主要免疫细胞类型的状态与组成,包括 T 细胞、巨噬细胞、B 细胞和浆细胞,充分证明了 s1-s4 CAFs 的空间异质性。整合 MERSCOPE 数据集的进一步分析表明,CAFs 亚群具有跨癌种的保守性,对四种亚型进行量化发现,s2-CAFs 是最常见的亚型,存在于所有组织切片中;其次依次是 s4-CAFs、s1-CAFs、s3-CAFs。s3-CAF 主要见于肺癌、肝癌和结肠癌样本,其余亚型在八种癌症类型中均有分布。随后利用肺腺癌(LUAD)和胰腺导管腺癌(PDAC)样本的 Visium 空间转录组数据集揭示了肿瘤组织内保守存在的空间 CAF 亚型。
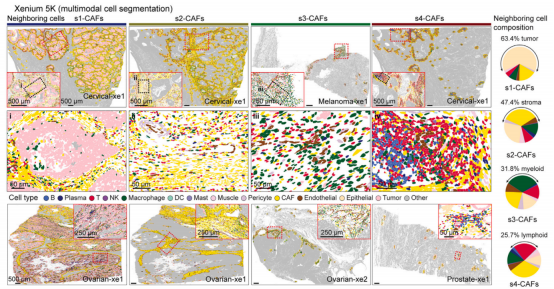
图 6. 使用 Xenium 解析肿瘤微环境中不同 CAFs 亚型的空间组织模式及邻域组成图
为探索 CAFs 亚型是如何影响 TME 的,研究者把每张切片分为肿瘤床、肿瘤边缘、肿瘤远端三个区域,分析每个区域内 CAFs 亚型及 T 细胞比例并分析其相关性。然后,利用卵巢癌、宫颈癌、前列腺癌和黑色素瘤的 5 张切片的 Xenium 5K 数据集验证 CAFs 亚型的空间组织模式、邻域细胞组成,发现 state 1 cancer 亚群高表达免疫逃逸相关基因,如 CD47、CD44、CCL28 和 NT5E[CD73] 并且在 s1-CAFs 邻近区域高度富集,揭示了 s1-CAFs 和肿瘤细胞之间的复杂通讯可能有助于肿瘤免疫逃逸。
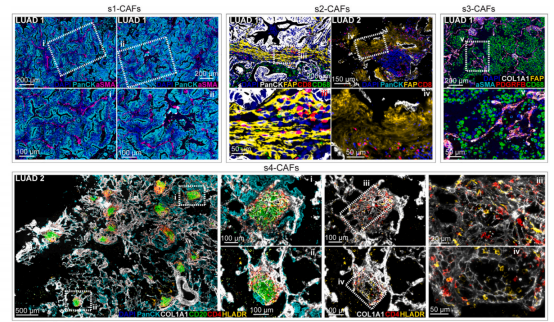
图 7. 使用 COMET 实验解析癌症微环境中的 CAFs 图
此外,研究者还采用 COMET 实验证明了癌症相关成纤维细胞空间组织异质性,并利用 35 例结肠癌患者的 70 张 TMA 的 CODEX 数据集和包含 1,070 名非小细胞肺癌 (NSCLC) 患者的成像质谱流式 (IMC) 数据集探究了 CAF 亚型的临床相关性,发现 s1-CAFs 与较短生存期的趋势相关 ,较高比例的 s4-CAFs 水平与较长的生存期显著相关。
研究意义
本研究运用 CosMx 和 MERSCOPE 平台对八种癌症类型中的癌症相关成纤维细胞(CAFs)进行了全面的空间转录组分析,并采用自有(Visium 和 COMET)与公共数据集(Xenium、CODEX 和 IMC)在独立空间组学平台进行验证,证实这些亚型在不同癌症类型和平台间具有保守性,并与特定肿瘤微环境特征及临床相关性存在关联。这项针对 CAFs 的大规模单细胞空间多组学表征研究,为理解其空间异质性以及在肿瘤进展和免疫调节中的作用提供了新见解。




![4-(N,N-二甲基氨基)偶氮苯-4'-磺酰氯[多肽研究用氮保护剂];56512-49-3;80%;S35715-50mg](https://img1.dxycdn.com/p/s14/2025/1029/004/8672158669127143891.jpg!wh200)