肿瘤领域研究方向之肿瘤发生、发展和进化
百奥智汇
肿瘤的发生、发展与进化是一个多因素参与、动态演变的复杂过程。其起源通常始于正常细胞内基因突变与表观遗传修饰的累积,这些分子层面的改变逐步打破细胞生长调控平衡,最终引发细胞恶性转化与增殖失控。在此过程中,肿瘤细胞通过持续适应微环境压力——如缺氧、营养匮乏及免疫监视等——逐步获得侵袭、迁移及免疫逃逸等恶性表型特征。
随着疾病进展,肿瘤内部的细胞异质性不断加剧:不同克隆在进化谱系中分化出不同分支,呈现出基因型与表型的多样化特征。这种异质性赋予肿瘤在治疗压力下的适应性优势,既可通过选择性扩增耐药克隆,也可通过产生新的适应性突变来逃避治疗干预。与此同时,肿瘤细胞与微环境中的免疫细胞、基质细胞等通过复杂的信号交互进一步重塑生态位,持续推动肿瘤的进化进程。因此,深入解析肿瘤发生、发展与进化的分子机制,对于开发高特异性早期诊断标志物、精准预测疾病进展轨迹及制定个体化治疗策略具有至关重要的理论与临床价值。
接下来,我们将通过典型案例,阐述如何利用单细胞与空间组学技术解析肿瘤的发生、发展与进化过程。
案例一:空间原位分析构建食管癌单细胞多阶段空间动态演化图谱

发表期刊:Cancer Cell
影响因子:44.5
发表时间:2025 年 3 月
研究疾病:食管鳞状细胞癌(ESCC)
样本类型:食管鳞状细胞癌(Esophageal Squamous Cell Carcinoma, ESCC)
样本数量:43 名患者的 127 个食管癌变多阶段组织样本
样本分组:
人类样本:正常食管上皮(NOR)、低级别上皮内瘤变(LGIN)、高级别上皮内瘤变(HGIN)、食管鳞状细胞癌(ESCC)
小鼠模型:对照组(Notch1+/+小鼠)和实验组(Notch1+/-和 Notch1−/−小鼠)
应用技术:Xenium 原位测序(Xenium In Situ)、转录因子单分子荧光原位杂交(TF-seqFISH)、单细胞 RNA 测序(scRNA-seq)、染色质免疫沉淀-定量 PCR(ChIP-qPCR)、蛋白质印迹(Westernblot)
研究背景
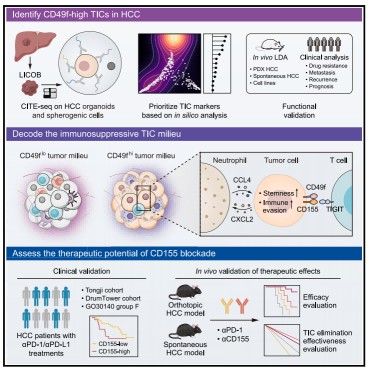
食管癌是原发于食管鳞状上皮和柱状上皮的恶性肿瘤,主要分为食管鳞状细胞癌(ESCC)和食管腺癌(EAC)两大类型。其中,ESCC 在全球范围内致死率居高不下,尤其在东亚地区呈现高发病率特征。ESCC 的发生发展是一个多阶段、多因素协同参与的复杂过程,涉及上皮细胞恶性转化与肿瘤微环境(TME)重塑的共演化,而这一共演化过程对癌症的发生、进展及转移具有关键调控作用。尽管近年来基因组学及单细胞转录组学研究已揭示了 ESCC 中癌细胞突变及细胞异质性的作用,但受限于技术分辨率,单细胞水平的空间互作分析仍存在不足,对肿瘤微环境时空演化的解析尚未充分。本研究通过高分辨率 XeniumInSitu、TF-seqFISH 等空间转录组学技术,绘制 ESCC 发展的单细胞分辨率多阶段空间演化图谱,旨在解析癌相关成纤维细胞-上皮细胞(CAF-Epi)生态位的形成机制。
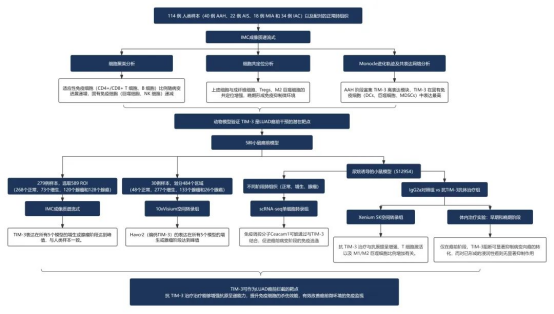
研究路线
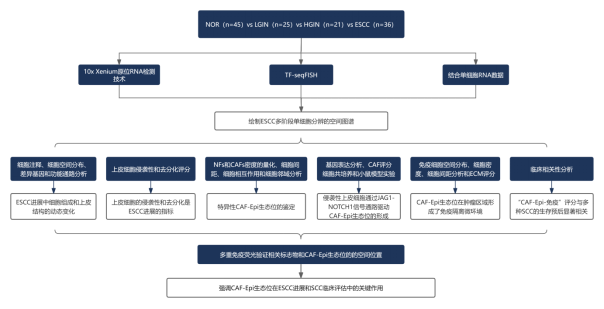
研究结论
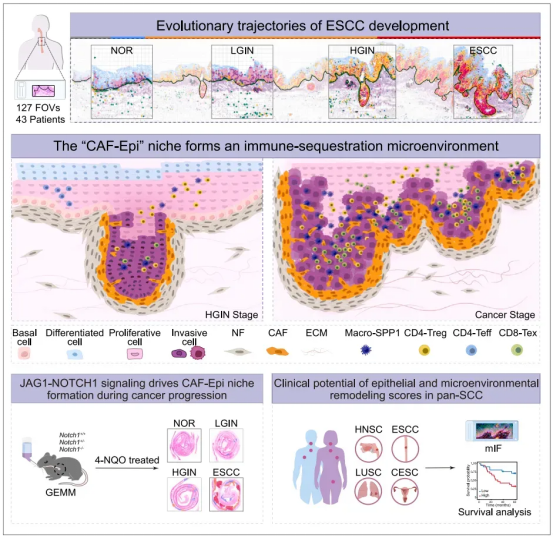
图 1. 单细胞空间转录组技术和单细胞转录组测序结果图
利用 Xenium In Situ、TF-seqFISH 等单细胞空间转录组技术和单细胞转录组测序(scRNA-seq),研究者鉴定出 4 个主要的上皮细胞亚群(基底细胞、增殖细胞、分化细胞、侵袭细胞),其比例随疾病进展呈动态变化。ESCC 的演进过程是由增殖性上皮细胞亚群驱动,该亚群通过获得去分化及侵袭性特征推动肿瘤进展:正常阶段(NOR):基底细胞与增殖细胞定位于上皮-基质界面附近;癌前病变阶段(LGIN→HGIN):增殖细胞显著扩张并逐渐挤压分化细胞的空间,至 HGIN 阶段出现侵袭性亚群,可突破上皮-间质界面形成局部浸润前沿;ESCC 阶段:侵袭性细胞主导肿瘤边缘,完全破坏基底-间质界面并侵入间质区域,而分化细胞被限制于肿瘤核心。
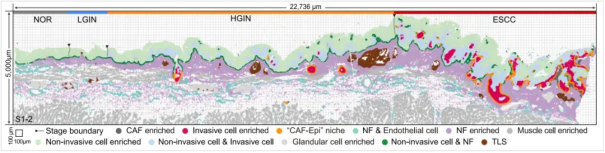
图 2.空间转录组解析横跨 NOR、LGIN、HGIN 和 ESCC 四个阶段的肿瘤发展过程图
进一步研究发现,HGIN 阶段出现的侵袭性上皮细胞可激活正常成纤维细胞(NFs)向肿瘤相关成纤维细胞(CAFs)转化,并且与 CAFs 在肿瘤边缘构成特定的 CAF-Epi 生态位。该生态位的功能包括:直接驱动肿瘤细胞的增殖与侵袭;通过重塑细胞外基质(ECM)构建物理屏障,阻碍免疫细胞浸润;主动募集并极化 SPP1+巨噬细胞及 CD4+调节性 T 细胞,形成免疫抑制网络,削弱免疫系统对肿瘤的监控与攻击能力。体外共培养及小鼠基因敲除模型验证显示,侵袭性上皮细胞通过 JAG1-NOTCH1 信号通路上调 CXCL1/CXCL8 的表达,进而诱导邻近 NFs 转化为 CAFs 并形成 CAF-Epi 生态位,而敲除 CXCL1/CXCL8 可阻断这一效应。
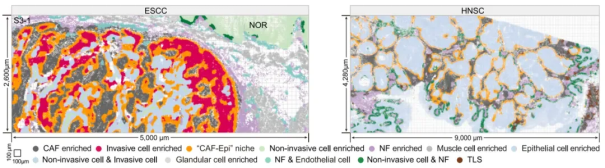
图 3.利用 Xenium 原位数据解析 ESCC 和 HNSC 中 CAF-Epi 生态位的空间分布图
基于 CAF-Epi 生态位形成相关基因的表达特征,研究者开发了「CAF-Epi-Immune 评分」系统。该系统整合了上皮细胞的侵袭性、去分化程度及肿瘤微环境中免疫细胞与基质细胞的特征,可更全面地评估 ESCC 进展并精准预测患者预后,且在多个独立患者队列及其他鳞状细胞癌(SCC)患者中均验证了其良好的预后预测效能。
研究意义
本研究首次系统绘制了食管鳞癌(ESCC)从癌前病变到浸润性癌的单细胞分辨率空间动态演化图谱,揭示了侵袭性上皮细胞通过 JAG1-NOTCH1-CXCL1/8 信号轴驱动 CAFs 招募与免疫抑制微环境形成的核心机制,填补了肿瘤空间生物学在食管癌领域的理论空白。本研究还阐明了 CAF-Epi 生态位促进免疫逃逸的跨尺度调控网络,并验证了该机制在泛鳞状细胞癌中的保守性,为理解肿瘤微环境的空间协同演化提供了范式。同时,该研究开发的「CAF-Epi-Immune 评分」突破了传统病理分期的局限性,为 ESCC 的早期诊断、病情监测和治疗策略制定提供了新型生物标志物与治疗靶点,对推动癌症精准医疗的发展具有重要意义。
案例二:人类和小鼠肺腺癌前体的空间多组学分析揭示 TIM-3 可作为癌前干预的潜在靶点

发表期刊:Cancer Cell
影响因子:44.5
发表时间:2025 年 5 月
研究疾病:肺腺癌
样本类型:人类样本(LUAD 及癌前病变样本、正常组织);小鼠样本(LUAD 及癌前病变样本、正常组织)
样本数量与分组:
IMC:114 例手术切除样本(40 例 AAH、22 例 AIS、18 例 MIA、34 例 IAC),5 种小鼠模型的 279 例样本
10x Visium:30 个切片,来源于 5 种小鼠模型的 30 例样本
scRNA-seq:Urethane 诱导模型的 LUAD 前体组织(增生、腺瘤阶段)/对照,13 例
10x Xenium:Urethane 模型中 anti-TIM-3 或 IgG 处理的肺组织,每组 6 例,共 12 例
应用技术:成像质谱流式细胞术(IMC)、scRNA-seq、10xVisium、Xenium(5k Panel)、IHC
研究背景
肺癌是全球癌症死亡的主要原因,而早期诊断和干预是提高生存率的关键。肺腺癌(LUAD)是肺癌的主要亚型,在 LUAD 前体中,不典型腺瘤样增生(AAH)是 LUAD 的唯一已知癌前病变,有可能进展为原位腺癌(AIS)、微浸润腺癌(MIA),最终发展为浸润性 LUAD(IAC)。但由于早期 LUAD 前体样本稀缺,对其早期发生机制的研究面临挑战。既往研究表明,从 AAH 进展到 AIS、MIA 和浸润性 LUAD 时基因组和甲基化复杂性的逐步增加。此外,免疫系统在肿瘤进展过程中也扮演着重要角色。然而,我们对于肿瘤微环境(TME)如何影响 LUAD 前体的演变,以及 TME 中细胞间的相互作用和空间分布仍然知之甚少。因此,本研究旨在利用空间多组学技术,深入剖析人源和鼠源 LUAD 前体样本,解析 TME 的空间结构、细胞组成和功能动态,并寻找潜在的早期干预靶点。
研究路线
研究结论
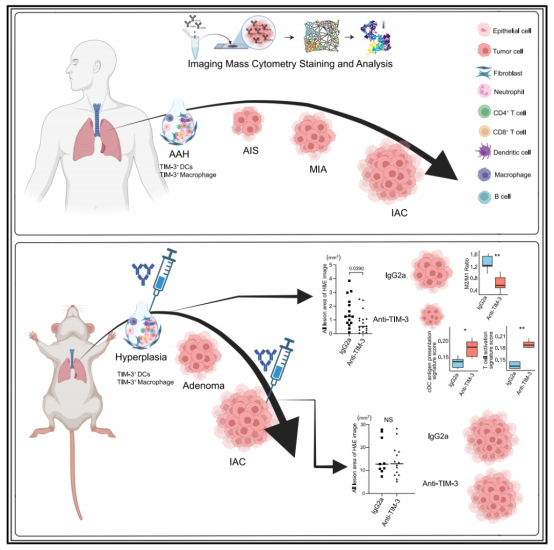
图 4. 成像质谱细胞术技术绘制的空间免疫微环境图
研究团队收集了 114 例人类 LUAD 及其前体样本,利用成像质谱细胞术(IMC)技术,绘制了高分辨率的空间免疫微环境图谱。研究发现,肺腺癌从癌前病变向浸润性癌转变过程中,伴随着巨噬细胞的极化以及 T 细胞功能的动态变化。具体表现为:固有免疫细胞在早期占主导地位,而随病程进展,适应性免疫细胞逐渐占据优势。为了更深入理解这一过程,研究团队提取了包括细胞组成、细胞状态、相互作用与形态在内的 818 个空间特征,并通过 Monocle 进化轨迹及共表达网络分析发现,癌前阶段的关键调控模块中富集大量与免疫检查点 TIM-3 相关的特征。进一步分析显示,与其他阶段相比,TIM-3 在癌前期的髓系细胞(如树突状细胞与巨噬细胞)中显著高表达。
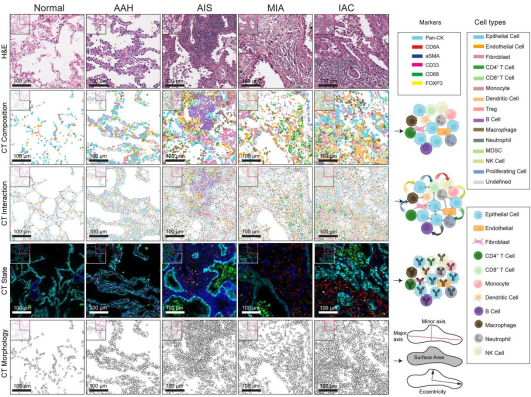
图 5. 空间组学解析 LUAD 肿瘤微环境的空间构成图
为了验证这些发现的保守性,研究者构建了 5 种小鼠癌前模型,包括致癌物诱导模型及携带不同驱动突变的基因工程模型。IMC 和空间转录组技术的分析验证,结果与人类样本高度一致:TIM-3 在癌前阶段的髓系细胞中表达显著上调,并在 mRNA 层面(Havcr2 基因)得到进一步证实。单细胞转录组分析还提示,免疫调控分子 Ceacam1 可能通过与 TIM-3 结合,促进癌前病变阶段的免疫逃逸。
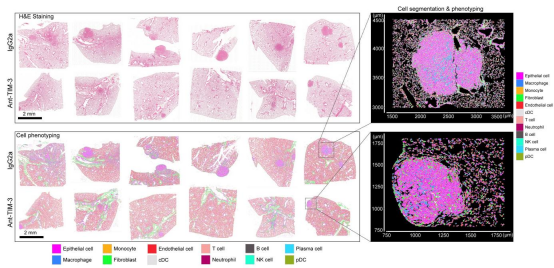
图 6. 利用 Xenium 原位数据解析抗 TIM-3 或 IgG2a 对照处理后的小鼠肺样本图
为验证阻断 TIM-3 是否具有「癌前拦截」潜力,研究团队基于小鼠模型进行了体内治疗实验。结果发现,仅在癌前阶段,TIM-3 阻断可显著抑制病变向癌的转化,而对已形成的浸润性癌则无显著抑制作用。 此外,Xenium 5k 空间分析显示,抗 TIM-3 治疗显著减少了促肿瘤 M2 型巨噬细胞的比例,并改善了 M2/M1 比值,提示其通过重塑髓系免疫环境发挥作用。同时,该治疗也增强了抗原呈递与免疫细胞杀伤功能,为靶向癌前免疫抑制提供了依据。
研究意义
该研究通过空间免疫分析和多组学技术,揭示了肺腺癌从癌前病变到浸润性癌过程中固有免疫向适应性免疫转变的动态免疫应答机制,发现 TIM-3 在癌前阶段高表达且其阻断可抑制癌前病变进展、增强抗肿瘤免疫,为肺腺癌的早期干预和免疫治疗提供了新靶点及理论依据,对实现肺癌的精准预防与治疗具有重要意义。