肿瘤领域研究方向之肿瘤细胞的异质性
百奥智汇
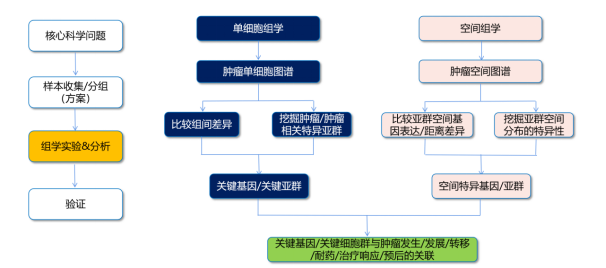
单细胞空间组常用研究框架 & 数据分析思路总结
肿瘤领域研究方向之肿瘤细胞的异质性
肿瘤细胞的异质性与状态转换作为肿瘤生物学的核心特征,承载着极为关键的生物学意义。肿瘤并非单一克隆细胞的简单堆砌,其内部存在着显著的遗传变异与表观遗传重塑,而这些变化又进一步驱动了细胞状态及功能的多样化。正是这种异质性,赋予了肿瘤细胞在进化进程中适应各类微环境压力的能力,像免疫攻击、缺氧以及营养匮乏等困境,都能被其巧妙应对。同时,肿瘤细胞具备高度的可塑性,能够实现状态转换——比如从增殖状态切换至侵袭状态,或是从分化状态逆转为干性状态。这种可塑性不仅会加速肿瘤的生长、侵袭与转移,更是治疗抵抗现象发生的重要诱因。以肿瘤干细胞为例,它们在治疗压力下可进入休眠状态,以此逃避治疗作用,最终为肿瘤复发埋下隐患。
由此可见,深入解析肿瘤细胞的异质性与状态转换,对于揭示肿瘤的发生发展机制、开发更为有效的治疗策略而言,具有不可替代的重要意义。接下来,我们将通过具体案例,为大家阐述单细胞与空间组学技术在肿瘤细胞异质性研究中是如何被巧妙应用的。
案例一: 组织病理学和单细胞组学揭示透明细胞肾细胞癌的侵袭性特征

发表期刊:Cancer Cell
影响因子:44.5
发表时间:2023 年 1 月
研究疾病:透明细胞肾细胞癌(Clear Cell Renal Cell Carcinoma,ccRCC)
样本类型:以具有 4 种病理特征的 ccRCC 肿瘤组织为主要研究材料
样本数量:4 例患者的 12 个肿瘤样本(用于单细胞分析)
样本分组:C3N-00148(4 个样本),C3L-01287(2 个样本),C3L-00606(3 个样本),C3L-00149(3 个样本)
应用技术:单核 RNA 测序(snRNA-seq)、免疫组织化学(IHC)、全外显子测序(WES)、bulk RNA 测序、蛋白质组学、代谢组学等多组学技术
研究背景
透明细胞肾细胞癌(ccRCC)占肾细胞癌总数的 75%,且是导致肾癌相关死亡的主要亚型。肿瘤内和肿瘤间异质性(Intratumor Heterogeneity,ITH)是导致患者预后差异及治疗响应异质性的关键原因,但其分子机制及临床意义尚未完全阐明。本研究通过整合组织病理学、蛋白质基因组学和代谢组学分析,系统解析 ccRCC 侵袭性表型的关键特征,为精准诊疗策略的开发提供理论依据。
研究路线
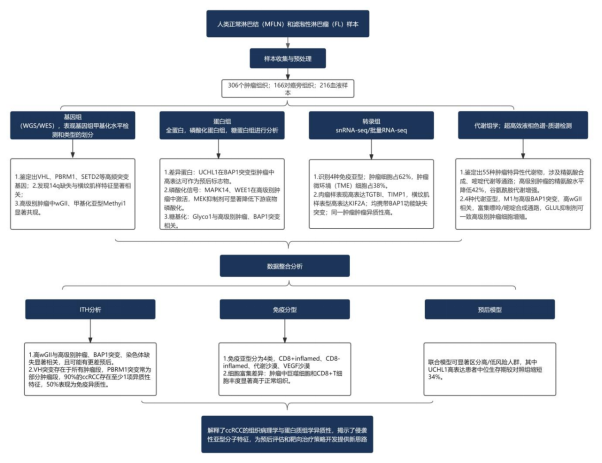
研究结论
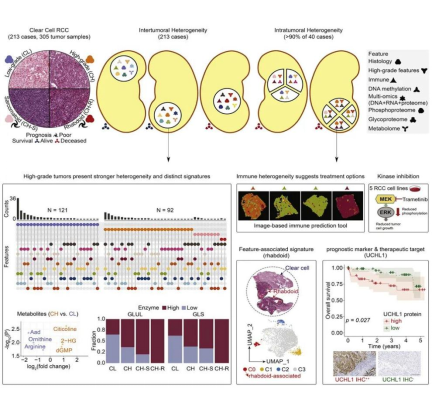
图 1. 213 例 ccRCC 样本病理学亚型以及检测图
研究将 213 例 ccRCC 样本分为四种组织病理学亚型:低等级(CL,121 例)、高等级(CH,92 例)、伴肉瘤样特征(CH-S,14 例)及伴横纹肌样特征(CH-R,3 例),分析证实,90% 的 ccRCC 存在肿瘤内异质性(ITH),其中 50% 伴随免疫特征异质性。
进一步识别出 7 种高级别病理特征(如肉瘤样、横纹肌样特征等),并将其量化为「高级别特征计数(HGFC)」,发现 HGFC≥3 与患者不良预后显著相关;同时,高等级肿瘤的肿瘤间异质性水平显著高于低等级肿瘤。
对 40 例患者的 132 个肿瘤组织片段进行蛋白基因组综合分析,明确高肿瘤等级(G3/G4)、BAP1 突变、高基因组不稳定性(WGII>0.4)、DNA 高甲基化(Methyl1 亚型)及特定蛋白糖基化特征(如岩藻糖型糖蛋白富集)共同构成 ccRCC 高风险亚型的分子标志物。
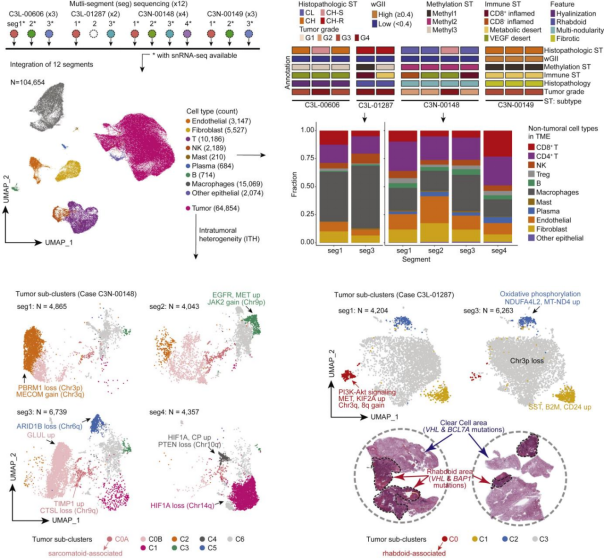
图 2. 单细胞水平的肿瘤内异质性转录组特征
通过 snRNA-seq 对 4 例患者的 12 个肿瘤组织(涵盖横纹肌样、肉瘤样、多结节性及透明质化组织)进行分析,发现肉瘤样区域特异性高表达 TIMP1、C1R 和 TGFBI 等基因,横纹肌样区域则高表达 KIF2A、NAMPT 和 GALNT2。研究还发现,DNA 高甲基化的 Methyl1 亚型与 BAP1 突变及不良预后显著相关,其中 UCHL1 高表达为关键预后标志物,其表达水平与 BAP1 突变、高 WGII 及特定 DNA 甲基化亚型相关,且UCHL1高表达患者预后显著较差。
此外,磷酸化信号通路分析显示,MAPK14-MAPKAPK2 及 EGFR-MEK-ERK 通路在不同磷酸化亚型中存在特异性激活,体外实验证实 MEK 及 WEE1 抑制剂对 ccRCC 具有显著抗肿瘤活性。鉴定出 ccRCC 特异性糖蛋白修饰模式,HYOU1 等高表达糖蛋白与高级别肿瘤及不良预后密切相关。代谢组学分析揭示 ccRCC 中存在精氨酸及谷氨酰胺代谢的显著重编程特征。
研究意义
本研究通过对 213 例 ccRCC 患者样本的多组学整合分析,系统揭示了肿瘤内异质性的分子基础,明确了高风险亚型的特征及 UCHL1 的预后价值,鉴定出侵袭性表型相关的基因特征及可靶向的磷酸化信号通路。研究结果为 ccRCC 的分子分层、精准治疗策略开发及预后评估提供了关键实验依据,同时为后续机制研究奠定了重要基础。
案例二: 单细胞结合空间组学解析宫颈鳞状细胞癌肿瘤异质性

发表期刊:Nature Genetics
影响因子:31.7
发表时间:2023 年 11 月
研究疾病:宫颈鳞状细胞癌(CSCC)
样本类型:肿瘤组织和正常对照组织
样本数量:scRNA-seq:14 例未经治疗的 CSCC 样本和 3 例健康宫颈对照样本;空间转录组数据(结合作者已发表的研究):15 例 CSCC 样本;空间蛋白组:60 个 ROI
样本分组:CSCC vs 健康宫颈
应用技术:scRNA-seq、bulk RNA-seq、空间蛋白组(基于激光显微切割)、全外显子测序、结合作者已发表的空间转录组(stereo-seq)数据等。
研究背景
宫颈鳞状细胞癌(CSCC)是女性癌症死亡的第四大原因,2020 年全球约有 34.2 万人死于该病。CSCC 是宫颈癌中最常见的组织学类型,虽然局限性疾病的预后较好,但晚期、转移性或复发性 CSCC 的 5 年生存率仅为 16.5%。近年来,免疫检查点阻断疗法(ICB)彻底改变了临床肿瘤学的治疗范式,但在晚期宫颈癌中,抗 PD-L1 治疗的总体反应率仅为 17%,且大多数反应是短暂的。研究表明,肿瘤免疫微环境(TIME)的异质性是影响免疫治疗反应的关键因素之一。TIME 的异质性不仅体现在细胞组成上,还体现在细胞状态和功能上。本研究旨在通过多组学分析方法,探究 CSCC 肿瘤内的异质性,并揭示不同肿瘤状态与免疫微环境之间的关系。
研究路线
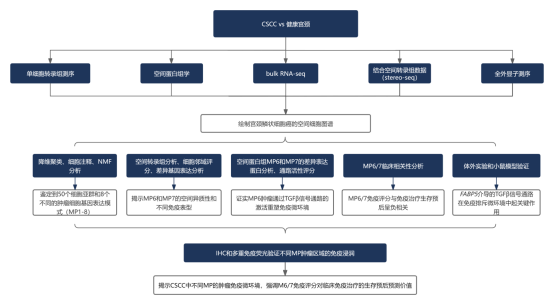
研究结论
图 3. CSCC 单细胞图谱进行非负矩阵分解(NMF)分析图
本研究通过单细胞 RNA 测序、空间转录组学和空间蛋白质组学等多组学技术,对宫颈鳞状细胞癌(CSCC)的肿瘤内异质性及其与肿瘤免疫微环境(TIME)的相互作用进行了系统分析。研究者从 14 个未经治疗的肿瘤和 3 个正常宫颈样本中获取了 163,880 个细胞,构建了包含 50 个细胞亚群的 CSCC 单细胞图谱。通过非负矩阵分解(NMF)分析,识别出 8 个反映肿瘤内异质性的基因表达模式(MPs),其中 MP6、MP7 和 MP8 与恶性上皮细胞鳞状分化的不同阶段相关,并表现出不同的肿瘤免疫微环境。
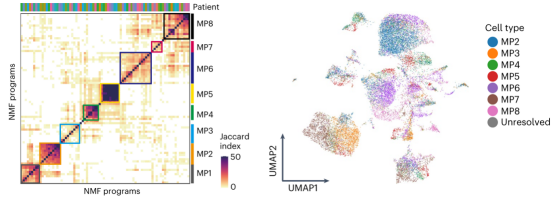
图 4. 使用单细胞数据解析肿瘤细胞的不同基因表达模式图
空间分析显示,MP6 状态的肿瘤细胞与免疫抑制性癌症相关成纤维细胞(CAF)通过 TGFβ信号通路相互作用,形成免疫排斥微环境。相反,MP7 状态的肿瘤细胞高表达免疫相关分子(如 HLA-DRB1、B2M),与免疫细胞浸润(如 CD8+T 细胞)显著相关,并通过干扰素信号通路与自然杀伤细胞和 T 细胞相互作用,表现出免疫浸润特征。通过进一步的体外实验和小鼠模型实验,研究发现 FABP5 对 MP6 状态的维持至关重要,它通过激活 TGFβ信号通路驱动免疫排斥现象。
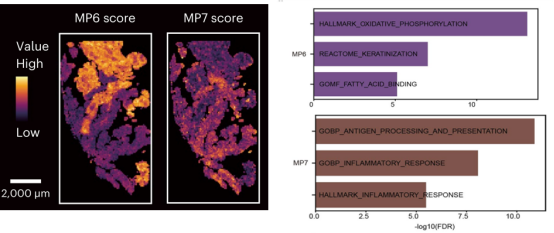
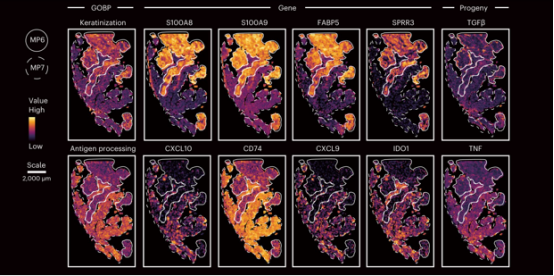
图 5. 使用空间组学数据解析两种肿瘤细胞状态(MP)的空间分布以及两种 MP 特异的空间区域的基因表达和通路活性图
研究还发现,新辅助化疗可诱导肿瘤状态从 MP6 向 MP7 转变,这种转变与免疫检查点阻断治疗后的病理完全缓解(pCR)相关。此外,研究者开发了 MP6/7 评分,用于预测鳞状细胞癌(如 CSCC 和非小细胞肺癌)对免疫治疗的响应,该评分与免疫细胞浸润呈负相关,并可作为预测免疫治疗反应的潜在指标。
研究意义
本研究不仅揭示了宫颈鳞状细胞癌(CSCC)的肿瘤内异质性和免疫微环境的复杂性,还识别了与不同肿瘤状态相关的细胞亚群,并揭示了这些状态与免疫细胞浸润之间的关系。这些发现为理解 CSCC 的生物学特性提供了新的视角,并为开发新的治疗策略和生物标志物提供了重要依据。此外,研究还提出了 MP6/7 评分可作为预测鳞状细胞癌免疫治疗反应的潜在指标,为未来的临床应用和免疫治疗提供了新的方向。




![C127 [C-127]小鼠乳腺肿瘤细胞|C127细胞|小鼠乳腺肿瘤细胞|C127细胞|小鼠乳腺肿瘤细胞|C127](https://img1.dxycdn.com/2020/0703/473/5770838485445752243-14.jpg!wh200)