材料与仪器
动物准备: 称量小鼠并计算最终剂量。将其置于固定器中,仅露出尾巴。
血管扩张: 将鼠尾浸入温水(约 40°C)至少 1 分钟,或用酒精棉球擦拭,直至两侧静脉清晰可见。这是成功的关键。
药液准备: 在此期间,将计算好的 AAV 溶液吸入注射器。务必排尽气泡,并将注射器静置约 40 秒,使其恢复至室温,避免冷刺激导致血管收缩。
步骤
1.病毒注射
定位与固定: 擦干鼠尾,用酒精消毒后再次擦干。用拇指和食指绷直鼠尾,使一侧静脉朝上。始终从尾巴的远端(靠近尾尖)开始首次注射。
进针: 将针头斜面朝上,以几乎与尾巴平行的极小角度,平稳地滑入静脉。
推注与判断:
成功标志: 推注活塞时应感觉不到任何阻力,部分品系小鼠可见注射点近端的血管瞬间变白。
失败迹象: 若感到阻力或注射部位出现皮下鼓包,说明注射失败,应立即停止,拔出针头。
再次尝试: 若初次失败,须在更靠近身体(近端)的位置重新尝试。每侧静脉的失败尝试不应超过 3 次。
2.注射后处理
止血: 注射完成后,缓慢拔出针头,并立即用干纱布按压注射点至少 1 分钟,直至完全止血。
观察与清洁: 将小鼠移入新笼中,密切观察至少 10 分钟。最后,用 70% 乙醇彻底消毒工作台面。
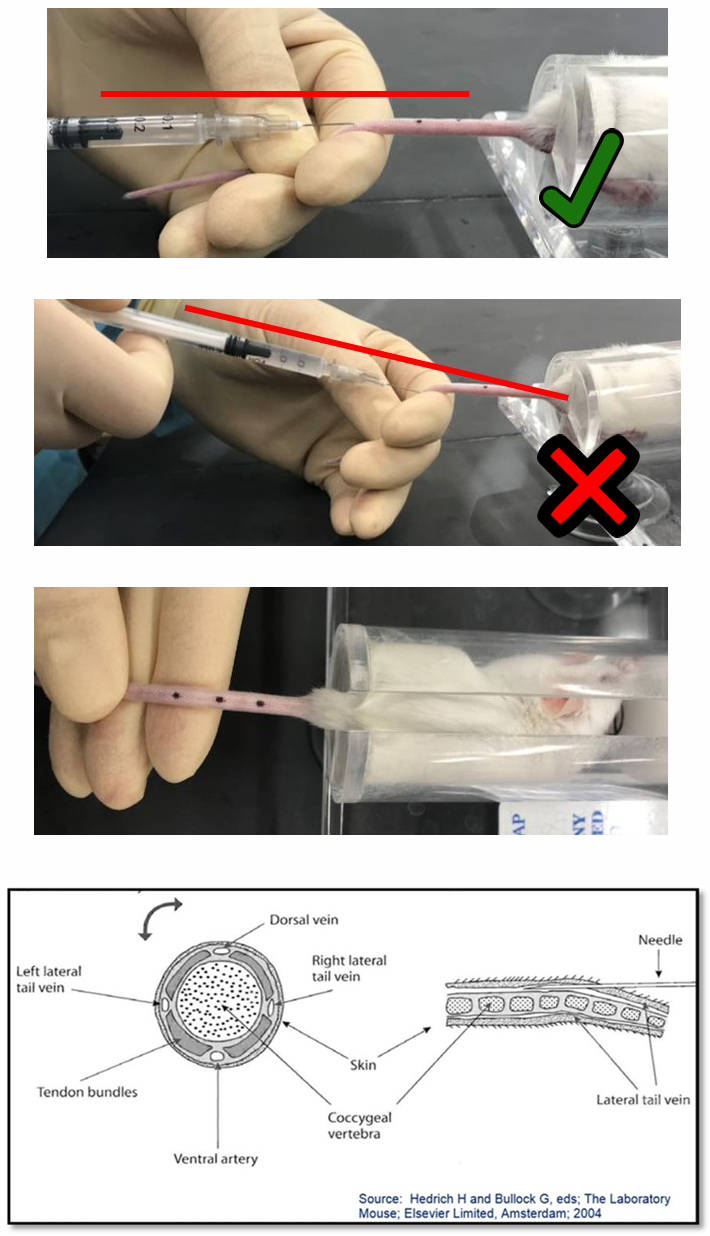
图片来源:https://research.unc.edu/wp-content/uploads/2021/06/mouse-class-handout.pdf
来源:丁香实验