万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
北京义翘神州科技股份有限公司
- 服务名称:
细胞库检测服务
- 规格:
询价
根据《中国药典》2020版三部生物制品生产检定用动物细胞基质制备及质量控制,用于生产抗体类药物、蛋白类药物、细胞治疗产品等生物制品的细胞系/株,需通过全面的细胞检定,并经国家药品监督管理部门批准。义翘神州细胞库检测实验室为生物安全二级实验室,已在北京市备案,且通过CNAS认证。该实验室按照GMP和GLP质量体系运行,B+A环境,满足无菌检测、分枝杆菌检测环境要求。
义翘神州拥有经验丰富的检测团队,可全程提供技术指导,并在项目开展之前提供相关咨询。依据药典方法及ICH、FDA及其它监管法规,义翘神州可根据客户的不同申报需求,提供最佳的细胞库检定方案,以更好地帮助客户完成中外申报,满足出海需求。出具的检测报告获得监管部门认可,已助力多家知名公司完成IND和BLA申报。

细胞库的建立
细胞库的建立可为生物制品的生产提供检定合格、质量相同、能持续稳定传代的细胞。
各级细胞库的概念
- PCB:由一个原始细胞群体发展成为传代稳定的细胞群体,或经过克隆培养形成的均一细胞群体,通过检定证明适用于生物制品生产或检定。在特定条件下,将一定数量、成分均一的细胞悬液,定量均匀分装于细胞冻存管,于液氮冻存,即为细胞种子,供建立主细胞库用。
- WCB:工作细胞库的细胞由MCB传代扩增制成。生产企业的工作细胞库必须限定为一个细胞代次。冻存时细胞的传代水平须确保细胞复苏后传代增殖的细胞数量能满足生产一批或一个亚批制品。复苏后的传代的水平应不超过批准的该细胞用于生产的最高限定。所制备的WCB必须经检定合格后,方可用于生产。
- MCB:取细胞种子经细胞传代、增殖后均匀混合成一批,定量均匀分装于细胞冻存管,保存于液氮。经全面检定合格后,即可作为主细胞库,用于工作细胞库的制备。生产企业的主细胞库最多不得超过两个细胞代次。
- EOPC&UPB:生产终末细胞是指在或超过生产末期时收获的细胞,尽可能取按生产规模制备的生产末期细胞。EOPC应进行一次全面检定,当生产工艺发生改变时,应重新对EOPC进行检测。收获液UPB包含生产用细胞和细胞培养上清液。
细胞库检定的必要性
生物制品的安全性:造成生物制品的污染,直接影响产品的安全性; 污染后给企业带来巨大的经济损失。
国内外法规要求:中国、美国、欧洲等药典明确规定必须对细胞库进行充分检定后才可用于生物制品的生产; CDE审查必查项目。
细胞库检定阶段
 |
|
双C认证的细胞库检测服务
○ 经验丰富,方法成熟 ○ 检测快,通量高,周期短 ○ 支持中外双报,满足出海需求
细胞库检测技术平台

苏州细胞库检测中心
苏州细胞库检测中心是一个专门提供细胞库检定服务的检测中心,占地面积广,通量大,可以解决更多客户需求。同时实验室严格遵循GLP和GMP规范进行管理。
• 体系认证:CMA认证、CNAS (申请中)
• 管理:GMP、GLP、CNAS
• 实验室:生物二级+负压条件

北京细胞库检测中心
拥有专业的细胞库检测技术人员,实践经验丰富,可根据不同生物制品类别和国内外(如NMPA、FDA、ICH、EMA等)不同的申报要求,制定规范科学和经验证的细胞库检定方案。
• 体系认证:CNAS认证
• 管理:GMP、GLP、CNAS
• 实验室:生物二级+负压条件

先进的实验室和仪器设备
实验室按照GLP和GMP质量体系运行,B+A环境,符合无菌检测、分枝杆菌检测环境要求。并通过生物安全二级实验室备案,保证生物安全。配套共聚焦显微镜、透射电镜、荧光定量PCR仪等先进仪器设备。

细胞库检测服务范围
义翘神州可提供主细胞库(MCB)、工作细胞库(WCB)、收获液 (UPB)、生产终末细胞(EOPC)的细胞库检定服务,已成功检测多个CHO、293、间充质干细胞等细胞库项目。细胞库检测方法成熟,符合药典等法规的要求,且经过严格的方法学验证。

细胞库检测服务内容
义翘神州遵循NMPA、FDA、EMA、ICH等多个国内外法规和指导原则,建立了全面的细胞库检定方法,主要包括以下几个方面:细胞鉴别、无菌检查、支原体检查、内外源病毒污染检查、成瘤性检查等,义翘神州提供的检测项目和方法描述见下表:
备注:"+" 为必检项目,"-" 为非强制检定项目。(+) 表示需要根据细胞特性、传代历史、培养过程等情况要求的检定项目。
细胞库检定方法
- 细菌、真菌检查
无菌检查
按照2020版《中国药典》三部通则1101无菌检查法的要求进行,义翘神州可提供薄膜过滤法和直接接种法。无菌检查在B+A环境中进行,并且在检测过程中对环境进行持续监测。下图是采用薄膜过滤法的案例。

- 支原体检查——培养法
按照2020版《中国药典》中生物制品生产检定用动物细胞基质制备及质量控制及通则3301支原体检查法的要求进行,义翘神州提供符合法规要求的支原体检查(培养法)。培养法检测的灵敏度高于中国药典要求,肺炎支原体达到10-9,口腔支原体达到10-5。

- 支原体检查——DNA染色法
按照2020版《中国药典》中生物制品生产检定用动物细胞基质制备及质量控制及通则3301支原体检查法的要求进行,义翘神州提供符合法规要求的指示细胞培养法(DNA 染色法)。如果样品被支原体污染,在荧光显微镜下除细胞外,可见大小不等、不规则的荧光着色颗粒。

- 内外源病毒污染检查——体外不同指示细胞接种培养
按照2020版《中国药典》中生物制品生产检定用动物细胞基质制备及质量控制的要求进行,根据样品需求提供周期为14或28天(人或猴巨细胞病毒,CMV)的检测。将供试品接种至3种指示细胞(Vero、MRC-5、同种属同组织类型来源细胞),连续培养14天或28天,观察细胞病变,并采用血吸附和血凝集检测是否存在任何病毒污染。
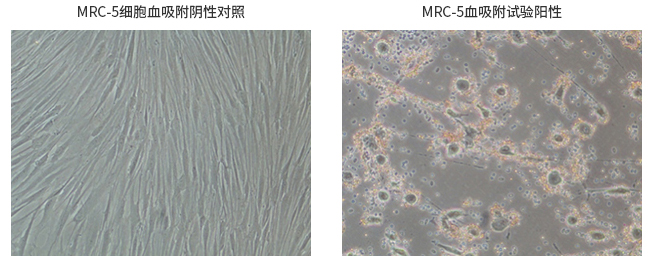
- 内外源病毒污染检查——牛源病毒检查
按照2020版《中国药典》中生物制品生产检定用动物细胞基质制备及质量控制及通则3604新生牛血清检测要求的要求进行。通过接种指示细胞培养21天,分别进行细胞病变观察(CPE)、血吸附检查(HAd)及荧光抗体检测(IF)。牛源性病毒检查完全按照中国药典要求,提供完整的阳性对照和阴性对照。
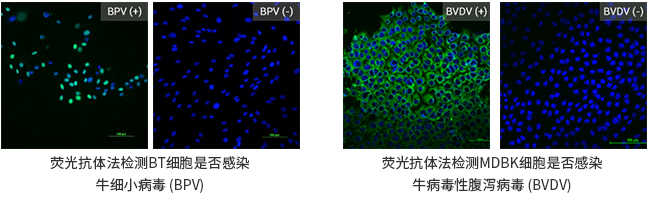
- 内外源病毒污染检查——猪源病毒检查
按照2020版《中国药典》中生物制品生产检定用动物细胞基质制备及质量控制的要求进行,通过接种指示细胞PK-15培养21天后进行细胞病变观察(CPE)、血吸附检查(HAd)。
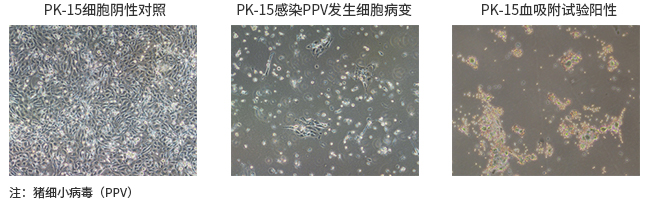
- 内外源病毒污染检查——动物和鸡胚体内接种法
按照2020版《中国药典》中生物制品生产检定用动物细胞基质制备及质量控制及通则3302外源病毒因子检查法的要求进行,义翘神州提供乳鼠脑内及腹腔接种法、小鼠脑内及腹腔接种法、豚鼠腹腔接种法、家兔皮内及皮下接种法、鸡胚接种法。

细胞库检测服务案例
义翘神州已为近100家公司提供了细胞库检测服务,总共完成了600个以上细胞库检测项目,助力客户成功申报多个IND或BLA项目。以客户利益为先,义翘神州拥有经验丰富的检测团队,可全程提供技术指导,并在项目开展之前提供相关咨询,积极帮助客户解决细胞库检定中遇到的任何问题。
我们的服务:检测周期短 实时跟踪项目进度 经验丰富,为客户提供有效解决方案 响应速度快
案例1:样品检测异常,积极帮助客户寻找原因
客户的样品接种后指示细胞死亡,样品检测异常,不能进行申报。义翘神州以客户利益为先,不轻易否定样品品质,帮助客户分析和验证可能的原因。经分析,该实验阴性对照组指示细胞无异常,阳性对照组指示细胞有病变,结果均符合预期,但样品组指示细胞异常死亡,分析样品中某种物质影响细胞生长。实验证明是由于样品中含有一定量的抗性筛选试剂造成的影响。义翘神州建议客户使用不含抗性筛选的培养基培养3代后再进行检测。最终样品检测合格,并成功通过NMPA审评。

案例2:优化培养条件,提高细胞活率,满足检测需求
收到客户样品后,经检测发现,细胞存活率低,无法进行细胞形态学观察试验。义翘积极与客户沟通反馈,寻找细胞存活率较低的原因,通过优化培养基和培养条件等方法,成功提高细胞存活率,顺利完成样品检测。

细胞库检测常见问题解答
IND和BLA阶段细胞库的检测要求有什么不同吗?EOPC美国只要求一批,国内需要检测几批是否最近有新的讨论?
IND和BLA阶段细胞库的检测要求是一样的,只要符合现行法规要求就可以,如在申报时某些检项法规做了修订,则需要对相应检项进行补充检定;EOPC中国药典中没有明确要求必须检定三批,工艺规模相同的情况下,一批全检是最低要求。我们推荐在IND申报阶段,一批全检,另外两批部分检;BLA阶段工艺验证三批全检。
建库细胞的来源什么样是合规的?
如采用已建株的细胞系/株,应具有细胞来源的证明资料。应从能够提供初始细胞历史及其溯源性书面证明材料的机构获得,且应提供该细胞在该机构的详细传代记录,包括培养过程中所使用的所有原材料的详细信息,如种类、来源、批号、生产日期及有效期、制备或使用方法、质量标准及检测结果等。
如果CHO细胞库检定内源性病毒是阳性的,该如何处理跟补救?
CHO细胞系内含有逆转录病毒基因序列,可能会表达内源性逆转录病毒颗粒,因此这类细胞应进行感染性试验,以确定所表达的逆转录病毒是否具有感染性,只要感染性结果为阴性,则可以用于生产,但是若可产生感染性逆转录病毒颗粒,且下游工艺不能证明病毒被清除的细胞基质不得用于生产。
更多生物安全检测服务
更多细胞库检测相关学习资源
- 讲师介绍
李晴晴
- 视频介绍
细胞库是生物制药的源头,重中之重,需要一份详尽的细胞库检测规范和工艺,确保所生产的生物制品安全性、纯度、理化指标和药效指标符合相关法规规定。细胞库可能携带病原微生物,如细菌、真菌、支原体、分枝杆菌、内源性病毒或外界污染的病毒,导致生产制备的生物制品含有污染的病原微生物,带来治疗上的安全风险。
中国、美国、欧洲等药典明确规定必须对细胞库以及生产过程中相关的生物制品进行充分检定,确保细胞库没有污染后,才能用于生物制品的生产。主细胞库(MCB)、工作细胞库(WCB)、生产终末细胞(EOPC)以及收获液(UPB)等都是细胞库检定的重点范畴。随着中国自2017年加入ICH,中美双报已经成为国内各大药企药物申报的新趋势,国内外法规对于细胞库及收获液等检定要求存在一定的差异,细胞库检定如何满足中美双报也是大家讨论的热点。
本次讲座将围绕细胞库检定中美双报的策略以及具体的方法差异,与大家分享双报的要点,为相关制药企业的技术人员更好的了解和掌握细胞库中美双报提供技术指导。
立即咨询细胞库检测服务
扫码咨询细胞库检测服务

(欢迎小伙伴来咨询哦! 请注明来源、姓名,单位)
下载产品相关技术资料,获取更多细胞库检测服务相关内容!
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验阴性。经小量试验适于杂交瘤细胞生长。2、培养液应有培养液来源,质量指标。3、化学试剂规格应达到分析纯以上。二、基因工程抗体参考《人用重组DNA制品质量控制技术指导原则》和本指导原则中的有关要求进行。三、细胞库的建立应分别建立原始细胞库、主细胞库、工作细胞库的三级管理细胞库,一般情况下主细胞库来自原始细胞库、工作细胞库来自主细胞库。各级细胞库应有详细的制备过程、检定情况及管理规定等。四、单抗生产包括用小鼠腹水法和细胞培养法制备。(一)小鼠腹水法1、小鼠制备腹水必需使用合格的SPF级BACB/C小鼠
质相互作用尤为关键。迄今为止不到十年的时间,全球已有数百套基于此项技术(xMAP:flexible Multi-Analyte Profiling)的检测平台,用于蛋白质,免疫学等等领域的研究,临床诊断试剂的开发方面也发展迅速,自身免疫鉴别诊断试剂等已通过了FDA认证。 默克密理博与路明克斯2010年最新推出的新一代磁珠多重检测系统MAGPIX,主机采用了革命性的光学系统及流路系统,使得新的MAGPIX结构上更加紧凑,在光路设计上采用了全新的LED激发光源及高分辨率的CCD成像技术,配合功能
rop基因的质粒在拷贝数上的表现却不尽相同,这是由于pUC质粒在RNAII序列上带有一个G到A的点突变,可依温度的不同而改变正向调节分子RNAII的二级结构,Chambers S &Yanisch-Perron C等研究表明在42℃或者45℃下,RNAII似乎折叠成抗RNAI抑制的构型,于是DNA合成的起始加强,结果拷贝数特别高[12-14]。 尽管构建DNA疫苗时普遍使用ColE1类型复制子,但Uhlin B & Remaut E报道的一种由低拷贝发展而来的由温度控制的“失控型”复制子同样具有