相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 提供商:
云舟生物科技(广州)股份有限公司
- 服务名称:
提供定制载体及辅助载体
概述
CRISPR / Cas9载体是几种新兴的基因组编辑工具之一,可以在基因组的靶位点快速有效地创建突变(另外两种流行的是ZFN和TALEN)。
Cas9是一类RNA引导的DNA核酸酶的成员,它们是天然原核免疫系统的一部分,可赋予对外来遗传元素(如质粒和噬菌体)的抗性。在细胞内,Cas9酶与引导RNA(gRNA)形成复合物,通过与基因组中同源的18-22nt靶序列直接相互作用提供靶向特异性。gRNA与靶位点的杂交定位Cas9,然后切割基因组中的靶位点。
为了实现CRISPR介导的基因靶向,靶细胞必须同时共表达Cas9和靶位点特异性gRNA。这可以通过表达来自同一载体(又名多合一载体)的Cas9和gRNA序列或使用单独的载体来驱动Cas9和gRNA表达(分别是仅Cas9和仅gRNA载体)来实现。与一体化载体相比,使用单独的载体表达Cas9和gRNA的优势在于,根据用户的实验目标,它可以灵活地组合使用不同的gRNA表达载体与各种Cas9变体(野生型核酸酶、切口酶、核酸酶死)。此外,使用单独的仅gRNA载体允许稳定表达高水平Cas9的细胞或生物体转染针对同一基因或不同基因的不同gRNA序列。这为比较不同gRNA序列在具有可比和高水平Cas9表达的细胞或生物体中CRISPR介导的基因靶向并行的效率提供了机会。
常规质粒gRNA表达载体是一种高效的工具,用于将基于常规转染的靶位点特异性gRNA序列递送到哺乳动物细胞中。通过常规转染将质粒载体递送到哺乳动物细胞中是生物医学研究中使用最广泛的程序之一。虽然多年来已经开发出许多更复杂的基因递送载体系统,如慢病毒载体、腺病毒载体、AAV载体和piggyBac,但传统质粒转染仍然是许多实验室基因递送的主力。这主要是由于其技术简单性以及在各种细胞类型中的良好效率。使用常规质粒载体转染的一个关键特征是它是瞬时的,只有非常低比例的细胞稳定地将质粒整合到基因组中(通常小于1%)。
我们的常规质粒gRNA表达载体可用于表达单gRNA或双gRNA。虽然单gRNA载体广泛用于传统的CRISPR基因组编辑,例如产生单基因敲除,但双gRNA载体对于需要同时靶向一对基因组位点的应用是必要的。此类应用的示例包括:1)配对的Cas9切口酶实验,其中hCas9的“切口酶”突变形式(hCas10-D9A)与靶向单个靶位点的两条相反链的两个gRNA结合使用,以在每条链上产生单链切割一个,从而导致DSB的靶向特异性高于单个gRNA;2)在一对gRNA靶向的两个DSB之间产生片段的缺失;3)同时靶向两个不同的基因。单个 gRNA 载体由驱动靶位点特异性 gRNA 序列的单个人 U6 启动子组成,而双 gRNA 载体由两个连续的 U6 启动子组成,这些启动子驱动对两个感兴趣的基因组靶位点特异性 gRNA 序列的表达。
技术简单: 通过传统转染将质粒载体递送到细胞中在技术上很简单,并且比需要包装活病毒的基于病毒的载体容易得多。
高级表达式: 质粒的常规转染通常会导致细胞中的拷贝数非常高(每个细胞高达数千个拷贝)。这可能导致载体上携带的基因的表达水平非常高。
有限的细胞类型范围: 质粒转染的效率因细胞类型而异。非分裂细胞通常比分裂细胞更难转染,原代细胞通常比永生化细胞系更难转染。众所周知,一些重要的细胞类型,如神经元和胰β细胞,很难转染。此外,质粒转染在很大程度上仅限于体外应用,很少在体内使用。
基因传递的不均匀性: 虽然成功的转染可以导致每个细胞转染质粒载体的平均拷贝数非常高,但这可能是高度不均匀的。一些细胞可以携带许多拷贝,而另一些细胞携带很少或没有。这与基于病毒的载体的转导不同,后者倾向于导致相对均匀的基因传递到细胞中。
PAM 要求: 基于CRISPR/Cas9的靶向依赖于对位于gRNA识别序列3'末端的原间隔相邻基序(PAM)的严格要求。所需的PAM序列因所使用的Cas9变体而异。
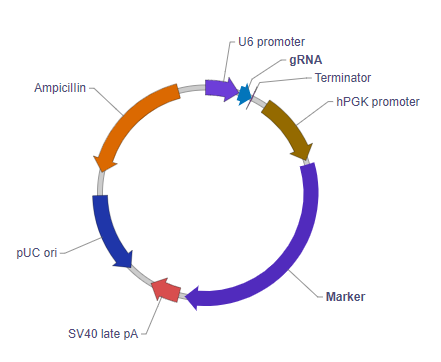
U6 Promoter: Drives expression of the downstream gRNA sequence. This is the promoter of the human U6 snRNA gene, an RNA polymerase III promoter which efficiently expresses short RNAs.
gRNA: Guide RNA compatible with the Cas9 variant being used.
Terminator: Terminates transcription of the gRNA.
hPGK promoter: Human phosphoglycerate kinase 1 promoter. It drives the ubiquitous expression of the downstream marker gene.
Marker: A drug selection gene (such as neomycin resistance), a visually detectable gene (such as EGFP), or a dual-reporter gene (such as EGFP/Neo). This allows cells transduced with the vector to be selected and/or visualized.
SV40 late pA: Simian virus 40 late polyadenylation signal. It facilitates transcriptional termination of the upstream ORF.
Ampicillin: Ampicillin resistance gene. It allows the plasmid to be maintained by ampicillin selection in E. coli.
pUC ori: pUC origin of replication. Plasmids carrying this origin exist in high copy numbers in E. coli.
Dual-gRNA regular plasmid expression vector
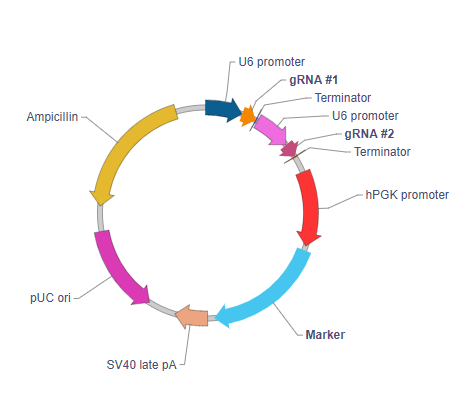
U6 Promoter: Drives expression of the downstream gRNA sequence. This is the promoter of the human U6 snRNA gene, an RNA polymerase III promoter which efficiently expresses short RNAs.
gRNA #1: The first guide RNA compatible with the Cas9 variant being used.
gRNA #2: The second guide RNA compatible with the Cas9 variant being used.
Terminator: Terminates transcription of the gRNA.
hPGK promoter: Human phosphoglycerate kinase 1 promoter. It drives the ubiquitous expression of the downstream marker gene.
Marker: A drug selection gene (such as neomycin resistance), a visually detectable gene (such as EGFP), or a dual-reporter gene (such as EGFP/Neo). This allows cells transduced with the vector to be selected and/or visualized.
SV40 late pA: Simian virus 40 late polyadenylation signal. It facilitates transcriptional termination of the upstream ORF.
Ampicillin: Ampicillin resistance gene. It allows the plasmid to be maintained by ampicillin selection in E. coli.
pUC ori: pUC origin of replication. Plasmids carrying this origin exist in high copy numbers in E. coli.
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验For further information about this vector system, please refer to the papers below.
| References | Topic |
|---|---|
| Science. 339:819 (2013) | Description of genome editing using the CRISPR/Cas9 system |
| Cell. 154:1380–9 (2013) | Use of Cas9 D10A double nicking for increased specificity |
| Science 339:823 (2013) | CRISPR/Cas9 targeting using regular plasmid gRNA expressing vectors |
| Plos One. 12: e0187236 (2017) | CRISPR/Cas9 vectors for dual gRNA expression |
 技术资料
技术资料暂无技术资料 索取技术资料