相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
云舟生物科技(广州)股份有限公司
- 服务名称:
提供定制载体
概述
CRISPR/Cas9(规律成簇的间隔短回文重复序列及相关蛋白9)核酸酶表达载体属于几种新兴的基因组编辑工具之一(另外两种是ZFN和TALEN),可在基因组的靶位点快速有效地产生突变。这些质粒载体编码的特异性RNA,能够引导DNA核酸酶(或缺刻酶)编辑基因组中特定位点的DNA序列。
Cas9是RNA引导DNA核酸酶,是天然原核免疫系统的一部分,赋予细菌产生对质粒和噬菌体等外源遗传物质的抵抗能力。在细胞内,Cas9核酸酶与引导RNA(gRNA)形成复合物,该复合物通过与基因组中的18-22 nt的同源靶序列直接相互作用,gRNA与靶位点通过互补配对使Cas9定位到靶序列上,然后切割基因组中的靶位点。为了方便使用,我们设计的CRISPR/Cas9载体能够在一个载体上同时有效表达Cas9核酸酶(或缺刻酶)和引导RNA(gRNA)。
我们的CRISPR/Cas9表达载体中有两种Cas9核酸酶供选择,一种是标准的人源化Cas9(hCas9),能够有效地在靶位点产生双链断裂(DSBs);另一种是“缺刻酶”(Cas9_D10A),仅在DNA中产生单链切割。如果将Cas9_D10A缺刻酶与靶向两条互补链的两个gRNA一起使用,缺刻酶会在两条链上产生单链切割,从而导致靶位点处产生DSB。这种方法通常会减少CRISPR/Cas9脱靶效应,因为它需要两个gRNA同时靶向靶位点。
细胞通过非同源末端连接途径(NHEJ)修复通常会产生小的片段或碱基缺失,插入和碱基置换等突变。当这些突变破坏蛋白质编码区(例如引起移码缺失)时,会引起功能性基因敲除。在少数情况下,CRISPR/Cas9载体和外源供体DNA模板共同导入细胞时,细胞会通过同源性修复(HDR)机制来修复DSB,靶基因DNA序列会被模板序列取代,碱基发生改变,如点突变等。缺刻基因组DNA也会经常发生同源修复(HDR),如将外源模板DNA与Cas9_D10A缺刻酶一起导入细胞中,有可能产生碱基改变。
利用CRISPR/Cas9系统可以有效靶向大部分DNA序列,而NGG(有时是NAG)是必须的。NGG叫做前间区序列邻近基序(PAM),位于靶DNA,gRNA识别序列的3'末端。
我们的CRISPR/Cas9表达载体可以用于快速高效靶向细胞基因组,并在靶位点并产生碱基缺失等突变。为了在特定的靶位点引入突变,需要与靶DNA序列匹配的gRNA序列以及核酸酶hCas9(产生DSB)或其变体Cas9_D10A缺刻酶(单链切割)。

图1 all-in-one CRISPR系统介导的基因编辑。(A)向稳定表达EGFP的HEK293T细胞(HEK293T-EGFP)转染表达Cas9:T2A:mCherry的常规质粒和靶向EGFP的scramble gRNA。转染后72小时,流式细胞术检测EGFP表达水平。MFI表示荧光强度中值。(B)显微镜(100x)观察EGFP和mCherry表达。(C)转染all-in-one CRISPR载体的细胞对比无转染细胞中的相对EGFP表达。相对EGFP表达量用以下公式计算:[MFI (experimental group) – MFI (WT HEK293T cells)] / [MFI (HEK293T-EGFP cells) – MFI (WT HEK293T cells)]。Mean±SD,ns P>0.05,ANOVA以及Tukey事后检验。(D)gRNA靶向的基因组DNA区域使用PCR进行扩增,基因编辑效果使用T7E1试验确认。
瞬时表达:转染CRISPR/Cas9质粒载体后,Cas9蛋白和gRNA会在靶细胞中大量瞬时表达。如果没有药物筛选,质粒会随着时间流逝而丢失,在基因组编辑发生后,靶细胞中的Cas9和gRNA也会逐渐消失。
简单易懂:gRNA和靶位点之间的简单同源关系使得CRISPR/Cas9系统简单且易于设计。
不足之处
具有脱靶效应:已有文献报道CRISPR/Cas9具有脱靶效应,通常TALEN系统比CRISPR/Cas9具有更低的脱靶活性。通过将Cas9_D10A缺刻酶与两种gRNA结合使用(如上所述),可以显著减轻脱靶效应。
PAM要求:CRISPR/Cas9靶位点必须包含NGG序列(使用较多),也叫做PAM序列,位于gRNA识别序列3'末端。
载体关键元件
Single-gRNA CRISPR regular plasmid vector

U6 Promoter: This drives high level expression of the gRNA. This is the promoter of the human U6 snRNA gene, an RNA polymerase III promoter which efficiently expresses short RNAs.
gRNA: Guide RNA compatible with Cas9 derived from Streptococcus pyogenes.
Terminator: Terminates transcription of the gRNA.
CBh promoter: Chicken beta-actin promoter. Drives expression of the downstream Cas9 nuclease.
Cas protein: Cas9 nuclease variant chosen by user.
BGH pA: Bovine growth hormone polyadenylation signal. It facilitates transcriptional termination of the upstream ORF.
CMV promoter: Human cytomegalovirus immediate early promoter. It drives the ubiquitous expression of the downstream marker gene.
SV40 late pA: Simian virus 40 late polyadenylation signal. It facilitates transcriptional termination of the upstream ORF.
Ampicillin: Ampicillin resistance gene. It allows the plasmid to be maintained by ampicillin selection in E. coli.
pUC ori: pUC origin of replication. Plasmids carrying this origin exist in high copy numbers in E. coli.
Dual-gRNA CRISPR regular plasmid vector
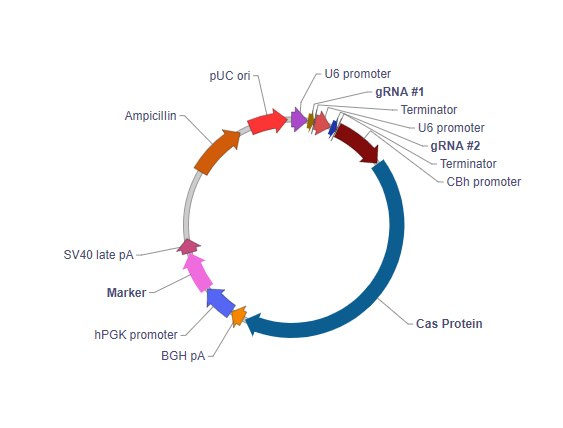
U6 Promoter: This drives high level expression of the gRNA. This is the promoter of the human U6 snRNA gene, an RNA polymerase III promoter which efficiently expresses short RNAs.
gRNA #1: The first guide RNA compatible with Cas9 derived from Streptococcus pyogenes.
gRNA #2: The second guide RNA compatible with Cas9 derived from Streptococcus pyogenes.
Terminator: Terminates transcription of the gRNA.
CBh promoter: Chicken beta-actin promoter. Drives expression of the downstream Cas9 nuclease.
Cas protein: Cas9 nuclease variant chosen by user.
BGH pA: Bovine growth hormone polyadenylation signal. It facilitates transcriptional termination of the upstream ORF.
CMV promoter: Human cytomegalovirus immediate early promoter. It drives the ubiquitous expression of the downstream marker gene.
SV40 late pA: Simian virus 40 late polyadenylation signal. It facilitates transcriptional termination of the upstream ORF.
Ampicillin: Ampicillin resistance gene. It allows the plasmid to be maintained by ampicillin selection in E. coli.
pUC ori: pUC origin of replication. Plasmids carrying this origin exist in high copy numbers in E. coli.
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验Cell Rep:上海科技大学季泉江团队开发出高效微型 CRISPR-SpaCas12f1 基因编辑系统
CRISPR-Cas 系统是目前最常用的基因编辑工具,但是由于传统的 Cas 核酸酶分子量普遍太大,使其在在体基因治疗的应用中受限。近年来,为了解决这一难题,小的 Cas 核酸酶逐渐被发现和探究。其中,Cas12f 核酸酶是目前最紧凑的 CRISPR 效应核酸酶,比传统 Cas9 和 Cas12a 核酸酶小一半以上,在临床治疗应用中具有巨大潜力,然而高效的 Cas12f 基因编辑系统仍旧较少。 2022 年 9 月 27 日,上海科技大学季泉江教授团队在 Cell Reports 发表
诺奖得主 Science 发文:基因编辑诞生 10 年,未来将如何改变世界?
,从患者体内采集细胞后,在体外进行基因编辑改造,之后再重新注入患者体内;体内基因编辑,在患者体内直接改造相关致病基因,使用某种载体将 CRISPR-Cas9 系统递送至目标器官或组织。 体外基因编辑通常用于编辑造血干细胞和祖细胞及白细胞,具有更高的细胞类型特异性和更严格的编辑质量,但可以在培养中存活增殖并保留体内活性的细胞类型有限。 体内基因编辑中,CRISPR 的编辑仍然是一个艰巨挑战,在递送载体中需要防止物质降解、毒化和从血管外渗出的吞噬作用,以及需要保证通过间质空间并释放物质的有效性(图
动物模型构建CRISPR-Cas9 系统作为最新一代基因编辑技术,能够简便高效地实现基因组精确 修饰,是制备哺乳动物疾病模型的重要工具。目前科学家利用 CRISPR-Cas9 技术在动物模型,如小鼠、大鼠、猪 和猴等研制方面做出一系列重要工作。如科学家们将 CRISPR-Cas9 系统导入小鼠受精卵,成功获得了有特定基因突变的小鼠模型,并获得近乎 100% 的基因靶向突变效率,极大地降低了基因编辑小鼠模型制备的难度和成本,有望被广泛应用。背景:使用自主研发的sgRNA设计平台为一个基因位点设计
 技术资料
技术资料暂无技术资料 索取技术资料