相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 服务名称:
AAV在肺部中的应用
- 提供商:
OBiO和元生物
目前对于肺部的病毒感染,普遍采用AAV病毒载体。虽然AAV1,5,6,9几个血清型均有报道能实现肺部表达,但是AAV9在肺部的表达最强。一般递送途径包括两类:系统注射(经血液循环)、鼻内或气管内递送(经呼吸道)。系统注射会同时感染其他脏器,病毒被稀释,使得靶向肺脏的病毒减少,因此一般对于肺脏的特异性感染,都是采用呼吸道递送。鼻内递送直接使用微型移液器推送,参考剂量是1×1011vg病毒,体积50ul。气管内递送则使用24G的导管将病毒液体推送到气管内,剂量同鼻内递送。通过肺呼吸道递送,可以实现最大程度的特异性递送,并实现肺部的高效表达,同时降低病毒剂量(图1)。
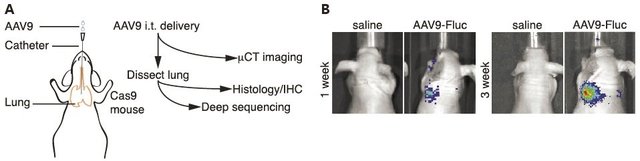
图1 肺脏AAV9载体递送方法示意图及肺脏特异性表达效果(Cell. October, 2014)
使用病毒载体的一个不可忽略的问题就是免疫反应。尽管AAV的免疫原性相对较低,但是对于二次免疫,其免疫反应也会非常显著,并且不同血清型的AAV产生免疫反应的程度不一样。相对来说,AAV9产生的免疫反应较小,且鼻内递送病毒因为几乎没有体液反应,可以考虑二次递送。
肺部特异性表达对启动子一般没有特别要求,像CMV、CAG等在肺部中表达均很好。实验中可以通过上述特殊的递送方法实现在肺部的特异性表达。
AAV介导CRISPR/Cas9在肺部的应用
通过CRISPR/Cas9系统能够快速获得各种基因敲除小鼠模型。由于该技术能够同时靶向多个DNA位点,因此在肺部可以借助AAV9载体递送sgRNA,再结合含Cas9基因的knock-in小鼠,可以快速建立肺部特异性敲除小鼠模型。
以下简要分享张锋团队利用CRISPR/Cas9的Knock-in小鼠和AAV载体递送的sgRNA靶向小鼠肺部,实现肺部基因的特异性敲除,并成功诱发肿瘤(图2)。

图2 基于AAV载体的靶向肺部基因的sgRNA表达载体(Cell. October, 2014)
上述AAV表达载体含有3个不同基因的sgRNA,可以同时失活3个基因。同时该载体表达Cre重组酶,能够诱导被感染的细胞激活Cas9的表达(图3)。
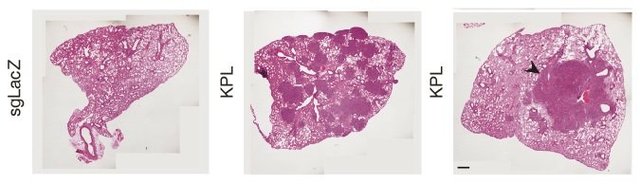
图3 通过AAV9载体靶向LKB1、Kras和p53后在肺部诱发肿瘤(Cell. October, 2014)
AAV9的感染效率与受体改造
AAV9对多种器官组织具有较高的感染倾向性,包括心脏、肌肉、肺以及神经等。很多病毒的感染入侵都依赖于特定的糖基化修饰。因此,研究人员对糖链分析后发现,通过神经氨酸酶(Neuraminidase)消化去除末端的唾液酸后,AAV9感染能力显著加强。而且,对肌肉、心脏和肝脏半乳糖水平的研究发现,AAV9对组织的感染效率与半乳糖的表达水平呈负相关:组织半乳糖表达越高,AAV9感染越低;组织中半乳糖水平越低,AAV9的感染水平越高。通过神经氨酸酶消化细胞表面的唾液酸基团后,能够增强AAV9对肺部组织的感染效率(图4-6)。
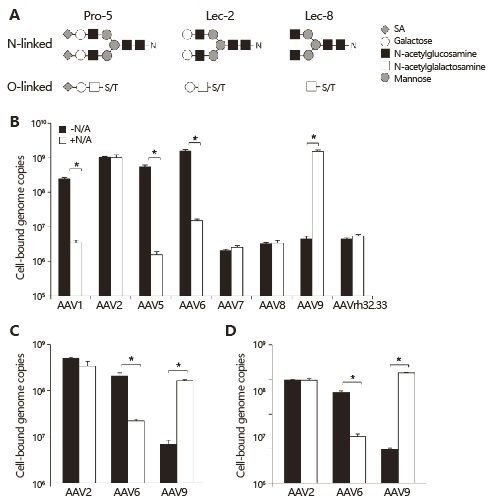
图4 神经氨酸酶处理对AAV病毒结合宿主细胞的效应(The Journal of Clinical Investigation. June, 2011)
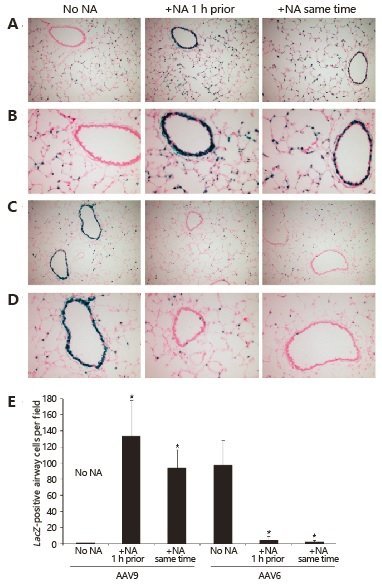
图5 神经氨酸酶处理后增强了AAV9对肺气道细胞感染(The Journal of Clinical Investigation. June, 2011)
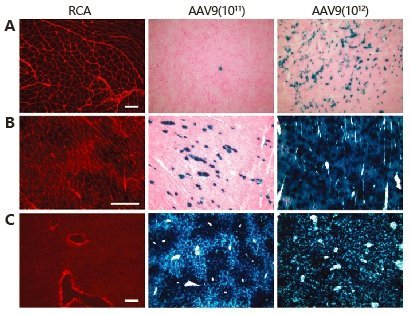
图6 半乳糖的表达与AAV9的感染效率成负相关(其中RCA能够结合半乳糖,用来指示半乳糖的表达水平)
(A-肌肉,B-心脏,C-肝脏)(The Journal of Clinical Investigation. June, 2011)
现在有很多实验室都在尝试对决定AAV血清型的衣壳蛋白进行改造,以达到增强AAV对某一特定组织高效感染的目的。另外,不同实验室采用的病毒包装体系和包装细胞不同,这些诸多因素使得不同研究中的结果往往出现差异。但是普遍的结论认为,通过尾静脉等系统注射,AAV9在心脏表达最高,其次为肌肉和肺部。肝脏感染的效果,不同研究中差别很大。一方面取决于启动子以及表达的靶基因本身;另一方面有些实验在注射过程中造成血管损伤后,肝脏会出现较高的表达,不过经检测发现,AAV9递送基因在肝脏中的表达没有在心脏和肌肉中持久。和元生物在AAV血清型方面的改造具有丰富的实践经验,致力于研发出组织特异性强的AAV血清型,为广大科研客户提供精准性高的AAV载体。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验and mitophagy in lung fibroblasts 的研究论文。 该研究表明,骨形态发生蛋白 4 (BMP4) 在 人肺中的下调,在 IPF 疾病发生和进展中起 关键作用,BMP4 信号通路通过调节肺成 纤维细胞的衰老和线粒体自噬抑制肺纤维 化。因此,BMP4 信号的激活可能是治疗 IPF 肺纤维化的一种新型有效的治疗方法。 血清型:AAV9 注射方式:气管内注射 病毒滴度:1x1010 vp/ml 靶向部位:肺 动物模型:C57BL/6 BMP4+/+ and BMP4+/- mice
遗传性眼病是一类由于基因缺陷而导致的疾病,目前已报道大约有 200 种遗传性眼病和超过 400 种具有眼部表现的系统性疾 病。遗传性眼病引起的视觉功能丧失通常很难通过传统的手术、激光治疗和局部药物治疗来治愈。基因治疗已成为治疗这类疾 病最重要的手段。腺相关病毒(AAV)由于具有安全性好、免疫原性低、表达时间长、有多种组织和细胞特异性血清型可选 择、高稳定性等优势,已被广泛应用于眼科疾病基因治疗。首款获批上市的遗传性视网膜疾病基因治疗药物 Luxturna(约 85 万 美元/剂)采用了 AAV
特异性评估:通过 Cre-LoxP 和 CRISPR/Cas9 技术,研究证实了 AAV9-Tnnt2 载体在肝脏中存在广泛的低水平泄漏表达; 2.miR122TS 介导的肝脏去靶:利用 miR122 在肝脏中的特异性高表达,通过在载体中引入 miR122TS,有效降低了肝脏的基因泄漏表达; 3.心脏疾病模型验证:将优化后的 AAV 载体应用于心梗小鼠模型,证实了其在改善心脏功能方面的显著效果,同时避免了对肝脏的额外损伤。 病毒工具 AAV9-Tnnt2-GFP AAV9-Tnnt2-Cre
 技术资料
技术资料暂无技术资料 索取技术资料