万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 服务名称:
细胞实验/稳转细胞株构建/稳转株构建/稳定细胞株构建/稳定株构建/稳定表达GFP细胞株/耐药细胞株/药物筛选细胞
- 提供商:
OBiO和元生物
稳转细胞株构建/稳转株构建/稳定细胞株构建/稳定株构建实验
摘要:本实验使用过表达human Oct-4-EGFP的慢病毒感染HeLa细胞。该病毒的表达框为pLenti-CMV-Oct-4-EGFP-3FLAG-PGK-Puro: CMV启动子驱动Oct-4-EGFP基因的表达, 同时由PGK启动子驱动puromycin抗性基因的表达。在感染HeLa细胞72h后,通过加入并维持2μg/μL的puromycin杀死未被有效感染的细胞。从而在puromycin药物的维持下最终获得Oct-4-EGFP稳定表达的混合稳定株。
一、 实验原理
外源基因在细胞中的表达可分为两大类,一类是瞬时表达,一类是稳定表达(永久表达)。前者外源DNA/RNA不整合到宿主染色体中,虽然可以达到高水平的表达,但通常只持续几天。后者外源DNA整合到宿主细胞染色体上,使宿主细胞可长期表达目的基因。建立稳定细胞株,一般是根据不同基因载体中所含有的抗性标志选用相应的药物对靶细胞进行筛选。
最常用的抗性标记基因有潮霉素(hygromycin)、新霉素(neomycin)和嘌呤霉素(puromycin),常用Hygromycin B、G418和puromycin进行选择性筛选。传统的稳定株筛选方法需要通过外源基因的瞬时转染后对靶细胞进行筛选, 最终获得从单一细胞扩增起来的稳定细胞株, 该方法阳性率低,周期长,工作量大。
慢病毒是一种RNA病毒,携带的外源基因在病毒感染细胞后需要逆转录为DNA,再整合到宿主细胞基因组以后才能表达。 利用慢病毒必须整合到宿主基因组的特性来筛选稳定株的方法克服了传统方法的弊端,可以在短时间内获得高效率的稳定细胞株。筛选得到的细胞或者可稳定表达目的蛋白,用于蛋白的扩增和富集;或者得到稳定沉默特定基因的细胞株。
二、 实验目的
通过慢病毒感染配合药物筛选的方法获得稳定表达Oct-4-EGFP的HeLa稳定细胞株。
三、 实验步骤
实验共分以下3个主要步骤:
1. 细胞铺板
将HeLa细胞按30%的融合度接种到24孔板:
1) HeLa细胞配成1×105 cells/mL细胞悬液,待铺板。
2) 每孔铺500μL,即5×104 cells/well,铺1块24孔板。
2. 感染慢病毒
12~20h后感染慢病毒:
1) 根据公式计算病毒用量: (细胞数×MOI值/病毒原液滴度)×103=病毒用量(μL)。
2) 本实验中MOI取10,吸去与加入病毒体积相同培养基。
3) 每孔加2.5μL的polybrene (1mg/mL),使polybrene终浓度达到5μg/mL。
4) 24h后换,弃去培养基后每孔加入500μL新鲜的培养基。
3. 稳定株筛选
1) 72h以后,加入终浓度2μg/μL puromycin。每隔2-3天换一次终浓度2μg/μL puromycin新鲜培养基。
2) 药物筛选约10天后,拍荧光照片。
3) 稳定细胞株冻存。
四、 实验结果

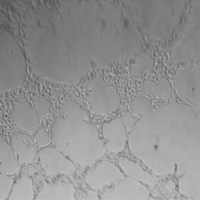
图1. 慢病毒感染HeLa细胞72h后荧光照片,MOI为10

图2. 慢病毒感染HeLa细胞,筛选10天后稳定株荧光照片
结论:从图1可以看到,在MOI为10条件下,HeLa的感染效率约为80%。根据图2,使用puromycin药物筛选10天后,表达目的基因的HeLa的比例在90%以上,且荧光亮度增强。Oct-4-EGFP稳定表达的HeLa细胞株筛选成功。
五、 参考文献
1. Zhang W, Kai K, Choi DS, Iwamoto T, Nguyen YH, Wong H, Landis MD, Ueno NT, Chang J, Qin L.Microfluidics separation reveals the stem-cell-like deformability of tumor-initiating cells.Proc Natl Acad Sci U S A. 2012 Nov 13;109(46):18707-12.
2. Day RN, Davidson MW.The fluorescent protein palette: tools for cellular imaging.Chem Soc Rev. 2009 Oct;38(10):2887-921.
3. Takahashi K, Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors.Cell. 2006 Aug 25;126(4):663-76. Epub 2006 Aug 10.
4. Weber K, Mock U, Petrowitz B, Bartsch U, Fehse B.Lentiviral gene ontology (LeGO) vectors equipped with novel drug-selectable fluorescent proteins: new building blocks for cell marking and multi-gene analysis.Gene Ther. 2010 Apr;17(4):511-20.
5. Sommer CA, Stadtfeld M, Murphy GJ, Hochedlinger K, Kotton DN, Mostoslavsky G.Induced pluripotent stem cell generation using a single lentiviral stem cell cassette.Stem Cells. 2009 Mar;27(3):543-9.
6. Szymczak AL, Workman CJ, Wang Y, Vignali KM, Dilioglou S, Vanin EF, Vignali DA.Correction of multi-gene deficiency in vivo using a single 'self-cleaving' 2A peptide-based retroviral vector.Nat Biotechnol. 2004 May;22(5):589-94.
7. Fitzgerald DJ, Berger P, Schaffitzel C, Yamada K, Richmond TJ, Berger I.Protein complex expression by using multigene baculoviral vectors.Nat Methods. 2006 Dec;3(12):1021-32.
8. Bieniossek C, Nie Y, Frey D, Olieric N, Schaffitzel C, Collinson I, Romier C, Berger P, Richmond TJ, Steinmetz MO, Berger I.Automated unrestricted multigene recombineering for multiprotein complex production.Nat Methods. 2009 Jun;6(6):447-50.
9. Kriz A, Schmid K, Baumgartner N, Ziegler U, Berger I, Ballmer-Hofer K, Berger P.A plasmid-based multigene expression system for mammalian cells.Nat Commun. 2010 Nov 16;1:120.
10. van den Ent F, Löwe J.RF cloning: a restriction-free method for inserting target genes into plasmids.J Biochem Biophys Methods. 2006 Apr 30;67(1):67-74.
11. Li MZ, Elledge SJ.Harnessing homologous recombination in vitro to generate recombinant DNA via SLIC.Nat Methods. 2007 Mar;4(3):251-6.
12. Sándor Z, Varga A, Horváth P, Nagy B, Szolcsányi J.Construction of a stable cell line uniformly expressing the rat TRPV1 receptor.Cell Mol Biol Lett. 2005;10(3):499-514.
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验目前慢病毒载体主要应用在以下几个方面: 细胞基因治疗(截止目前,已上市的 CAR-T 产品有 9 款采用了慢病毒载体递送 CAR 基因) 基因表达调控(过表达、RNA 干扰研究等) 基因编辑(CRlSPR/Cas9 gRNA 文库筛选、基因敲除、敲入、点突变、基因激活/抑制) 稳转细胞株构建 活体细胞成像追踪 转基因动物 图 1 慢病毒载体的主要应用方向 应用案例 案例 1:用慢病毒载体进行基因过表达,构建稳转细胞株,研究葡萄糖激酶在前列腺癌(PCa)中的作用[1] 细胞
,并且 EST12-RACK1 诱导的细胞焦亡在 M.tb 诱导的免疫中起关键作用。 研究内容: 1、RD 区编码蛋白筛选:对 40 种 RD 区(RD1-3、11-14)重组蛋白进行筛选(巨噬细胞焦磷酸相关蛋白),通过 LDH 释放实验细胞毒性分析,发现 EST12 对巨噬细胞有显著焦解作用。 2、菌株构建:构建 M. tb H37Rv ΔEST12(Rv1579c 敲除菌株)、BCG-EST12(Rv1579c 过表达菌株)、M. smeg–EST12(Rv1579c 过表达菌株)。 3、小鼠
监测蛋白间的相互作用。例如酵母URA3基因表达产物是尿嘧啶合成所必需的, 同时它又可催化5-氟乳清酸(5-FOA)转化为有毒物质。Vidal等构建了一酵母细胞株, 其URA3的表达由含GAL4结合位点的启动子严密控制。此细胞株在缺乏尿嘧啶的培养基中培育需要GAL4激活结构域(GAD)和GAL4 DNA结合结构域(GBD)的融合蛋白的相互作用的表达。而在含5-FOA的完全培养基中则受GAD和GBD融合蛋白相互作用的抑制。因此可通过筛选5-FOA抗性克隆从随机突变库中鉴定阻断蛋白相互作用的突变体。
 技术资料
技术资料暂无技术资料 索取技术资料