相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 提供商:
湖北佰莱博科技有限公司
- 服务名称:
蛋白质质量表征分析服务
- 规格:
1次
免纯化BLI技术:重组表达生物素化蛋白用于BLI生物分子互作实验
为解决传统生物膜干涉(BLI)技术中蛋白纯化步骤繁琐的问题,本方案采用Avi Tag位点特异性生物素化策略。该技术反应条件温和,特异性高,蛋白无需纯化,可通过生物素-链霉亲和素作用固定于传感器表面,从而极大提高BLI生物分子互作实验检测效率和速度。
1. 背景介绍
BLI(Biolayer Interferometry)生物膜干涉技术是一种高灵敏度的实时分析技术,常用于研究分子间相互作用、亲和力、结合动力学等。其基本原理是,仪器发射白光到传感器表面并收集反射光,光学参比层的反射光和传感器表面生物层的反射光发生干涉。当结合到传感器表面的分子厚度改变时,生物层反射光随之变化,导致干涉光谱位移(图1),从而反映分子间的相互作用。通过对分子结合过程的实时监测,系统可测定结合速率常数(ka或kon)和解离速率常数(kd或koff),并通过拟合计算分析得到分子间的平衡解离常数(KD)。
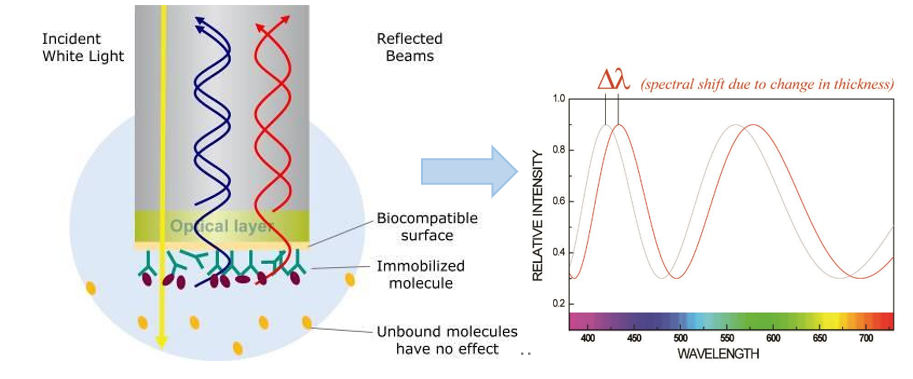
图1 BLI技术原理示意图
传统的BLI实验在验证蛋白-蛋白或者蛋白-小分子的相互作用时,通常是先将纯化的活性蛋白通过氨基偶联反应与生物素进行共价连接,再利用生物素和链霉亲和素的强亲和力固定在BLI探头上,随后进行相互作用的检测。
然而,蛋白的纯化步骤耗时繁琐,并且稳定性差的蛋白在纯化过程中可能发生降解或失活。因此,一种免纯化BLI实验方法应运而生,旨在简化操作流程,能极大提高检测效率和速度。
2. Avi Tag简介
Avi Tag是由15个氨基酸残基构成的短肽标签(GLNDIFEAQKIEWHE),其中的赖氨酸残基(K)是生物素连接酶(例如BirA)的识别位点,该位点在BirA酶的催化下能够特异性的共价连接一个生物素分子,实现位点特异性生物素化修饰。将目的蛋白与Avi Tag融合表达,既可在体内实现生物素化修饰,也可单独添加BirA酶在体外完成酶促修饰。由于Avi Tag只有15个氨基酸,结构精简,可以降低标签对目的蛋白的活性影响(图2)。
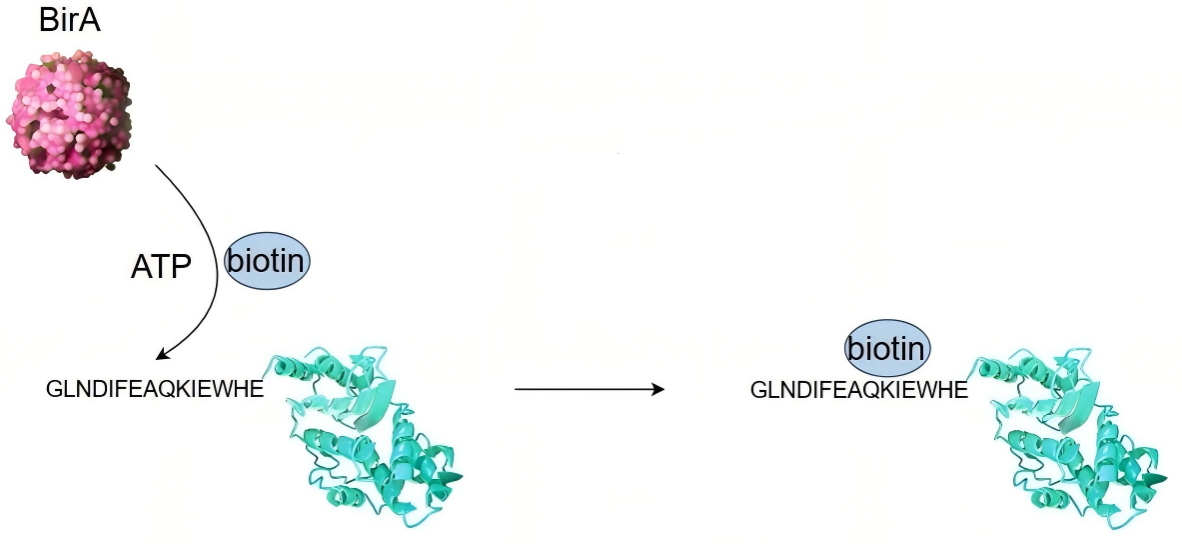
图2 BirA催化Avi Tag共价连接生物素示意图
体内生物素化:该方法需选用特殊的双表达载体(如pET-Dual-His-MCS-Avi-BirA)。在宿主细胞内共表达带有AviTag的目标蛋白和BirA酶,在诱导蛋白表达的阶段,向细胞培养基中添加生物素,即可实现蛋白同步表达与位点特异性生物素化,无需后续的体外酶促反应。
体外生物素化:将蛋白表达和生物素化分为两个独立步骤,首先,使用带AviTag标签的表达载体(如pET-His-MCS-Avi)在大肠杆菌(如DE3菌株)中诱导表达目标蛋白;随后裂解菌体、收集上清,并在体外反应体系中加入BirA酶与生物素,完成特异性生物素化修饰。
AviTag生物素化技术具有高度的通用性和灵活性,已广泛应用于多个主流的蛋白表达系统。包括原核表达系统(如大肠杆菌E. coli)、真核表达系统(如毕赤酵母 Pichia pastoris、酿酒酵母 S. cerevisiae)、昆虫细胞(如基于杆状病毒系统的Sf9和Hi5细胞)以及哺乳动物细胞(如HEK293、CHO、HeLa)。得益于BirA酶催化反应依赖的ATP和生物素在生物中普遍存在,该技术具有跨系统的普遍适用性。
3. 免纯化BLI服务基本流程(以原核表达为例)
1) 载体构建:合成目的蛋白的基因序列,插入到Avi Tag载体上(如pET-His-MCS-Avi或pET-Dual-His-MCS-Avi-BirA),构建并筛选重组质粒。
2) 蛋白表达:将重组质粒转化到大肠杆菌表达菌株(如DE3)进行蛋白表达;若使用双表达载体,则在诱导表达时同时加入生物素,即可在诱导目的蛋白表达的同时进行生物素化修饰。
3) 位点特异性生物素化:若使用单表达载体,则在裂解菌体、收集上清后,于体外体系中加入相应的BirA酶和生物素,完成目的蛋白的位点特异性生物素化修饰。若使用双表达载体,在蛋白表达阶段(见步骤2)即可完成生物素化修饰。
4) 去除游离生物素:通过凝胶过滤或者超滤的方式,去除未反应的游离生物素。
5) 生物素化蛋白固定在传感器上:将SA传感器用PBS进行平衡,然后加入生物素化的蛋白,使蛋白通过生物素-链霉亲和素的相互作用进行固定,用PBS缓冲液洗涤,洗去未结合的或非特异性吸附的蛋白。
6) BLI检测: 上样梯度稀释的分析物样品,进行BLI检测。
下图展示了基于Avi Tag的免纯化BLI实验流程(图3)。

图3 免纯化BLI实验流程
4. 案例分享:免纯化BLI技术测定蛋白与蛋白结合亲和力
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验时间和慢解离速率的测量,最小化非特异性结合。 生物膜干涉 BLI 生物膜干涉技术(Bio-Layer Interferometry, BLI), 是一种无标记(Label-free)光学生物传感技术,用于实时监测分析生物分子相互作用(例如抗原-抗体相互作用),并对其结合强度和动力学进行量化分析。与 SPR 技术不同的是, BLI 技术中不使用金属芯片,而是利用生物传感器。将配体偶联在传感器的末端,浸入样品中来捕获分析物。 图 14:BLI传感器与 Strep-Tactin®XT 相结合,特异
基因 Akaluc 用于追踪胶质瘤的体内生长、侵袭和转移过程[3] 使用非侵入性生物发光成像(BLI)对肿瘤生长进行纵向追踪是研究体内癌症模型的关键方法。Akaluciferase(Akaluc)是一种新的 BLI 系统,其信号强度高于标准的萤火虫荧光素酶(Fluc)。本文设计了一种慢病毒载体,用于在胶质瘤细胞系中表达 Akaluc,追踪胶质瘤的体内扩张过程。 实验设计和主要研究结果: Akaluc 和 Fluc 报告基因的设计和灵敏度比较。用表达 Venus-Akaluc 或 Venus-Fluc
后将其移除。 纯化原理 Strep标签纯化蛋白质的技术原理,是利用自然界中最强的非共价作用之一:生物素(biotin)和链霉亲和素(streptavidin)之间的相互作用。将链霉亲和素改进后,就得到了非常稳定的Strep-Tactin®。Strep-Tactin®同样也是一种蛋白质,能高效且可逆的结合短肽标签Strep-tag®,而且它保留了结合生物素的能力。当生物素加入时,会作为特异性的竞争剂,用于洗脱Strep-tag®标签蛋白。 标签-配体 搭配Strep标签进行蛋白纯化的配体有2种
 技术资料
技术资料暂无技术资料 索取技术资料









