相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
艾迪基因
- 服务名称:
基因编辑服务
- 规格:
株
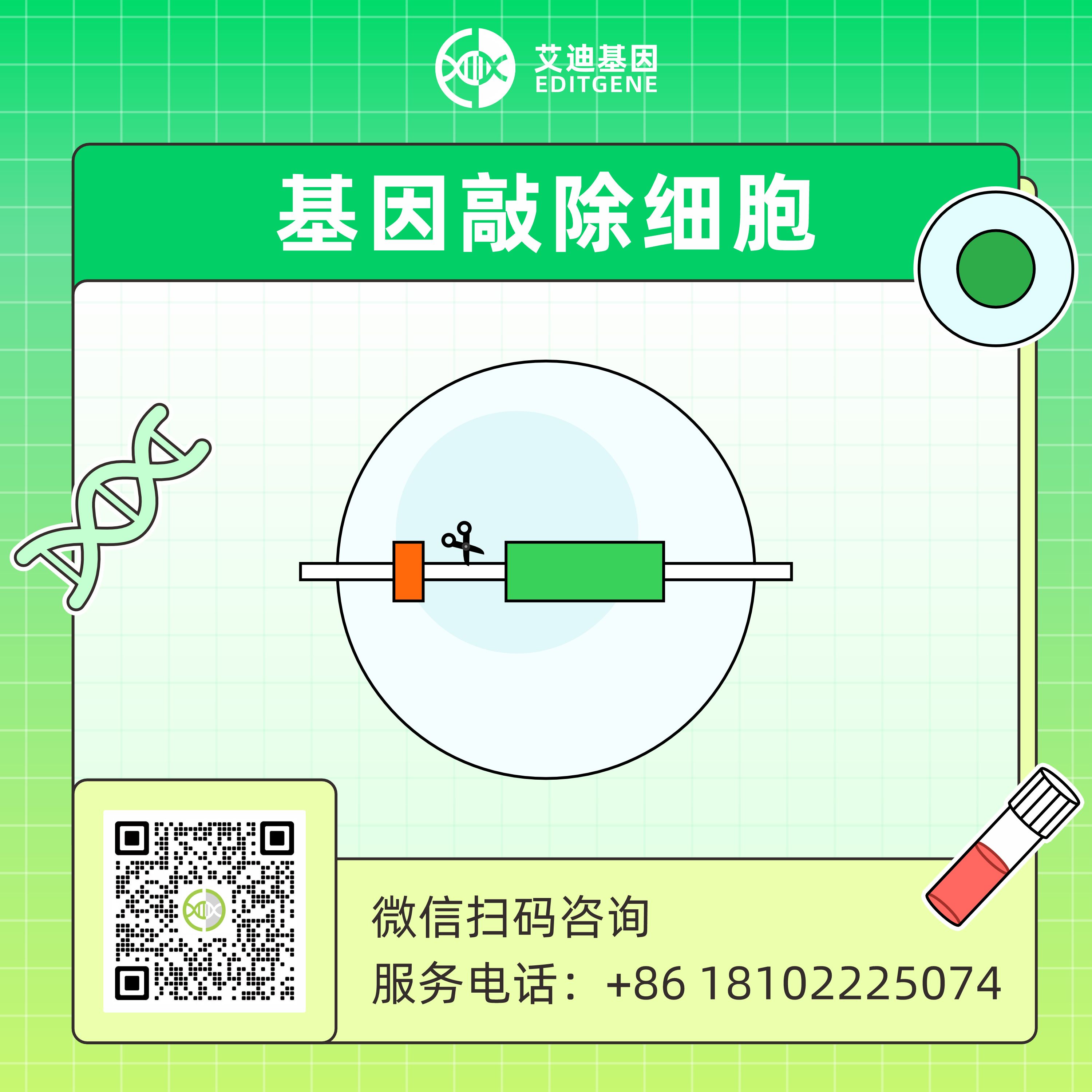
基因敲除细胞是应用基因敲除技术,可精准地去除或失活特定基因。构建基因敲除的细胞模型,可揭示基因在生物体中的功能,并在药物靶点筛选、药物开发等领域有广泛的应用。现有的基因编辑工具有CRISPR/Cas9、TALENs或ZFNs等。目前,CRISPR/Cas9系统因其高效性和操作便捷性,已成为基因敲除的首要选择工具。该系统通过gRNA引导Cas9核酸酶,对目标DNA进行特异性的识别和切割,产生DNA双链断裂(DSB)。随后,细胞通过非同源末端连接(NHEJ)途径修复这些双链断裂。在修复过程中,常常会产生非三倍数的插入或缺失(indel),导致移码突变,进而实现基因敲除。
艾迪基因基于自主研发的CRISPR-EDITx基因编辑平台,采用优化升级的CRISPR/Cas9系统,可根据基因与细胞、实验目的,制定合适的敲除策略和方案,可高效地构建符合需求的基因敲除细胞模型。
| 细胞类型 | 各种细胞类型,包括肿瘤、常规、干细胞、原代和永生化细胞系 |
|---|---|
| 服务类型 | 单基因敲除/多基因敲除/移码突变/片段敲除 |
| 交付标准 | 基因敲除单克隆细胞≥1株(2管细胞/株,1×106/管);项目结题报告 |
| 周期 | 现货1周 (查看现货);定制快至4周 |
| 价格 | 4980元起 ;具体可来电咨询18102225074 |
| 单基因敲除 | 实现单个基因的有效敲除 |
|---|---|
| 多基因敲除 | 实现多个基因的有效敲除 |
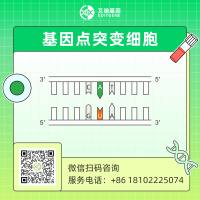
| 移码突变 | 针对编码基因的编码区前端设计sgRNA,实现碱基非3的倍数的indel |
| 片段敲除 | 针对基因设计sgRNA,实现基因片段的删除 |
(2)项目结题报告包含sgRNA序列、实验详细记录、测序结果及分析等,满足客户后期论证材料需求。
(3)基因敲除阳性单克隆均经过靶标片段T载体克隆测序验证,保证基因敲除。

| 细胞 | 基因名 (ID) | Cell pool敲除率 |
| MH-S | Sirt2 (64383) | ★★★★★ |
| HEPG2 | MAP1S (55201) | ★★★★★ |
| BHK-21 | TMEM41b (101842799) | ★★★★★ |
| KGN | TFE3 (7030) | ★★★★★ |
| LLC | CILP (214425) | ★★★★★ |
| MDA-MB-231 | OLFML2A (169611) | ★★★★★ |
| ID8 | DUSP1 (19252) | ★★★★★ |
| HmrSv5 | FN1 (2335) | ★★★★★ |
| huh7 | EGFL9 (65989) | ★★★★★ |
| MKN28 | TRIM54 (57159) | ★★★★★ |
| MB49 | STUB1 (56424) | ★★★★★ |
| hela | TRAPPC2(6399) | ★★★★★ |
| L929 | RIPK1(19766) | ★★★★★ |
| Bv2 | PKM(18746) | ★★★★★ |
| caco-2 | PEPT1(6564) | ★★★★★ |
| MOC2 | Itga5(16402) | ★★★★★ |
| PC3 | HJURP(55355) | ★★★★★ |
| CFSC-8B | Rock2 (25537) | ★★★★★ |
| HT22 | DJ-1 | ★★★★★ |
| A549 | PKM1(5315) | ★★★★★ |
| kupffer | sirt6(50721) | ★★★★★ |
| HBMEC | S100A6(6277) | ★★★★★ |
| Mia PaCa-2 | MMP1(4312) | ★★★★★ |
| HLE B3 | PXDN | ★★★★★ |
| HepG2/Dox | PIK3CA(5290) | ★★★★★ |
| HEK293 | DDR1(780) | ★★★★★ |
| RPE1 hTERT p53-/- Cell | BMF(90427) | ★★★★★ |
| HEK293T | WTAP(9589) | ★★★★★ |
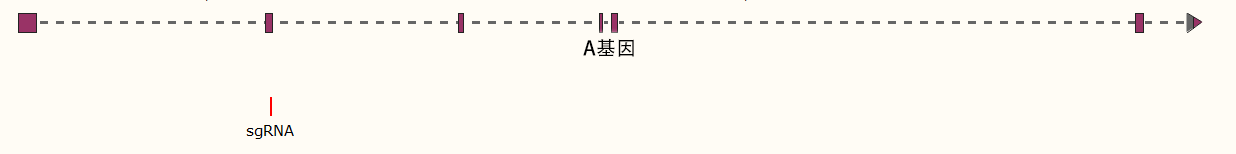

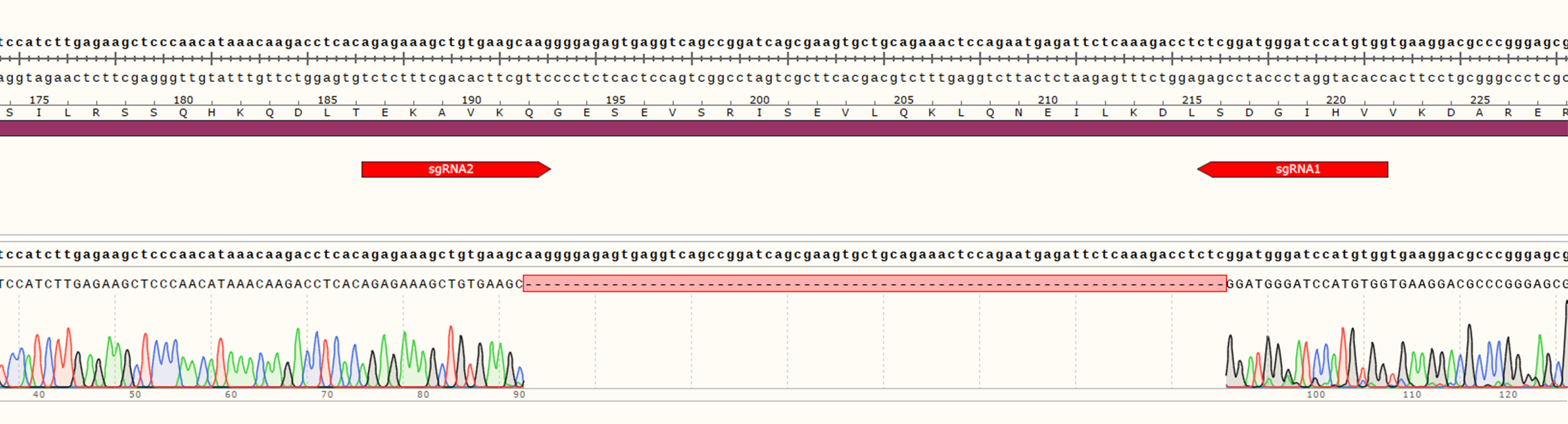
1、研究目的:在THP-1细胞中实现双基因敲除
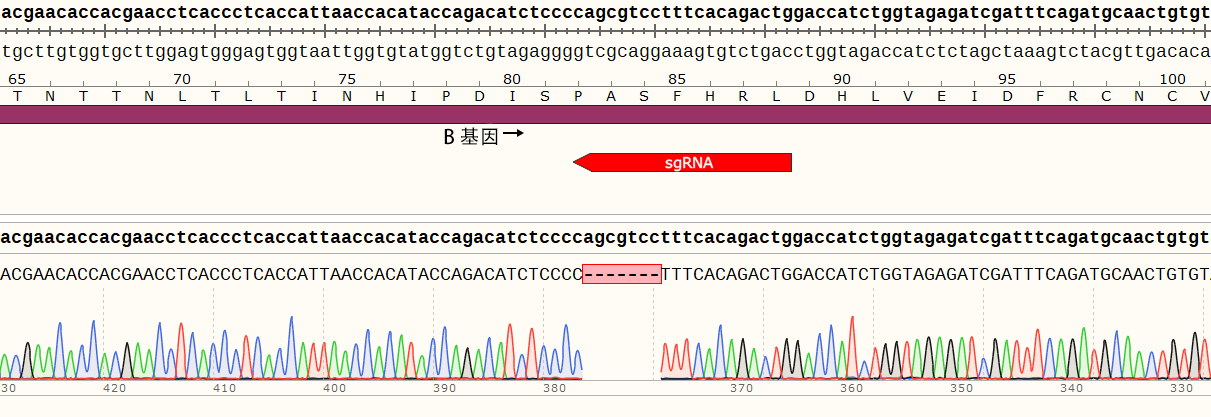
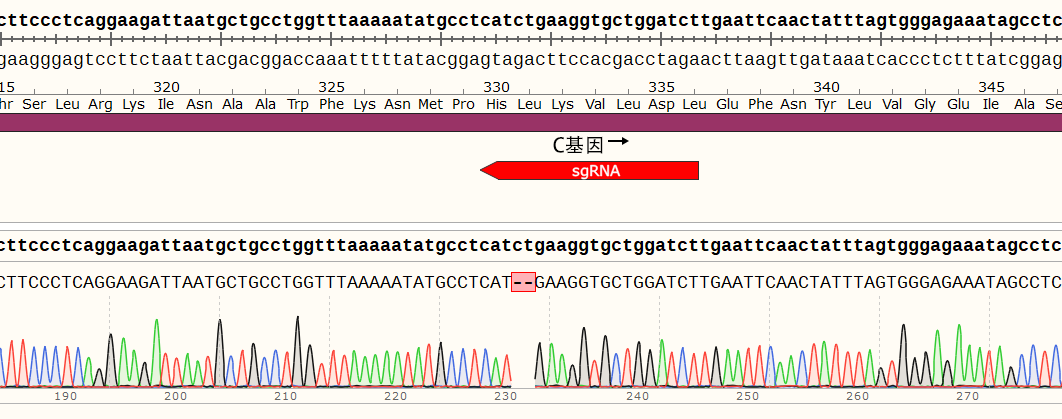
2、项目目标:成功在THP-1细胞中同时敲除B基因和C基因,从而开展基因相互作用及代偿机制的研究。
3、项目设计:在B基因外显子区域设计2个sgRNA,C基因外显子区域设计2个sgRNA。
▍ 案例分析
一、抗生素敏感浓度摸索
将细胞如下图1稀释。给药7天后,弃培养液,用台盼蓝染色2 min,显微镜下观察细胞存活情况。确定细胞多克隆细胞筛选和单克隆细胞筛选浓度。

图1 抗性浓度摸索
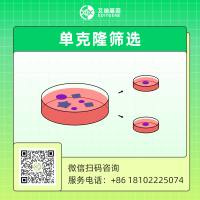
二、单克隆形成验证
细胞计数,将细胞悬液稀释混匀后加入96孔板,用封口胶将孔板封好,放于培养箱中培养。静置培养48 h后每日观察并记录单克隆形成情况。
三、靶标基因sgRNA 设计
根据基因序列信息,设计 sgRNA。
四、位点序列信息确认
PCR扩增(图2),测序验证基因序列,以确定sgRNA区域有无SNP。
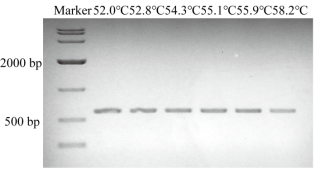
图2 靶标序列扩增
五、敲除载体构建
退火,连接,转化,涂板(LB/Amp)培养。
每个实验组各挑取6个单克隆菌落,于LB/ Amp培养基中扩增,提取质粒,琼脂糖凝胶电泳检测质粒提取效果(图3)。
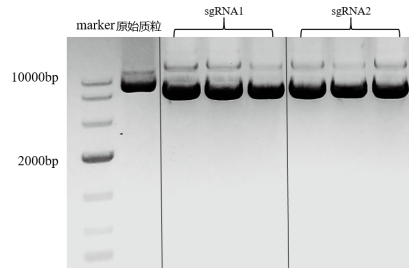
图3 质粒抽提
酶切验证 :取3个单克隆酶切,琼脂糖凝胶电泳检测酶切效果(图4)。选择2个样品送样测序。
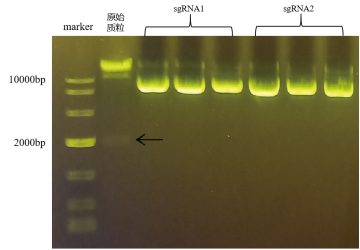
图4 单克隆酶切验证
六、慢病毒包装
敲除载体无内毒素质粒提取,病毒包装。
七、细胞转染
配制梯度病毒稀释液,细胞于培养箱中静置培养48h。
八、阳性多克隆细胞株筛选
九、阳性单克隆细胞株筛选
细胞转染48h后,更换完全培养基,筛选至对照组大部分细胞死亡,实验组细胞扩大培养,进行单克隆筛选。几天后挑选阳性单克隆进行扩增,并取样验证。
十、阳性单克隆细胞株验证
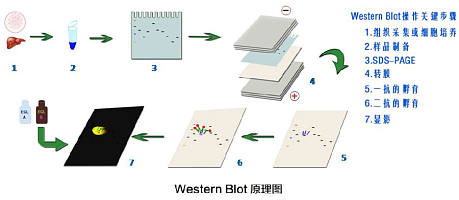
1、测序验证
提取阳性单克隆细胞株的基因组,将靶标基因酶切克隆至T载体后测序,以确定是否敲除成功。
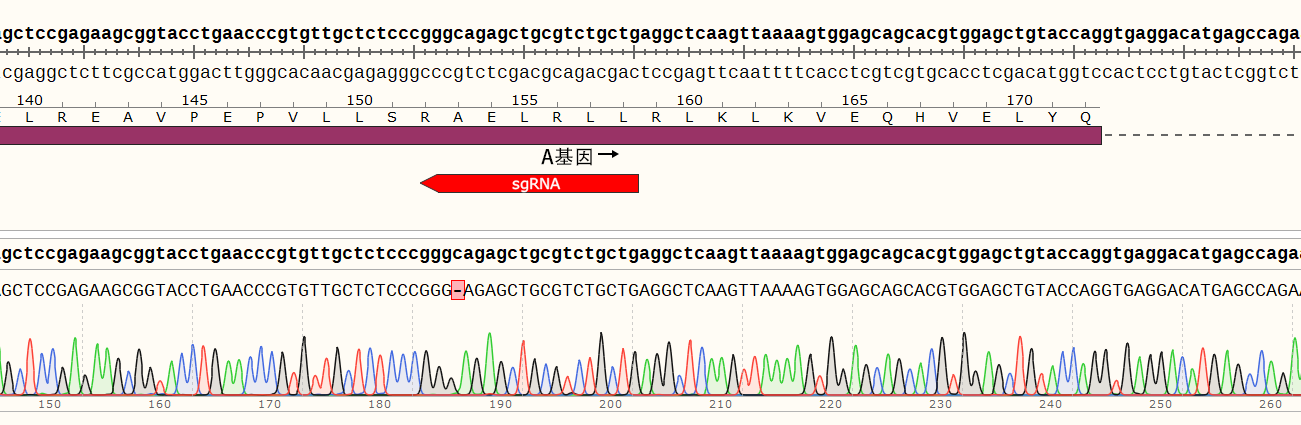
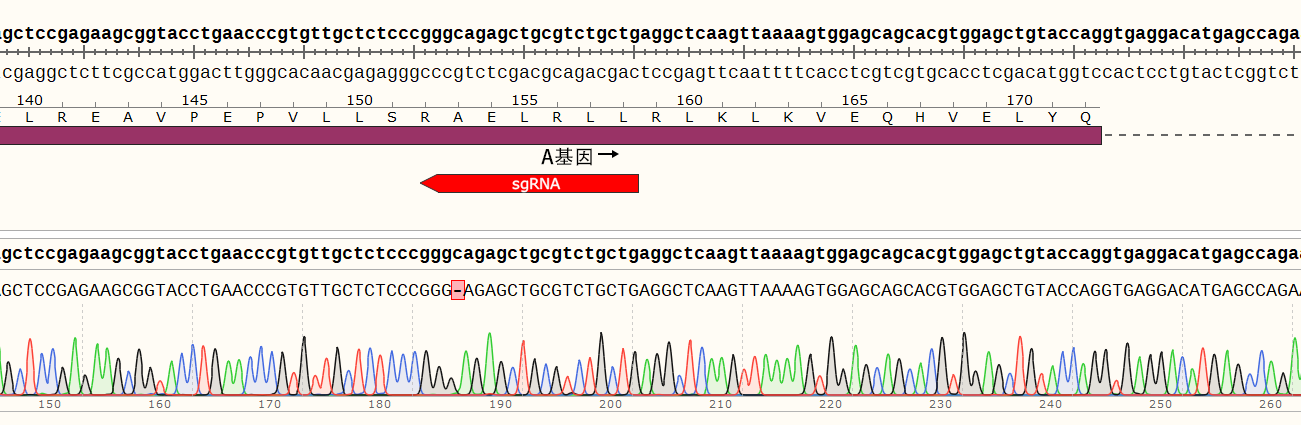
结果示例:该基因有两个单克隆细胞株,A1和A2。
(1)单克隆细胞A1的目的基因在sgRNA2位置出现两种突变形式,分别缺失1个和19个碱基,在新序列的第337位和第355位碱基提前出现终止密码子。
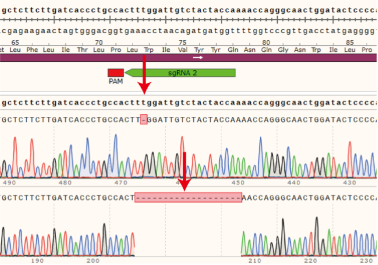
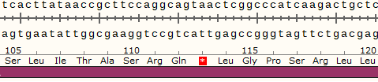
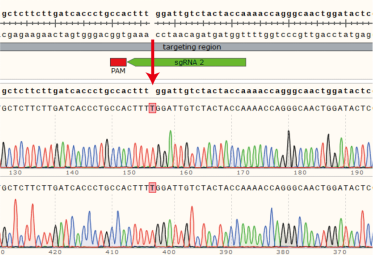
(2)单克隆细胞A2的目的基因在sgRNA2位置发生突变,插入1个碱基,在新序列的第340位碱基提前出现终止密码子。

风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验动物模型是现代生命科学研究的重要工具,特别是基因工程小鼠和大鼠,在基因功能研究、人类生理病理机制研究及新药研发中起着不可替代的作用。近几年来,制备动物模型的基因修饰技术层出不穷,这不仅包括传统 ES 打靶、TALEN、CRISPR/Cas9, 还有 TetraOneTM 基因敲除新技术。如此繁多的技术该如何选择?本文将对这四种技术的原理、特点、缺陷及未来发展趋势作系统的介绍和对比。 1、 传统 ES 打靶基因敲除——成熟、修饰准确、效果稳定,但制作周期长达一年 基于胚胎
近年来,ZFN、TALEN、CRISPR/Cas9等基因组编辑技术可谓是层出不穷,尤其是CRISPR/Cas9,一出现便在全球范围内掀起一股热潮。同时,各大公司也开发出一系列相应的产品,其中一种至关重要的就是基因敲除阳性克隆筛选的试剂。 目前用的比较多的有CEL I酶,CEL I是植物来源的一种特异性识别碱基错配的酶,活性高,不会产生假阳性。而且CEL I酶是目前生物界发现的唯一能准确切割异源双链DNA中存在错配位点的酶,在遗传学研究和应用领域中扮演重要的角色,多应用在临床诊断领域
手把手教你利用 CRISPR-Cas9 系统精准敲除靶标基因
一、CRISPR-Cas 系统简介图 1 CRISPR-Cas9 系统介绍CRISPR-Cas9 系统是一种被广泛运用的基因组编辑工具,它来源于细菌的适应性免疫系统。CRISPR-Cas9 系统包括:Cas9 酶和一个向导 RNA。 向导 RNA 作用是引导 cas9 到基因组的特异性位点上切割。如图 1 所示。目前为止,CRISPR-Cas9 系统主要有两方面应用: 基因敲除和基因敲入。基因敲除时, 一旦 DNA 的双链断裂反应(DSB)被 Cas9 切割诱导发生, 细胞会启动 NHEJ