相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 提供商:
艾迪基因
- 服务名称:
基因编辑服务
- 规格:
株
▍ 服务详情
| 细胞类型 | 各种细胞类型,包括肿瘤、常规、干细胞、原代和永生化细胞系 |
|---|---|
| 服务类型 | 模型构建/基因治疗方向的点突变效率验证 |
| 交付标准 | 基因点突变单克隆细胞≥1株(2管细胞/株,1×106/管) |
| 周期 | 现货1周 (查看现货);定制快至8周 |
| 价格 | 16800元起 ;具体可来电咨询18102225074 |
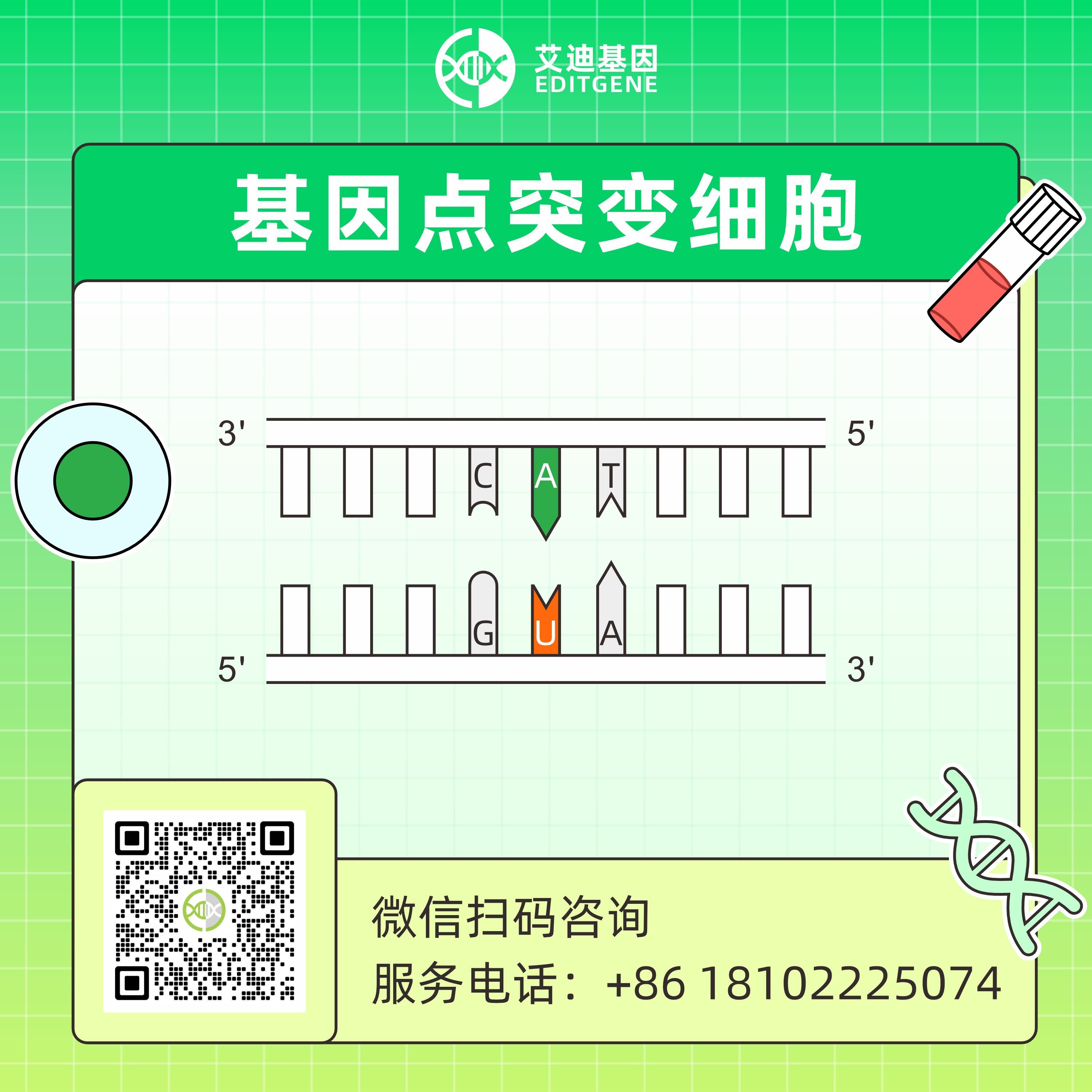
▍ 基因点突变介绍
人类超过75,000种疾病与遗传变异相关,其中单碱基突变占主要类型。构建基因点突变细胞株在疾病检测、研究与治疗中具有巨大潜力,例如点突变细胞株可用于神经退行性疾病机制研究、小分子药物研发、肿瘤及遗传病诊断等。曾被寄予厚望的CRISPR-Cas9基因编辑技术,因脱靶效应及DNA双链断裂引发的副产物(如染色体易位、大片段缺失)等问题,限制了其在基因治疗中的应用。而无需双链断裂的碱基编辑技术(Base Editing)仅能实现4种单碱基转换(C→T、G→A、A→G、T→C),无法完成其余8种颠换编辑(C→A、C→G、G→C、G→T、A→C、A→T、T→A、T→G)。
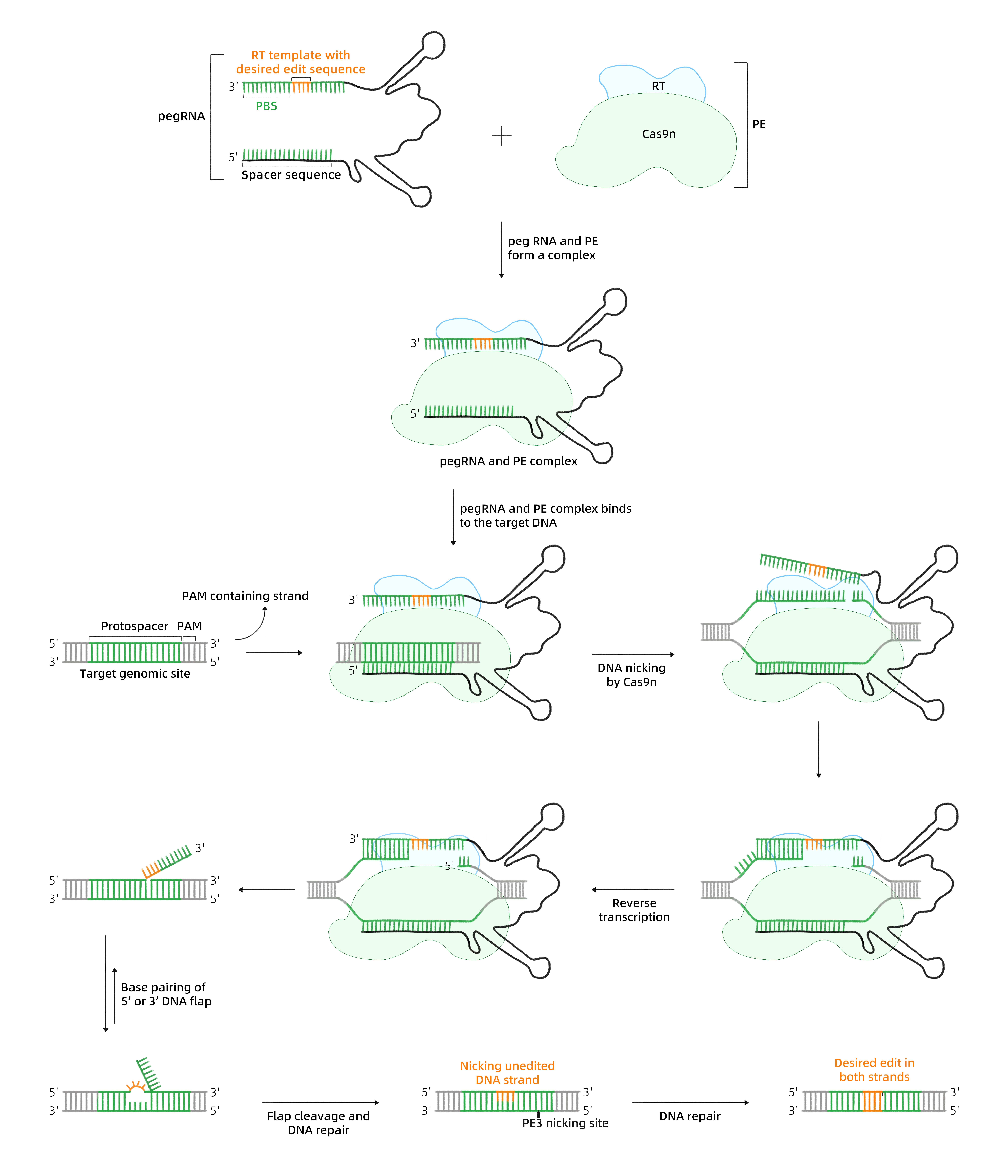
先导编辑系统(Prime Editing)通过融合Cas9切口酶与逆转录酶,结合特殊设计的gRNA(prime editing guide RNA),实现精准且通用的基因编辑。
艾迪基因基于先导编辑PE (Prime Editing)技术全新研发的 Bingo™ 平台 ,可提供精准、高效的基因定点突变细胞定制服务。依托十多年基因编辑经验,在上千例基因编辑CRO项目经验中总结、优化、提升,成功率远超传统基因定点突变HDR系统。
Prime Editing的技术原理:利用一种融合了逆转录酶的Cas9 nickase(Cas9n-RT)和一种特殊的引导RNA——pegRNA,这种RNA不仅指导编辑酶到达目标DNA序列,还携带了需要插入或替换的遗传信息。在pegRNA的指导下,Cas9n-RT在目标DNA上产生一个单链切口,然后逆转录酶使用pegRNA作为模板合成新的DNA序列,从而实现精准的单碱基替换或小片段的插入和删除,而不需要双链DNA断裂,提高了编辑的精确性和安全性。
▍服务优势

▍ 服务类型
可根据客户需求、综合基因等情况,为客户设计点突变方案。
| 1 | 点突变细胞株模型构建 |
|---|---|
| 2 | 基因治疗方向应用的pegRNA效率验证 |
| 3 | 作为IVD用的生物来源标准DNA的原料 |
▍ 服务流程
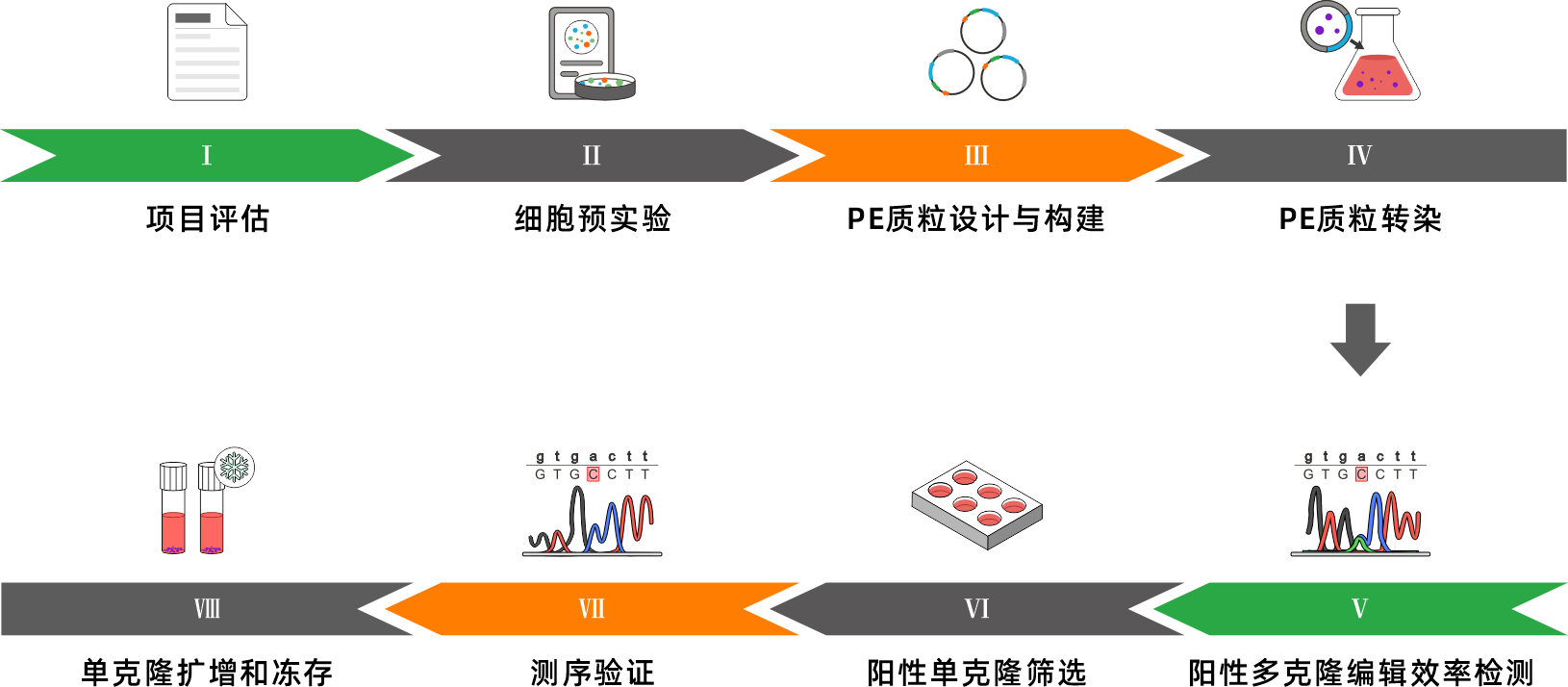
▍ 点突变细胞系

▍ Bingo™ 7 的技术优势
艾迪基因对基于prime editing技术开发的Bingo™ 平台进行迭代升级,正式推出Bingo™ 7,具有更高的编辑效率。
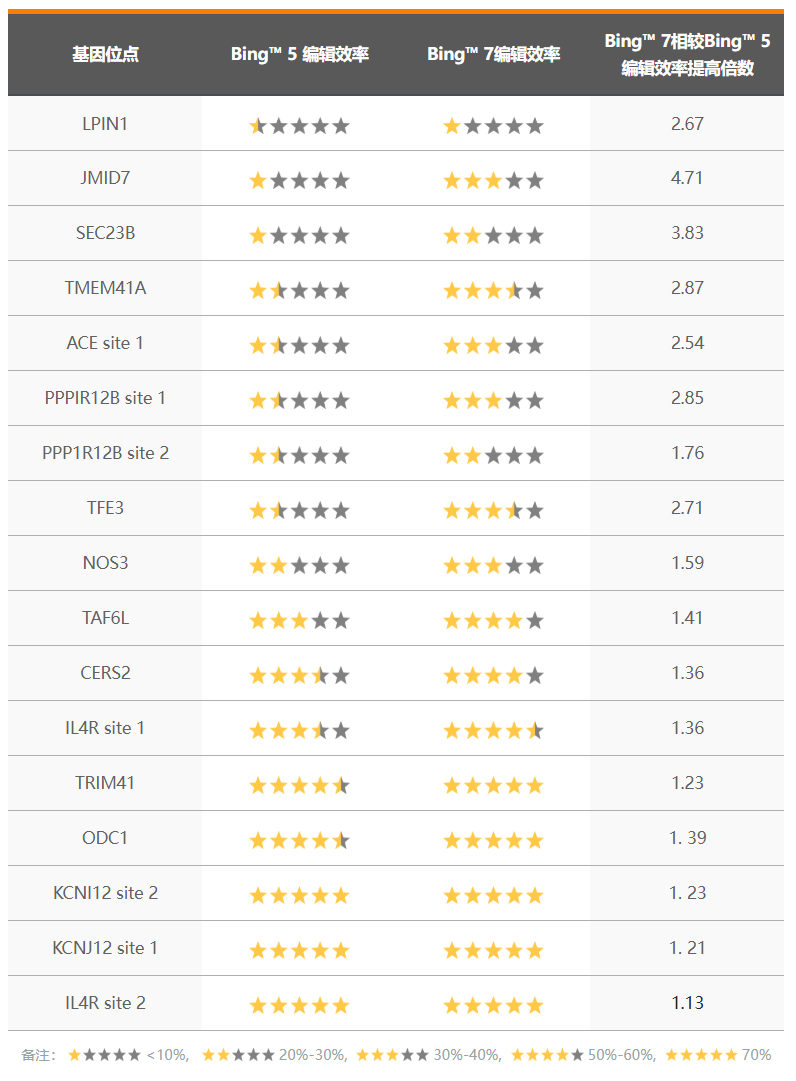
1)相较于Bingo™ 5,成功率提高4.71倍
Bingo™ 7优化了PE蛋白系统,增加了与RNA结合的活性,从而了增加编辑效率。我们在多个编辑位点进行测试,相较于Bingo™ 5,成功率提高了1倍以上,最高可达4.71倍。这意味着更加高效、低成本地提供符合您实验需求的细胞模型。
与 Bingo™5 相比,Bingo™7 的编辑效率有所提高
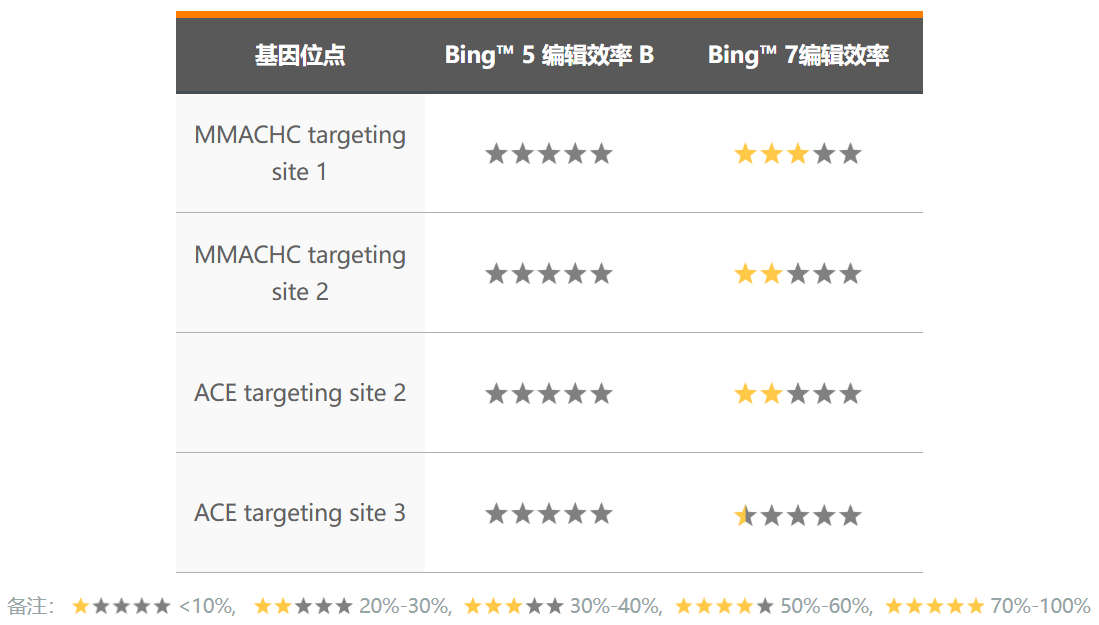
2)在挑战性位点实现有效的编辑
Bingo™ 7高效的编辑效率,使那些挑战性的位点有了编辑的可能。我们对多个难以编辑的位点,分别使用Bingo™ 7和Bingo™ 5系统进行测试,结果显示Bingo™ 7可以对这些位点实现有效的编辑。这意着以前难以编辑的任务变得可行,为突破性研究创造了可能。
Bingo™5 编辑失败 Bingo™7 编辑成功的位点
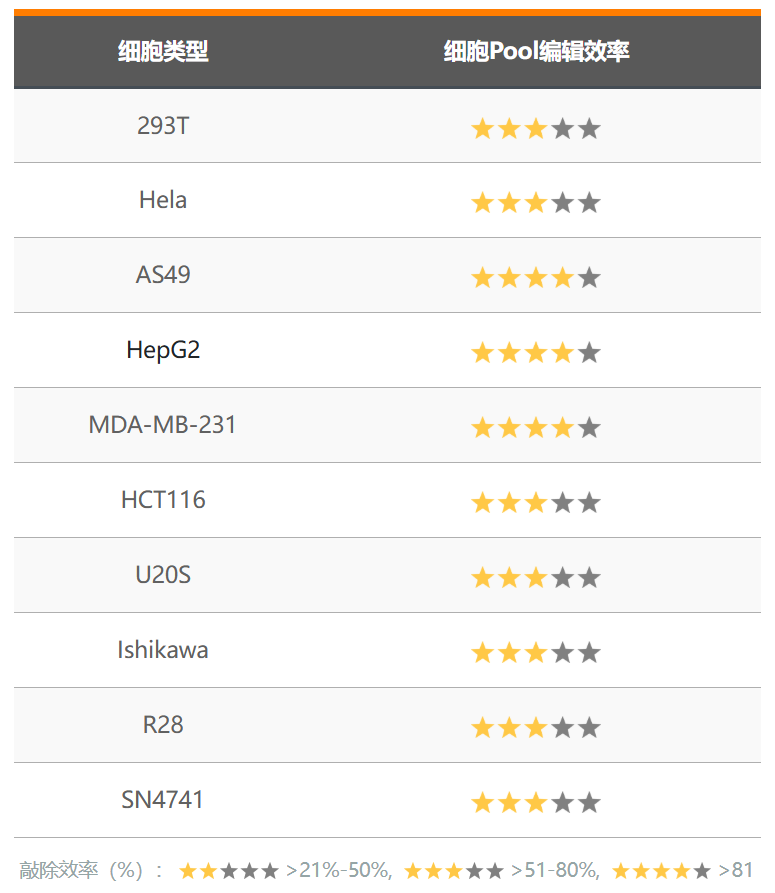
3)部分定点突变细胞Pool编辑效率
▍ 成功案例
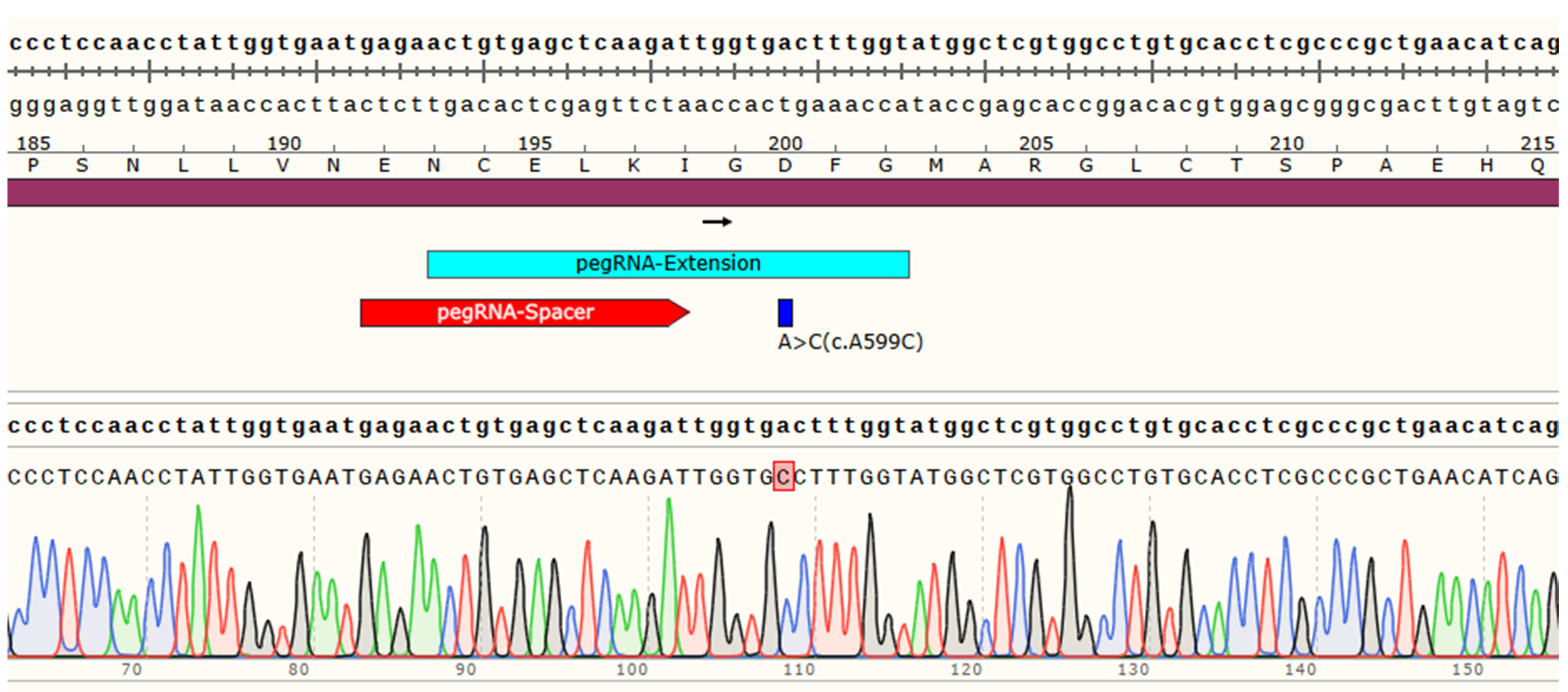
一、Ishikawa细胞MAPK7基因点突变(c.A599C)细胞株构建
1)项目信息

2)Bingo™PE系统质粒设计
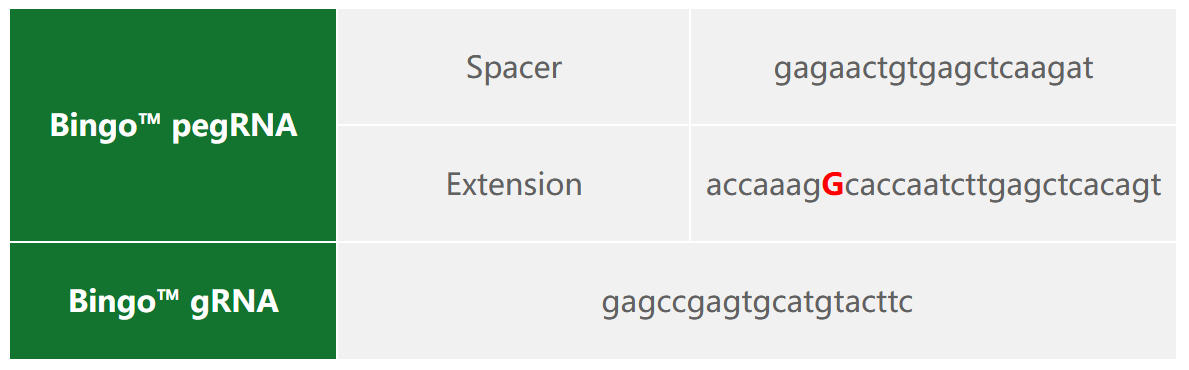
3)多克隆编辑效率
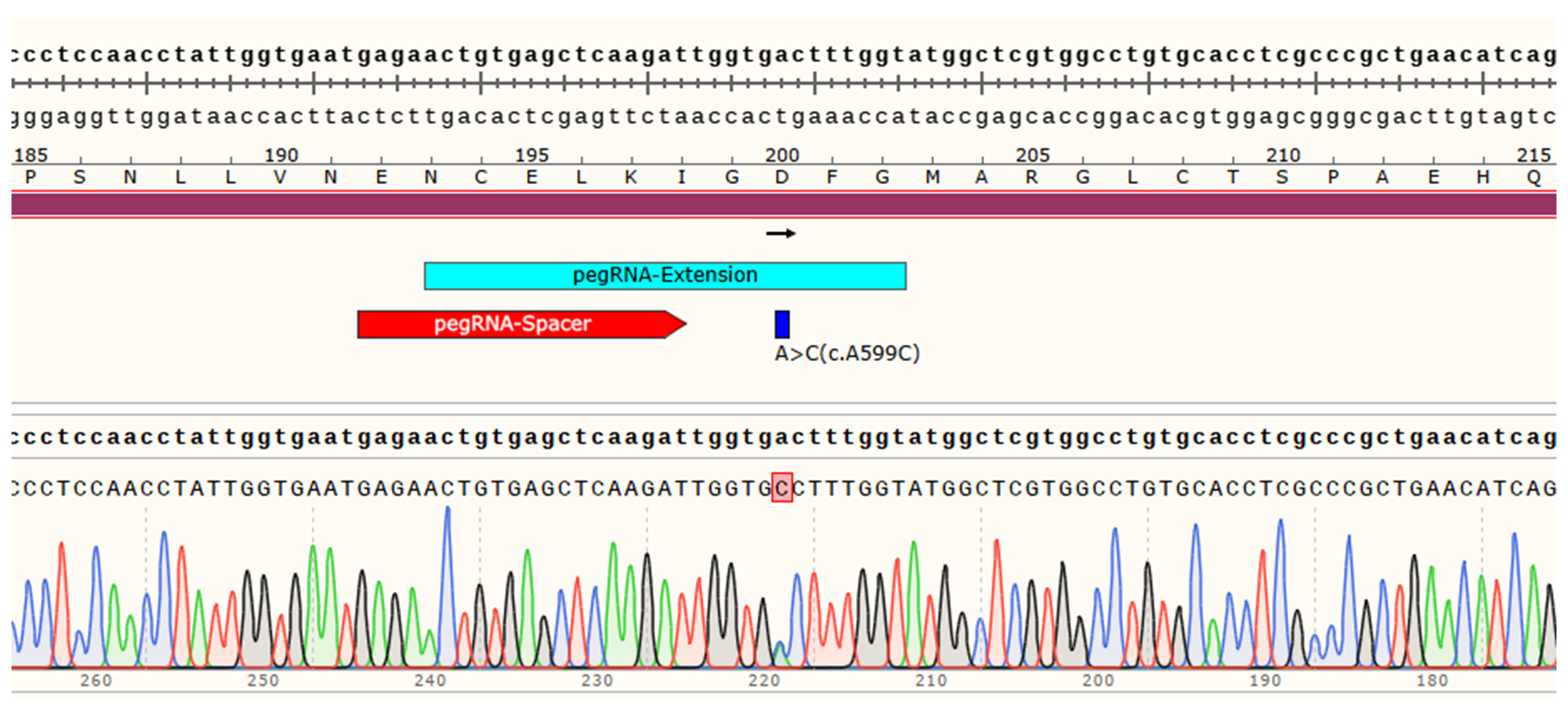
4)单克隆测序验证
二、Hela细胞HSPD1基因点突变(c.A391G)细胞株构建
1)项目信息

2)Bingo™PE系统质粒设计
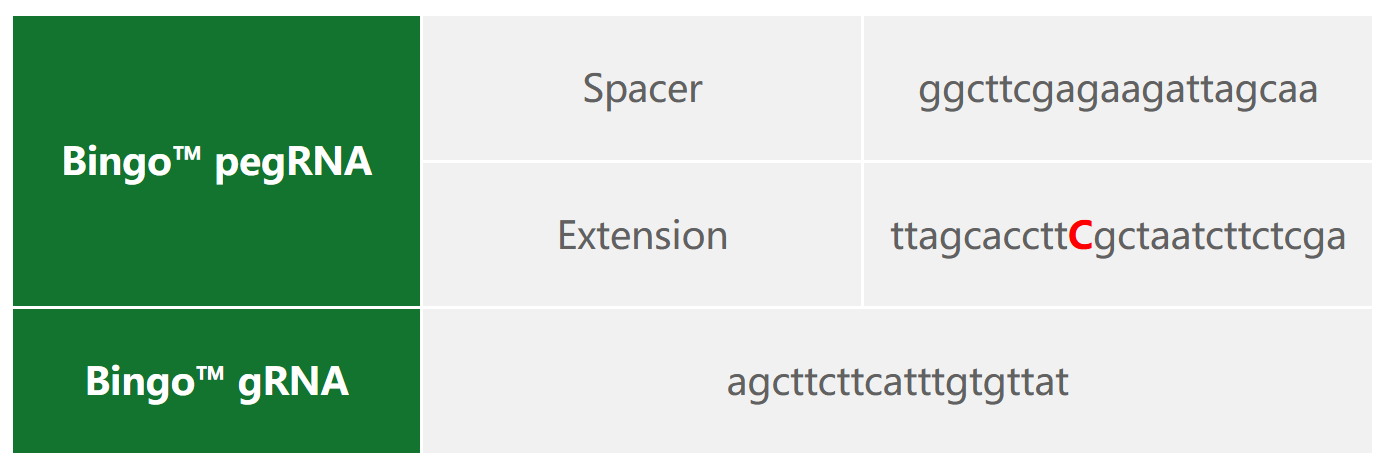
3)编辑效率检测
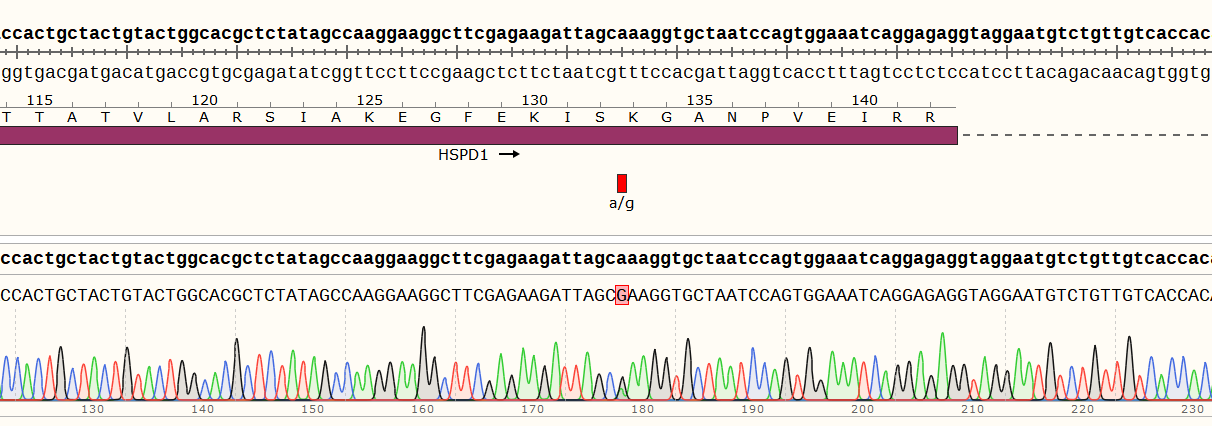
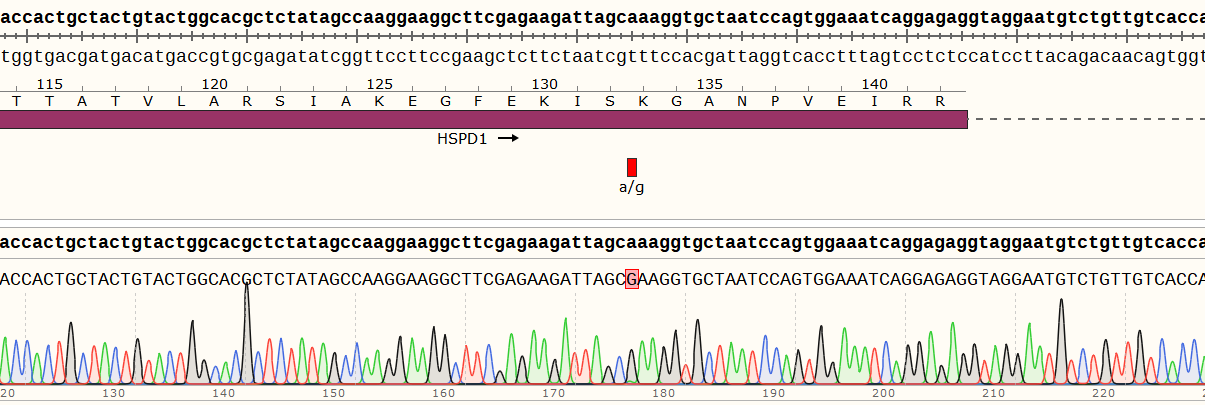
1)项目信息

3)编辑效率检测
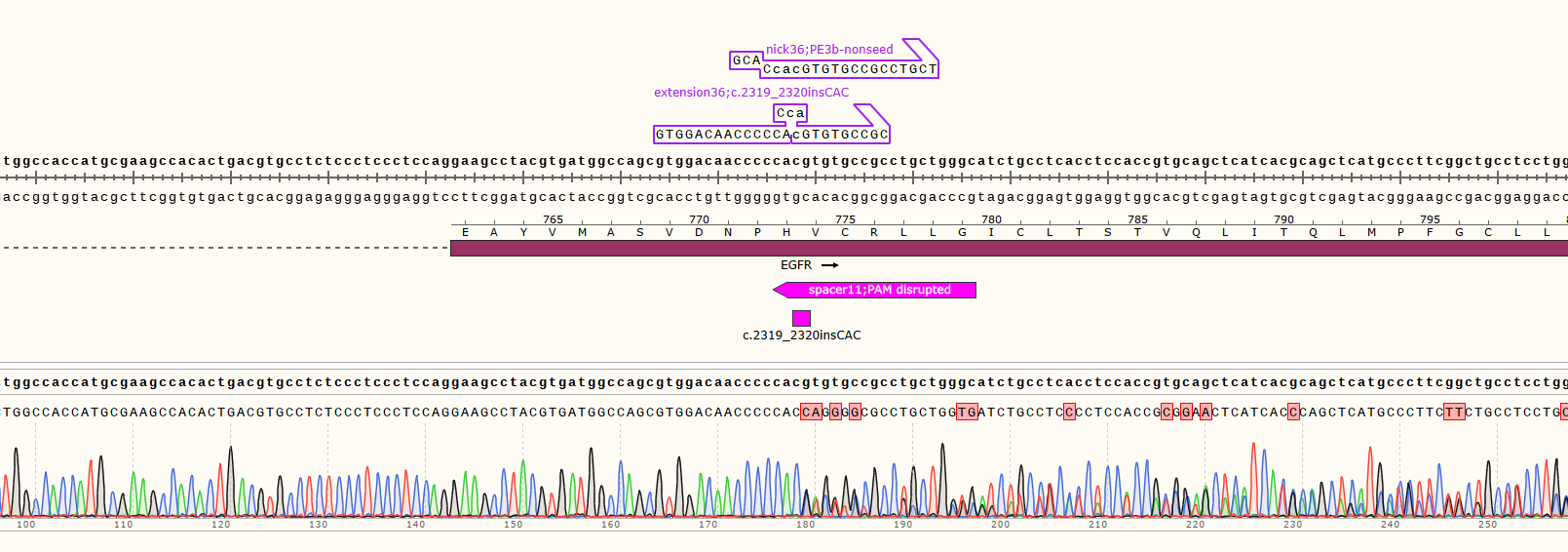
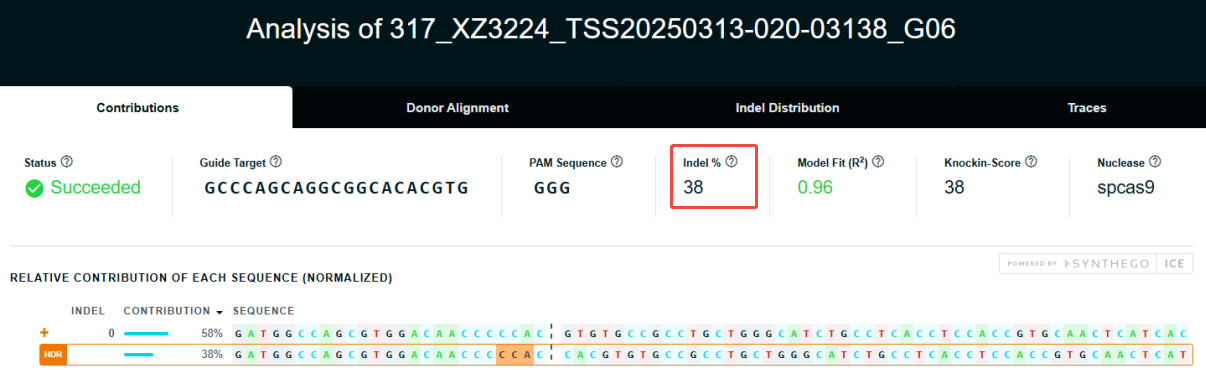
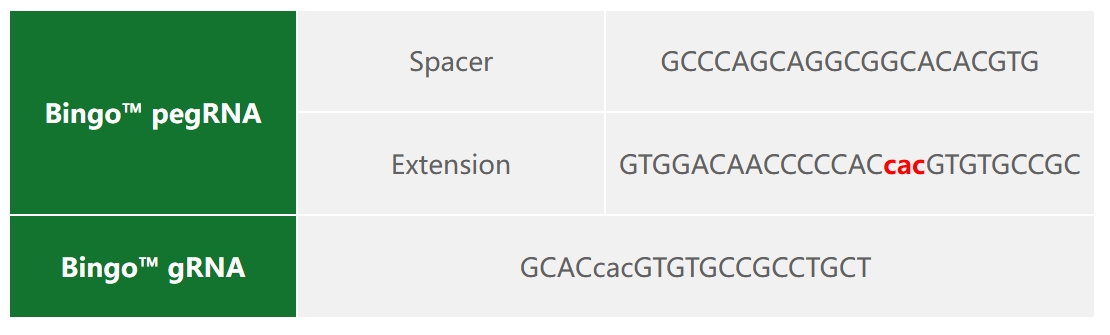
1)项目信息

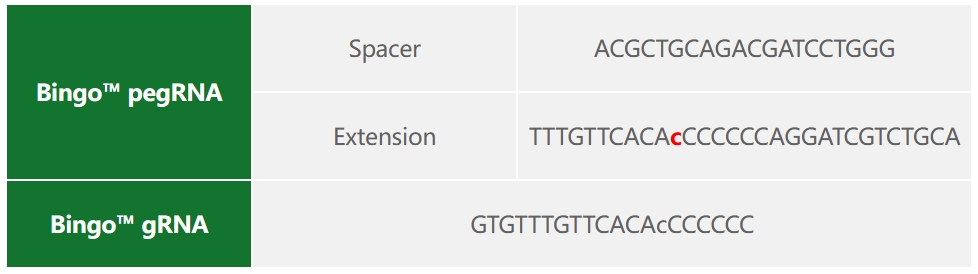
2)Bingo™ PE系统质粒设计
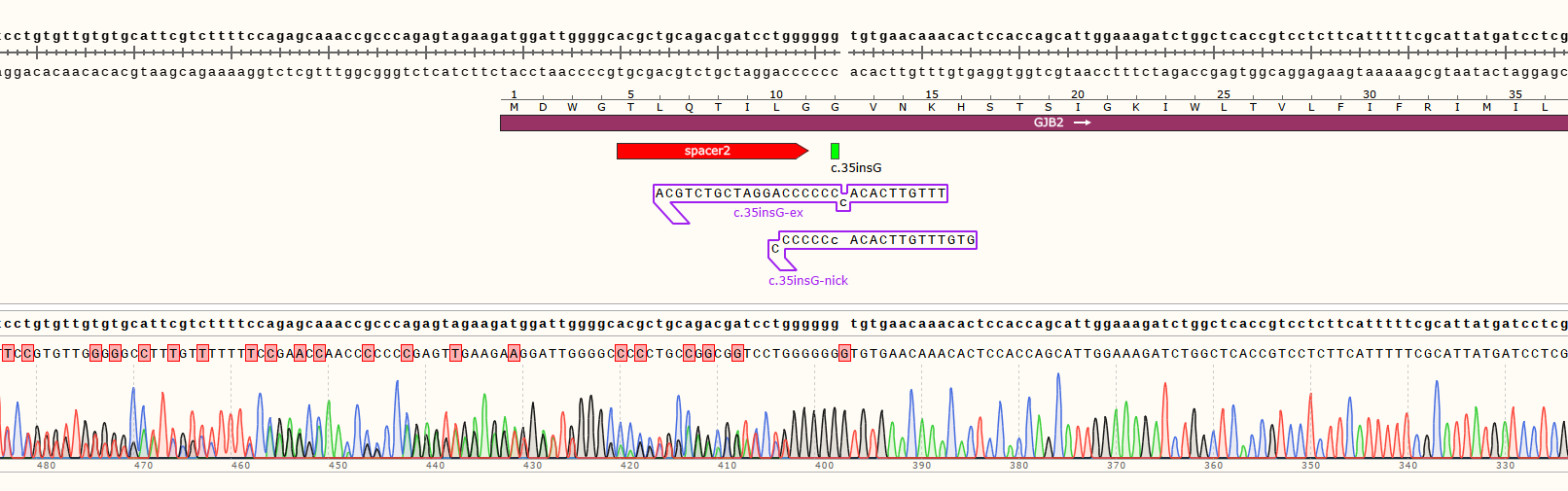
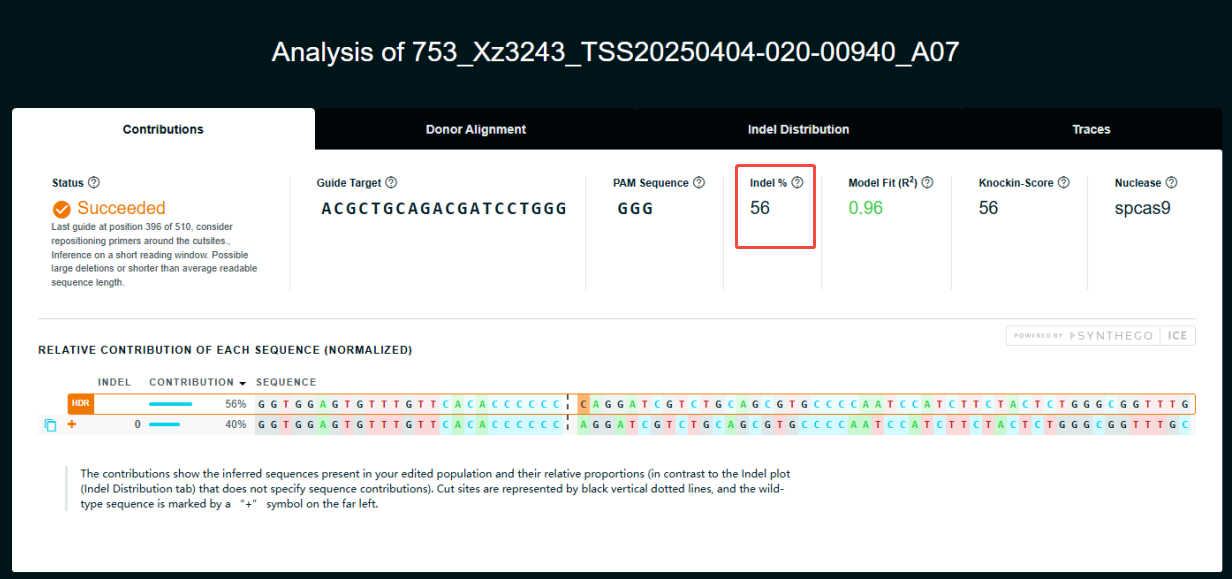
3)编辑效率检测
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验▍ 参考文献
 技术资料
技术资料暂无技术资料 索取技术资料