IF 40.4:陆军军医大学发表 CAR-MSCs 细胞治疗策略
2025-11-09 18:00点击次数:166
关键词:2025 年 10 月 27 日,陆军军医大学团队在 Journal of Hematology & Oncology 发表综述「Recent advances in CAR-MSCs: the new engine of cellular immunotherapy evolution」,系统阐述嵌合抗原受体修饰间充质干细胞(CAR-MSCs)技术。该技术融合 CAR 的靶向精准性与 MSCs 的免疫调节/组织修复双功能,为癌症及免疫相关疾病提供创新治疗策略。

当前 CAR-T 疗法虽在血液肿瘤中成效显著,却受限于免疫原性、毒副作用及实体瘤渗透障碍。为此,研究者转向间充质干细胞(MSCs)—— 其独特的归巢能力、低免疫原性及多向分化潜能,为突破现有瓶颈提供新路径。通过整合 CAR 技术,构建的 CAR-MSCs 既能精准识别病灶,又可重塑免疫微环境,进而拓展细胞治疗在实体瘤与自身免疫病中的应用疆界。
一、CAR 工程现状
CAR 技术历经三十年迭代,其发展呈现清晰的「问题-突破」逻辑:
早期第一代 CAR 因仅含 CD3ζ 激活域,导致 T 细胞扩增不足而被淘汰;
第二代引入共刺激域(CD28/4-1BB),成为当前所有获批疗法的核心设计;
第三代尝试叠加双共刺激域,却因临床结果异质性及 CRS 风险增加受限;
第四代 CAR(TRUCK)通过分泌 IL-12 等因子,实现靶向杀伤与微环境重塑的双重跃迁;
当前第五代聚焦 CAR 信号与细胞因子通路(如 JAK-STAT)耦合,仍处探索阶段。
整体而言,CAR 演进史是从基础激活信号向多功能集成的跨越。
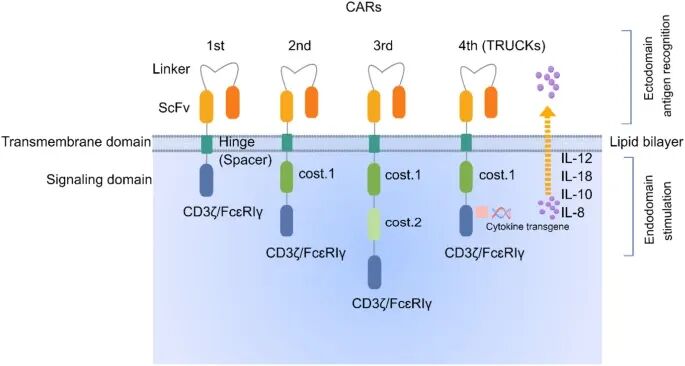
图 1:CAR 技术的迭代
二、间充质干细胞的生物学特性
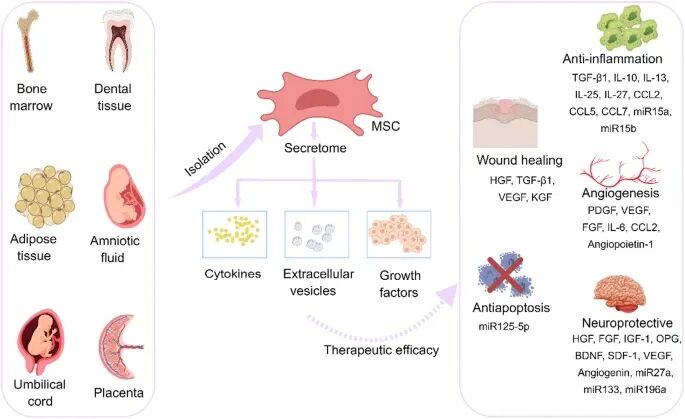
间充质干细胞(MSCs)是一类具有自我更新与多向分化潜能的成体干细胞,其生物学特性呈现显著异质性。
MSCs 的特性可概括为三大维度:
来源多样性突出 —— 除经典骨髓来源外,更可从脂肪、脐带等十余种组织分离,或经 iPSC 定向分化获得;
表型高度标准化,需稳定高表达 CD73/CD90/CD105(≥95%)且低表达造血系标志物及 HLA-DR(≤2%);
尤为关键的是功能可塑性 —— 在特定诱导下可分化为骨/软骨/肌细胞,且其功能亚群与表面标志物紧密关联:例如 CD146⁺亚群增强软骨保护与 Th17 抑制,CD271⁺亚群促进血管生成,而 TNFAIP6⁺亚群展现强效免疫抑制活性。这一特性谱系使 MSCs 成为 CAR 工程的理想多功能底盘。
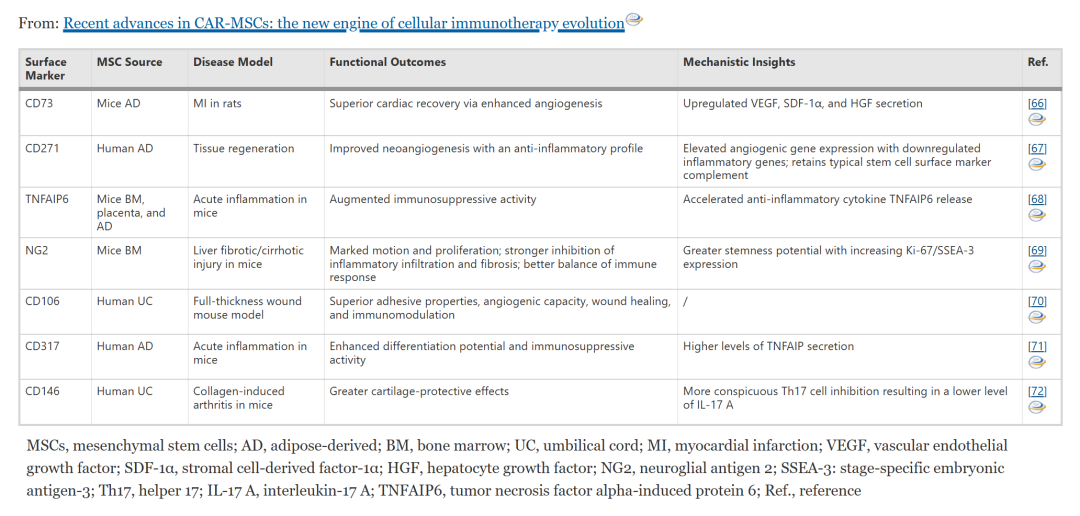
表 1 临床前模型中生物标志物定义的 MSC 亚群的功能特性
三、间充质干细胞和 CAR 工程细胞之间的双向相互作用
研究揭示了间充质干细胞(MSCs)与 CAR-T 细胞之间的三种不同相互作用范式。
首先,MSCs 可通过微环境介导的免疫抑制作用抑制 CAR-T 细胞功能,例如通过 IDO-1 代谢通路降低 AML 靶向 CAR-T 扩增,或通过 STC1 分泌削弱 CAR-T 对淋巴瘤的细胞毒性。
其次,MSCs 也能增强 CAR-T 活性,主要通过线粒体转移减少 CAR-T 细胞凋亡,或通过递送 IL-12 与 PD-L1 阻断抗体增强 CAR-T 对实体瘤的清除能力。
最后,在一些特定场景下,MSCs 对 CAR-T 的影响是中性的,尤其在 B-ALL 治疗中,MSCs 虽抑制常规 T 细胞,却未干扰 CD19-CAR-T 的肿瘤杀伤功能。
总体而言,MSCs 在 CAR-T 治疗中具备多种作用机制,未来可通过特定生物学干预增强其效果或改善治疗安全性。
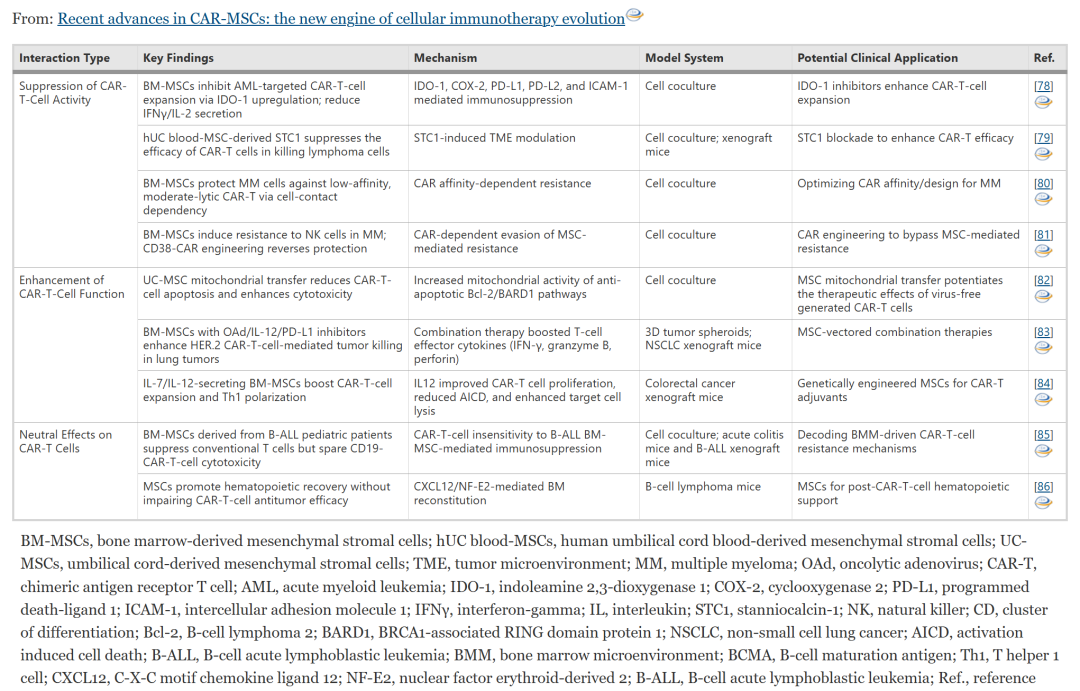
表 2 MSCs 和 CAR 工程细胞之间的双向相互作用:结果、机制和治疗意义
四、间充质干细胞的应用与载体优势整合
间充质干细胞(MSCs)的治疗潜力源于三大生物学功能轴:
免疫调节:通过抑制炎症与促进免疫耐受,显著提升 GVHD 患者生存率,CAR 工程化后更在结肠 GVHD 中实现协同增效;
组织修复:激活 CXCL12/AKT 通路加速造血重建,修复心/骨/关节损伤;
肿瘤调控:兼具诱导肿瘤凋亡与靶向递送抗癌因子的双路径。
全球逾 1300 项临床研究验证其跨疾病价值,但肿瘤领域转化明显滞后 —— 实体瘤微环境屏障与递送效率不足构成核心瓶颈。
基于上述特性,MSCs 成为 CAR 技术的理想底盘细胞:
安全性跃升:天然低免疫原性规避 CRS 与 GVHD 风险,突破传统 CAR-T 治疗瓶颈;
可及性革新:多组织来源结合「现货型」制备工艺,实现规模化应用;
实体瘤突破:凭借归巢能力穿透致密基质,通过「CAR 靶向识别 + 旁分泌因子(如 PD-L1 阻断剂)」双引擎重塑肿瘤微环境。
这一从基础功能到工程化优势的转化闭环,使 CAR-MSCs 成为实体瘤与自身免疫病治疗的变革性平台,为精准免疫治疗提供全新模式。
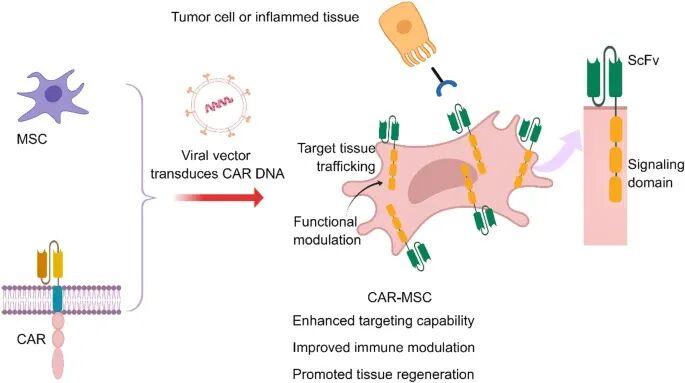
图 3:AR-MSC 结构示意图和疾病背景下的潜在作用机制
五、CAR-MSC 应用的潜在挑战和策略
转化之路面临多维挑战链:
首要是靶向不足,需通过趋化因子受体工程(CXCR4)与微环境响应型 CAR 协同提升;
其次是效价局限,可通过双信号域激活与 IL-12/TGFβ 拮抗剂基因回路增强;持久性缺陷则要求应用抗凋亡基因(BCL-2)修饰及线粒体移植;
工艺标准化缺口需同步突破 CRISPR-Cas9 非病毒整合与程序降温冻存技术;
最终,转化体系缺位亟待超顺磁示踪与「活细胞药物」审批通道创新。
唯有通过「靶向-效价-寿命」三位一体升级、GMP 工艺优化与适应性临床设计的深度协同,方能实现临床转化(图 4)。
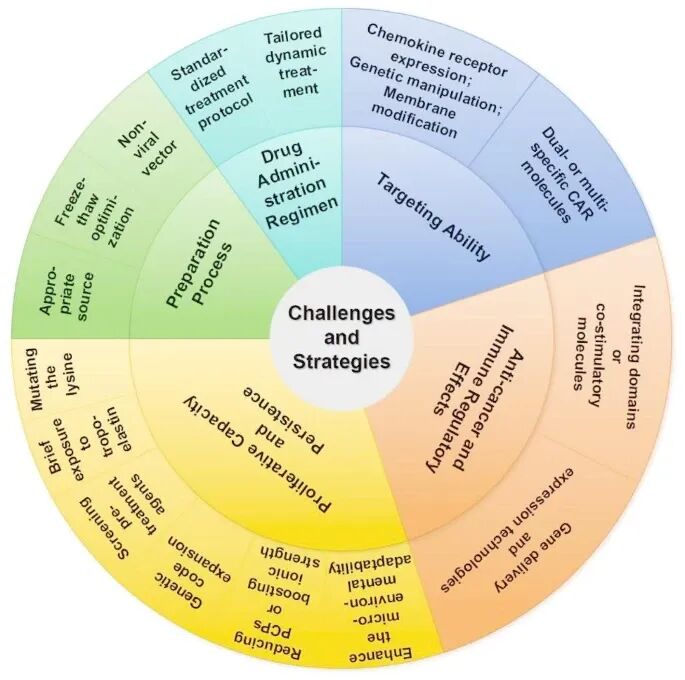
图 4:CAR-MSC 临床转化的潜在挑战和战略优化
CAR 与 MSCs 的整合代表细胞治疗新纪元,但当前研究仍处早期。
核心攻关方向在于:通过基因编辑规避肿瘤形成与遗传不稳定风险,利用单细胞分析解析机制异质性,并借力生物材料提升递送效率。通过跨学科协同创新与循证优化,CAR-MSCs 有望突破实体瘤与慢性免疫病治疗困局,最终实现精准医疗的范式革命。
原文链接:
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-025-01746-7#Sec30
文章来源:丁香通研选




