从一篇 Nature 讲起:制药和医学界共创的 NULISAseq™ 中枢神经系统 Panel 120
2025-11-12 14:49点击次数:43
关键词:NULISAseq™AD阿尔茨海默病Nature: AD 从“线性病理归因”转向“系统生态修复”
2025 年 9 月,Esther Landhuis团队在《Nature》期刊上发表了一篇题为“A Multipronged Assault - A new understanding of Alzheimer’s is leading to a variety of new treatment approaches”[1]的文章,指出截至 2025 年 1 月,全球共有 182 项阿尔茨海默病(AD)药物临床试验正在推进,涉及的治疗靶点可以分为 15 种类别(见图1),反映出 AD 研究的科学逻辑正从“线性病理归因”转向“系统生态修复”。
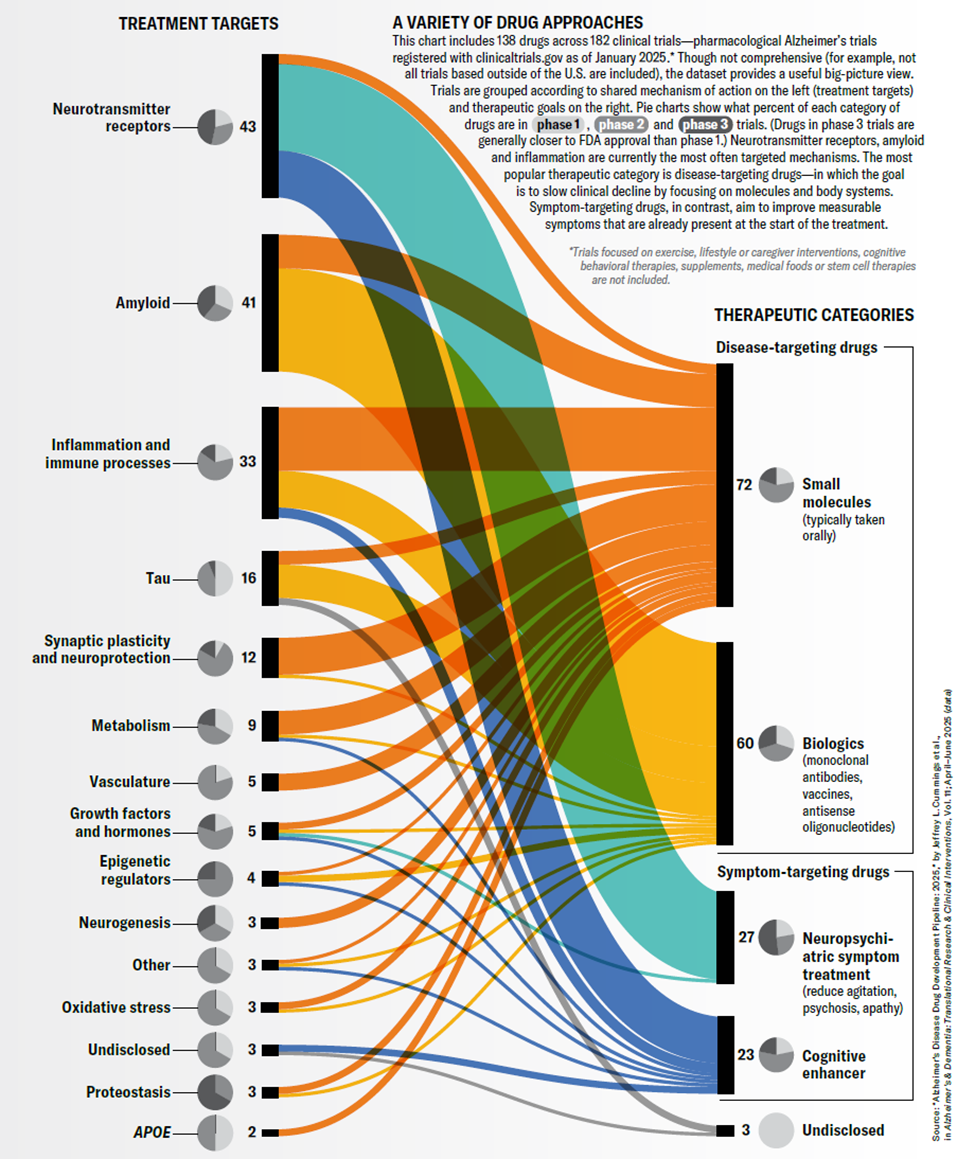
图 1. 治疗靶点分类:神经递质受体,β- 淀粉样蛋白,炎症与免疫过程,Tau 蛋白,突触可塑性与神经保护,代谢,脑血管系),生长因子与激素,表观遗传调控因子,神经发生,氧化应激,蛋白稳态,载脂蛋白E和其他
业界共创:NULISAseq™中枢神经系统Panel 120
与制药和医学界共创,系统性探索中枢神经系统
NULISAseq™ 中枢神经系统 Panel 120 基于“超灵敏×超多重”检测性能,与“业界共创的靶标清单”的独特组合(据悉,该Panel的初始靶标清单来源于神经领域头部制药公司,后经与临床和医学专家共同扩展和优化形成),不意外地全面匹配覆盖上述182项阿尔茨海默病(AD)临床试验的治疗靶点类别(见图 2)。
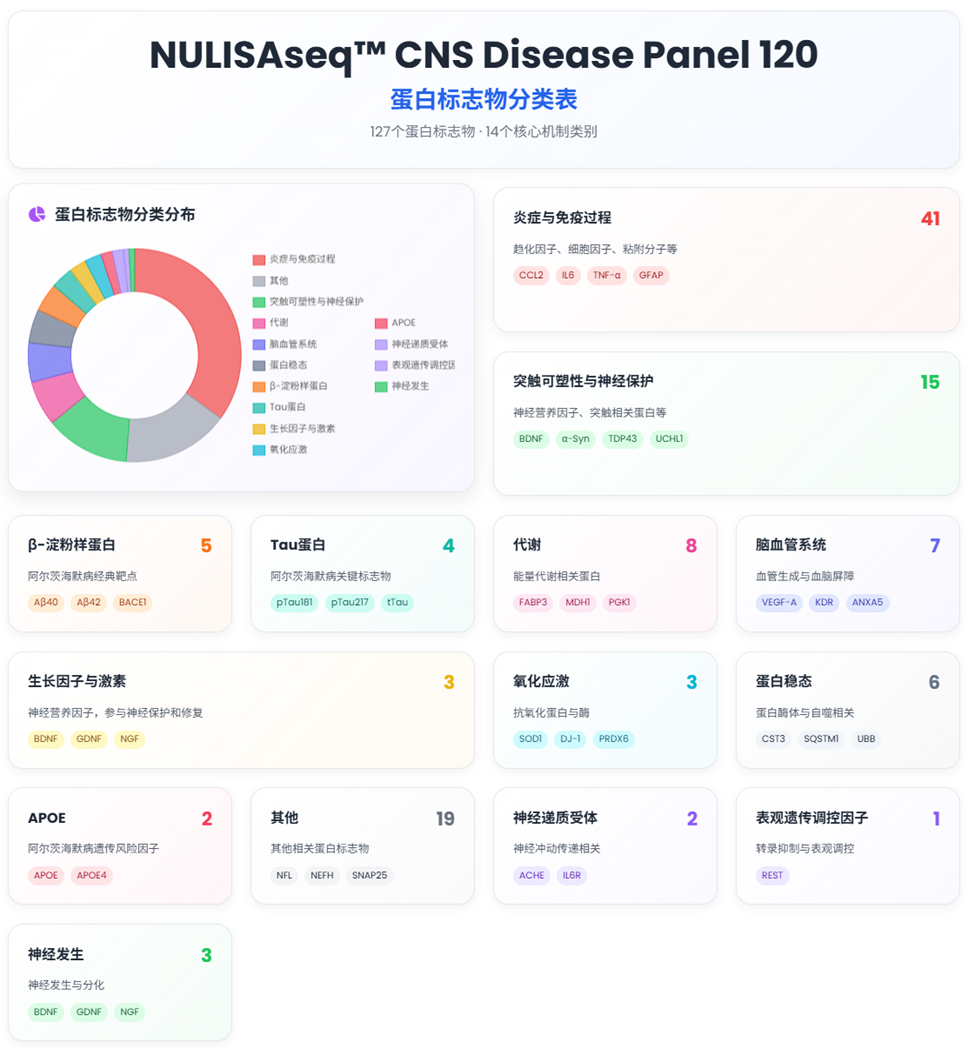
图 2. 鉴于生物学的复杂性,任何分类都难以做到绝对精准,图示呈现供参考[2]。
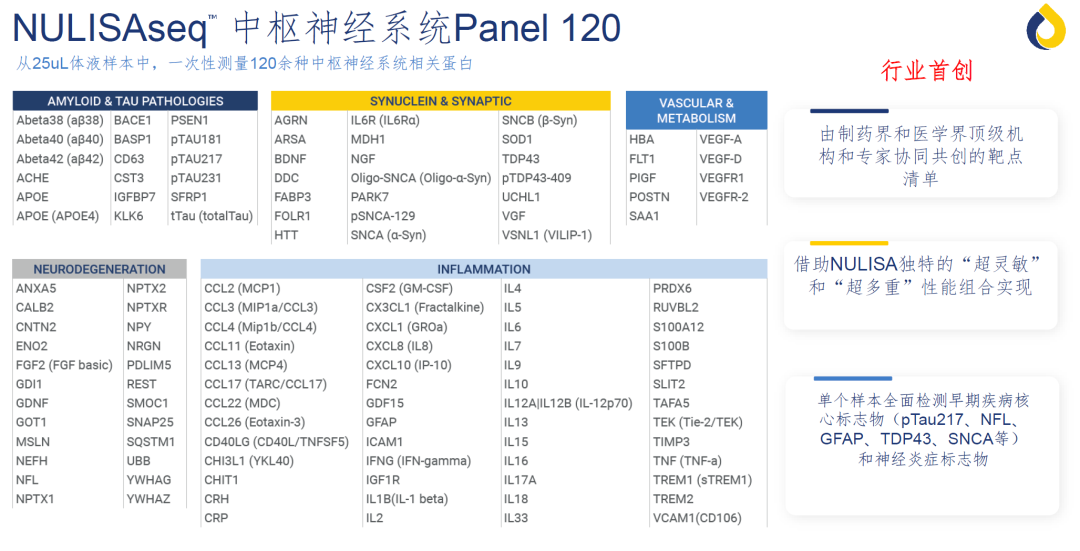
该 Panel 可以在 25uL 的血液或脑脊液样本中一次性精准定量检测 120 余种神经系统相关蛋白标志物(包含 Aβ38/40/42,pTau181/217/231/tTau,NfL和GFAP,以及APOE4,YWHAG,NPTX2,SOD1,α-Syn, TDP43 和 UCHL1 等;在 AD 之外,还覆盖其他的神经变性病和神经系统疾病。详细的 120+ 靶标清单见文末)。
不止于 AD:多项研究验证了 NULISA™ 的优异性能
和 PET 影像、单靶标检测一致性佳,而探索能力百倍提升
该 Panel 已被多项临床研究证明,一方面检测性能与临床PET影像、单靶标检测等具有极佳的相关性,另一方面,突破性地提供了系统性探索中枢神经系统疾病靶标组合的能力(适用于及早检测、鉴别诊断、分期分型、疗效监控等场景,广泛覆盖阿尔茨海默病、路易体痴呆、额颞叶痴呆、渐冻症、帕金森等其它神经系统疾病,以及衰老和脑健康)。
WashU: NULISA 从微量样本中一次性准确检测 100 多种阿尔茨海默病及相关疾病标志物
剑桥大学等借助 NULISA 对阿尔茨海默病、路易体痴呆、额颞叶痴呆、进行性核上性麻痹的鉴别诊断探索
埃默里大学借助 NULISA 技术筛选鉴定 CCL26 为渐冻症 ALS 基因治疗药效学生物标志物
诊疗生态:全球多个基于NULISA™的临床数据库
NULISAseq™ 中枢神经系统 Panel 120 和 NULISAseq™ 炎症和免疫 Panel 250 一起,得到了一系列重要的基金会和临床队列的认可和采用:
Alamar 与 The Michael J. Fox Foundation 合作推进帕金森病(PD)研究
ADDI 和 Gates Ventures 采用NULISA技术构建全球最大的 AD 临床结果相关蛋白组学数据集
德国 DZNE 的 Rhineland Study 采用 NULISA 技术进行超大规模前瞻性纵向老龄化队列蛋白组学分析
这些项目将通过 NULISA™ 技术,为神经退行性疾病的早期诊断、疾病进展追踪和治疗方案开发提供有力支持;所构建的大型的 NULISA™ 临床队列数据库将为阿尔茨海默病、帕金森病等神经退行性疾病和中枢神经系统疾病奠定良好的诊疗生态基础。
延伸阅读:AD 治疗领域的“多维度攻坚”趋势
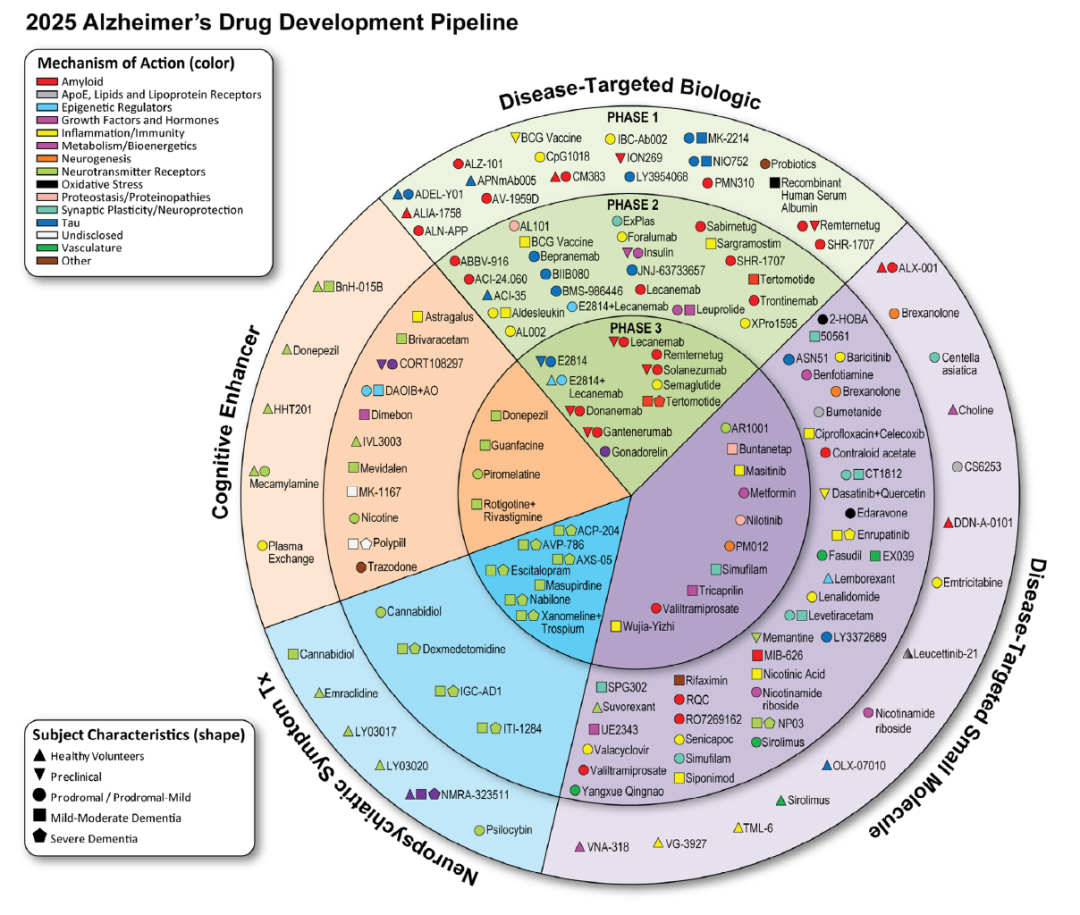
2025 年 6 月,Jeffrey Cummings教授团队在《Alzheimer's & Dementia》期刊上发表了“Alzheimer’s disease drug development pipeline: 2025”[3],指出截至 2025 年 1 月,全球共有 182 项阿尔茨海默病药物临床试验正在推进,评估 138 种候选药物,这些药物覆盖了通用阿尔茨海默病研究本体论(CADRO)分类下的 15 类病理过程(见图3),反映了 AD 领域“单一靶点”研发格局的彻底打破和“多维度攻坚”的明确趋势。
参考文献和信息来源
[1].Landhuis E. Alzheimer's Drugs Are Finally Tackling the Disease Itself. Here's How. Nature. 2025 Sep;645(8081):S6-S9. doi: 10.1038/d41586-025-02926-8. PMID: 40962989.
[2] https://www.doubao.com/ 基于 NULISAseq™ 中枢神经系统Panel 120 靶标清单和Nature[1]文章,借助 AI 制作而成
[3].Cummings JL, Zhou Y, Lee G, et al. Alzheimer’s disease drug development pipeline: 2025. Alzheimer’s Dement. 2025;11:e70098. https://doi.org/10.1002/trc2.70098
公司专利的 NULISA™ 技术和 ARGO™ HT 自动化平台相结合,作为兼具“超灵敏”和“超多重”检测性能的突破性蛋白检测系统,在同一个平台上同时具备 “高通量蛋白质组学” 和 “聚焦蛋白标志物” 两种检测模式。借助fg/mL级的灵敏度,超多重检测能力,12 个log的动态范围,全自动工作流程和一以贯之的特异性,形成了第一个有机会赋能蛋白标志物 “从发现、验证、到转化” 完整生命周期的技术平台。
版权声明
本篇内容来源为第三方转载,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



