【热应激的翻译调控】 | 7SL RNA与信号识别颗粒(SRP)的双重身份大揭秘!
2025-11-03 16:26点击次数:33
关键词:导读:
非编码7SL RNA是哺乳动物Alu和B1 SINE RNA的祖先分子,被认为只在信号识别颗粒(SRP)内起作用,帮助分泌蛋白转运到内质网输出。

新研究发现,在急性热应激下,这个古老的非编码RNA竟化身"应急指挥官",与SRP蛋白协同关闭全局转录与翻译,将细胞资源优先用于应激生存!这一发现重塑了我们对细胞应激响应机制的理解。
文章索引:
标题:7SL RNA and signal recognition particle orchestrate a global cellular response to acute thermal stress.
发表期刊:Nature Comminucations.
发表时间:2025.02
作者团队:美国马萨诸塞综合医院分子生物学系 Jeannie T. Lee 团队
IF:15.7
DOI:10.1038/s41467-025-56351-6.
研究结果
(1)热休克颠覆认知:7SL RNA竟擅离职守,冲进细胞核“拉闸限电”!
首先,作者发现当细胞遭遇急性热应激(42°C),经典“物流员”7SL RNA竟瞬间变身“应急总指挥”,其行为模式彻底颠覆传统认知!
7SL RNA(约300 nt)不仅是信号识别颗粒(SRP)的RNA组分,更是Alu/B1元件的分子始祖!其独特的“哑铃形”结构(中央7SL特异域+两侧Alu样域)成为功能演化的关键(图1a)。POL-III介导的7SL转录在热刺激2.5分钟内急速启动(图1b),证明其与Alu/B1等SINE元件类似,具备应激响应元件的核心特征!
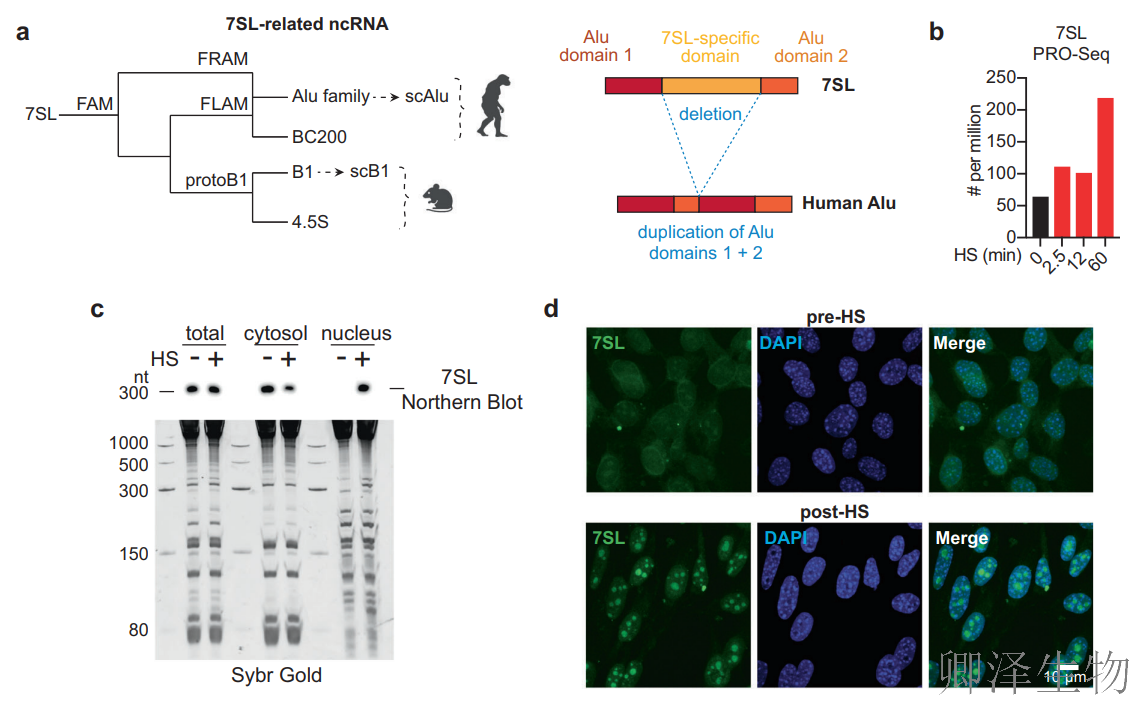
细胞分级和荧光原位杂交双双证实:热休克后7SL RNA发生剧烈的核聚集现象--Northern Blot显示核内含量激增(图1c),FISH成像直接捕捉到其在核内形成明亮焦点(图1d)。
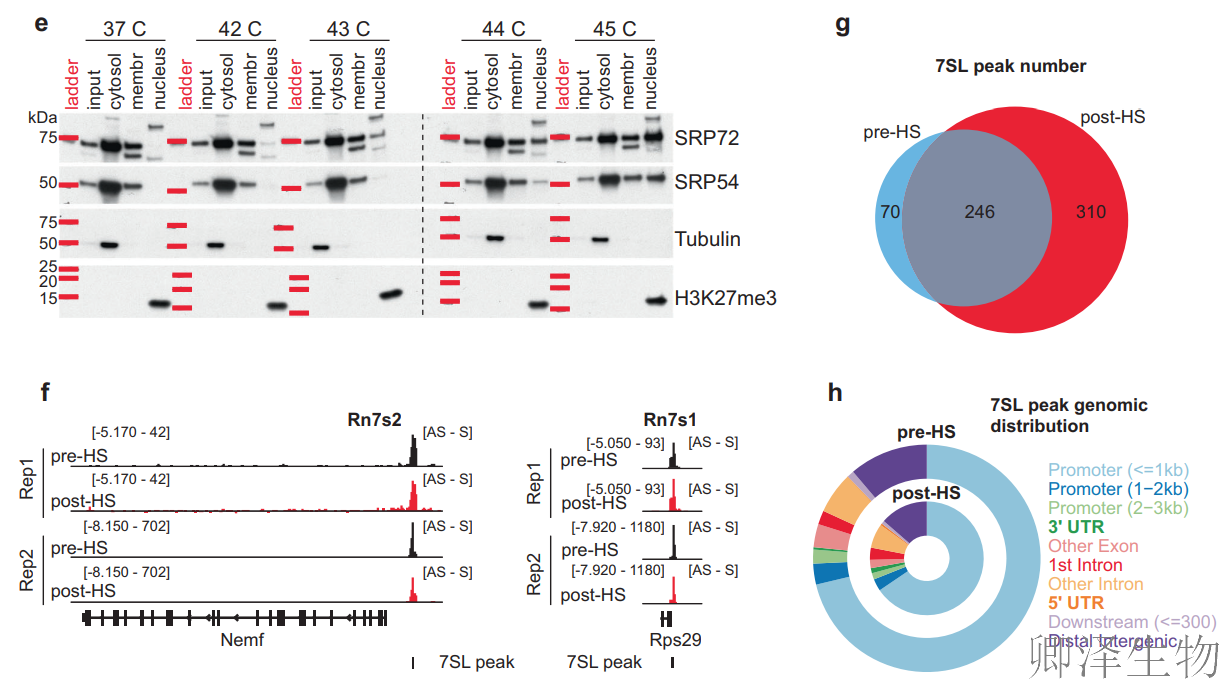
而且,7SL并非独自入核!其结合的SRP蛋白(SRP72/SRP54)同步向细胞核转移(图1e),暗示整个SRP核糖核蛋白复合物可能协同执行核功能。CHART-Seq技术精准捕获7SL RNA的染色质结合行为(图1g-h):基础状态下结合316个位点,热休克后结合位点新增310个(总数达556个),且76%结合于启动子附近!靶基因显著富集转录调控相关功能,直接暗示其全局转录抑制潜能。
综上,热休克诱导7SL/SRP复合物发生“身份转换”:从专职胞质蛋白转运的“物流系统”,转变为入驻细胞核、结合染色质、关闭基因表达的“应急调控模块”!这一发现彻底改写了对7SL/SRP功能的传统认知。
(2)7SL RNA如何精准关闭靶基因?热休克转录抑制的直接证据链
随后,作者发现热休克(HS)诱导的7SL RNA染色质结合直接导致靶基因的转录抑制,且其靶标富集于转录调控核心元件(如Pol II因子、中介体、rRNA基因),揭示7SL作为全局转录抑制器的关键功能。
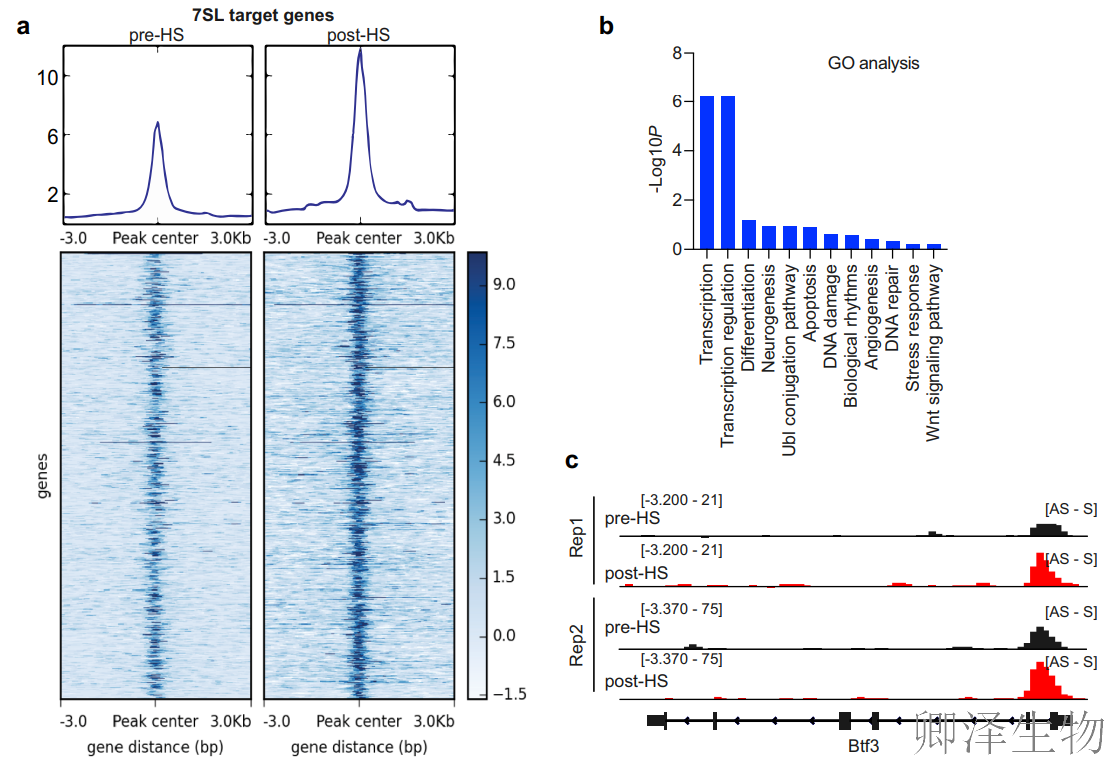
热图分析(图2a)显示:7SL CHART-Seq信号在热休克后显著增强(峰值区域±3 kb),表明热应激不仅诱导7SL表达,更强化其与染色质的亲和力。基因本体分析(图 2b)发现:7SL结合基因显著富集于转录调控相关通路(如RNA聚合酶II转录、转录因子复合物组装),提示其通过抑制核心调控节点实现全局转录重编程。
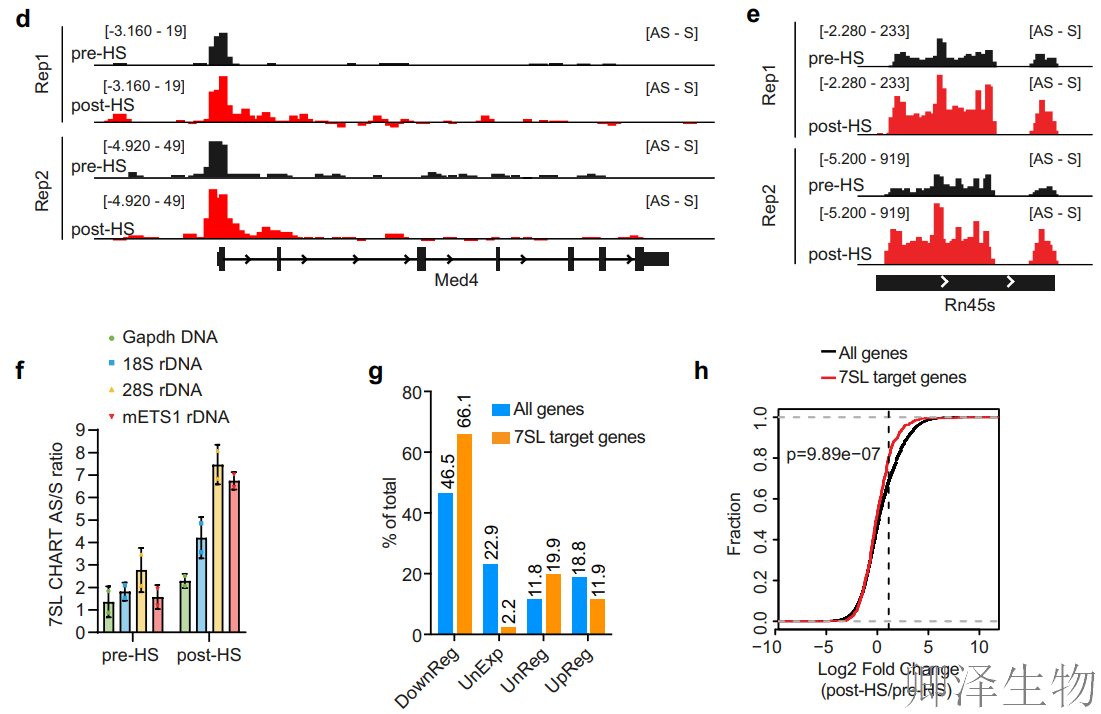
同时,验证了关键靶基因如Btf3、Med4、Rn45s与7SL的结合模式(图2c-e)。
RT-qPCR正交实验(图2f)对CHART富集DNA进行qPCR,证实7SL在18S/28S rDNA及ETS1区域的结合显著增强。PRO-Seq分析(图2g-h)显示:7SL靶基因中66.1%在热休克后被抑制;累积分布曲线(CDF)显示靶基因表达变化显著左移,整体下调程度远超非靶基因。
综上,热休克通过诱导7SL RNA①核转位 → ②染色质结合(尤其启动子) → ③抑制靶基因转录的三级联反应,选择性关闭包括Pol I和Pol II系统在内的转录网络,证实7SL是细胞应激转录调控的核心执行者。
(3)热休克颠覆认知:SRP蛋白竟是基因“紧急制动器”!
接着,作者发现信号识别颗粒(SRP)在热休克中跨界扮演“转录调控者”,通过抑制关键基因表达协助细胞应急响应!
热休克(45°C, 15 min)驱动7SL RNA显著富集于核仁(绿色),与核仁标志蛋白nucleophosmin(红色)共定位(Fig. 3a),提示其可能干预rRNA合成,重塑核内转录格局。
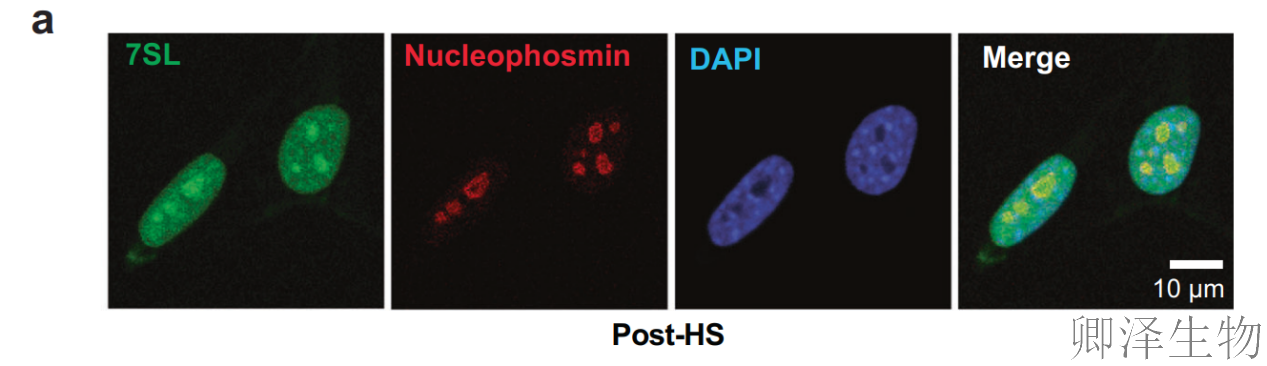
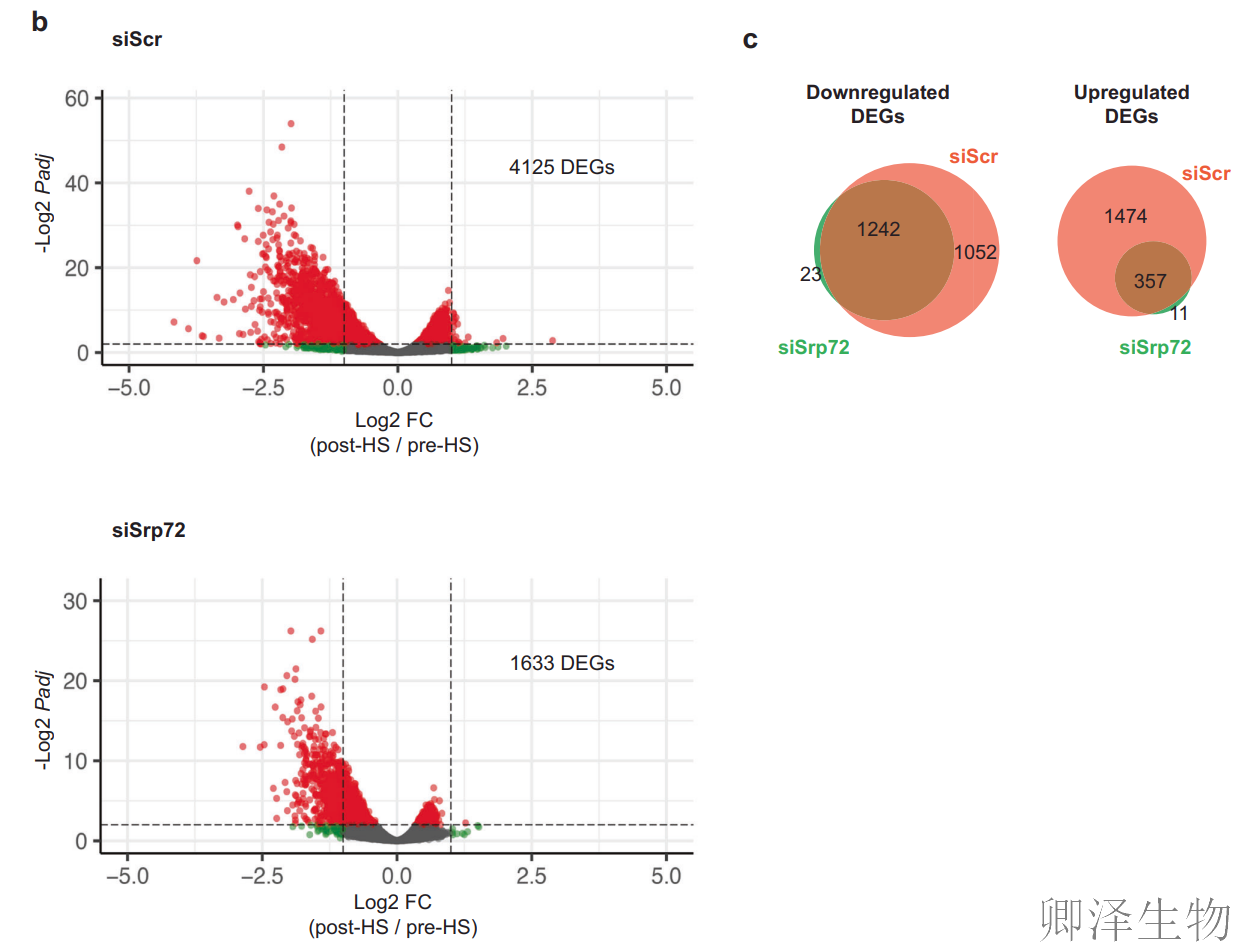
核仁正式7SL组装成RNP的场所。这提出了一种有趣的可能性,即SRP本身可能在对热应激的反应中发挥作用。因此,作者采用siRNA敲降了一个重要的SRP亚基SRP72。在敲除48小时后,细胞进行急性和严重(10分钟,45°C)热休克,并对hs前和hs后的细胞进行RNA-Seq分析。对照组中,热休克引发4125个差异基因(DEGs),下调基因为主(应激典型响应);而在SRP72敲低组(siSrp72)中,DEGs锐减至1633个,且下调基因数量显著减少(图3b-c),提示SRP是热休克转录抑制的 “必要开关”。
综上,SRP蛋白从传统的“蛋白转运工”转型为应激转录指挥官,通过核定位与基因特异性结合,协同7SL RNA实现转录程序的快速重编程!这一发现为靶向应激通路提供了新思路。
(4)7SL/SRP与核糖体“紧密结合”,全局抑制翻译!
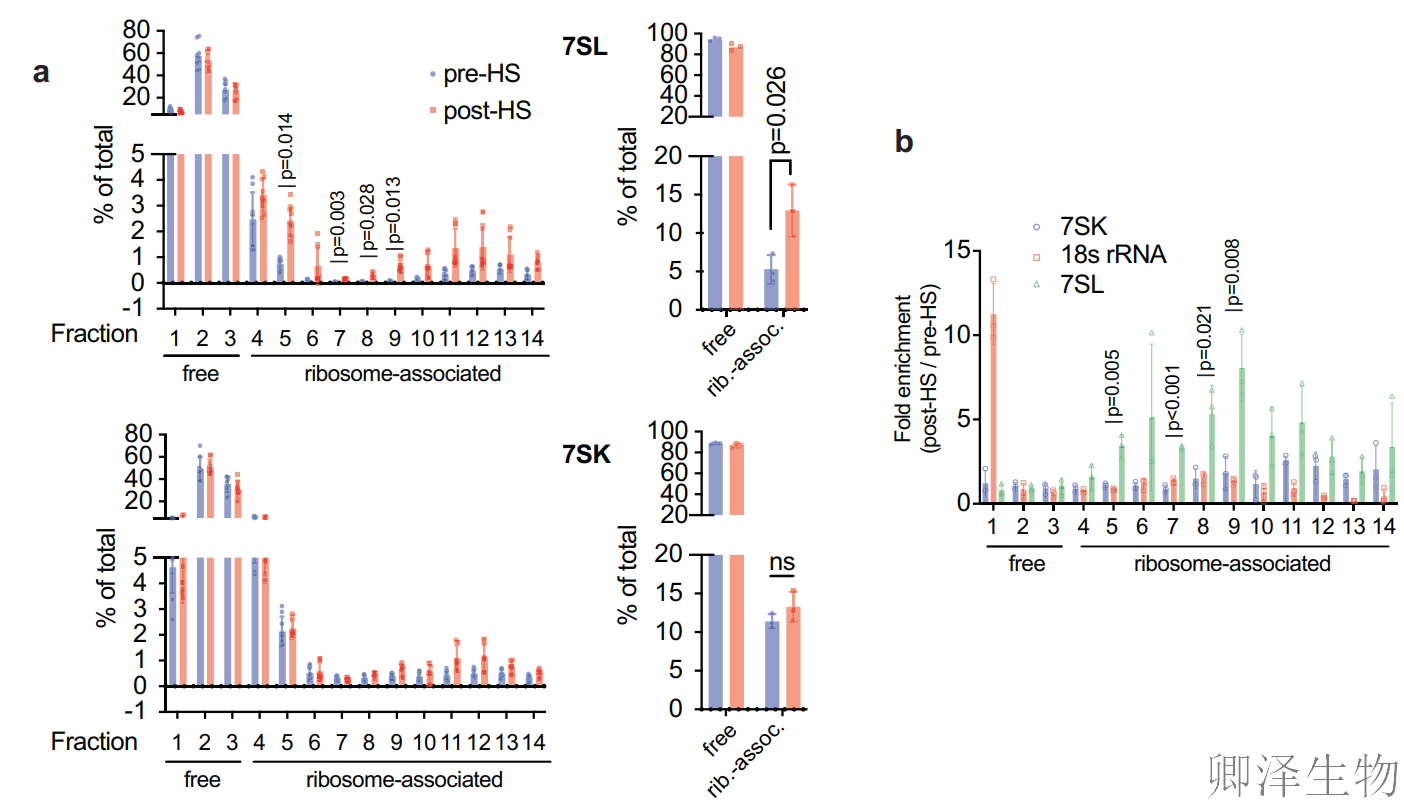
为了确定SRP复合体是否在压力下与核糖体结合,作者在热休克前后对细胞质进行了蔗糖密度梯度离心。热休克(45°C, 15 min)后,7SL RNA在核糖体组分中显著富集,而对照RNA 7SK无变化,证实结合特异性(图4a-b)。Western Blot显示SRP54/SRP72蛋白与核糖体标志蛋白(RPL23a/RPS6)同步向重梯度转移(图4c),证明SRP整体参与核糖体结合。
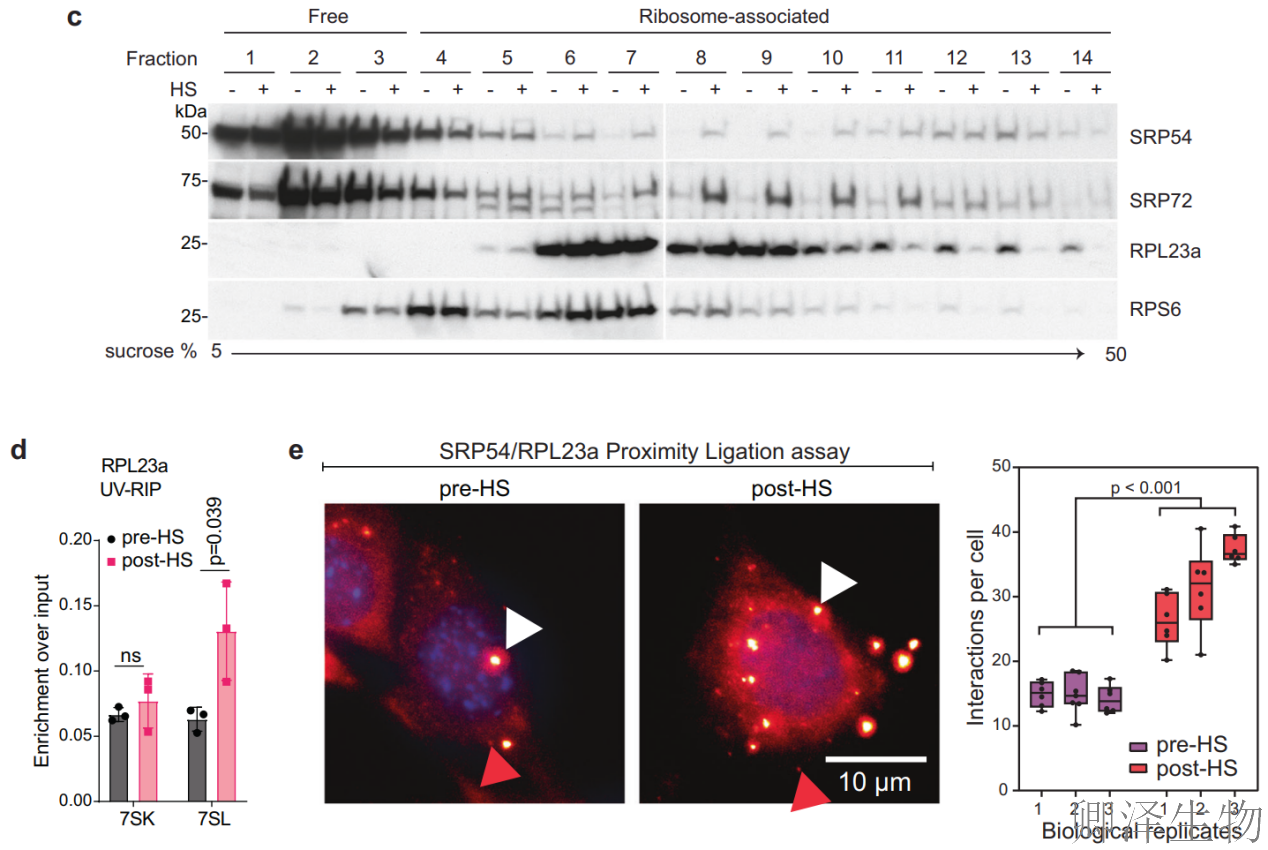
此外,使用RT-qPCR的uv-交联RNA免疫沉淀(UV-RIP)显示,7SL与RPL23a的相互作用在热休克后显著增加,而7SK没有观察到这种增加(图4d),这表明7SL- srp复合物与核糖体直接相关。RPL23a和SRP54的邻近连接分析(PLA)支持了这些观察结果,结果表明,在热应激期间,这两种蛋白之间的关联显著增加(图4e)。
总之,这些数据表明,在急性热应激期间,7SL-SRP复合体从游离细胞质池转变为核糖体结合。
(5)SRP独立于ISR通路介导热休克翻译抑制
基于上述结果,作者尝试研究SRP是否可能有助于已知的热介导的翻译抑制。敲降SRP14和SRP72后,并在存在或不存在热休克的情况下对新生蛋白进行Click-iT标记(图5a)。结果显示:热休克(45°C)后对照组蛋白合成显著下降,而SRP14或SRP72敲低细胞中翻译抑制被明显缓解。嘌呤霉素标记实验中(图5b),SRP72敲低后热休克诱导的翻译抑制减弱(Puromycin信号增强),证实SRP是热休克翻译关闭的必需因子。
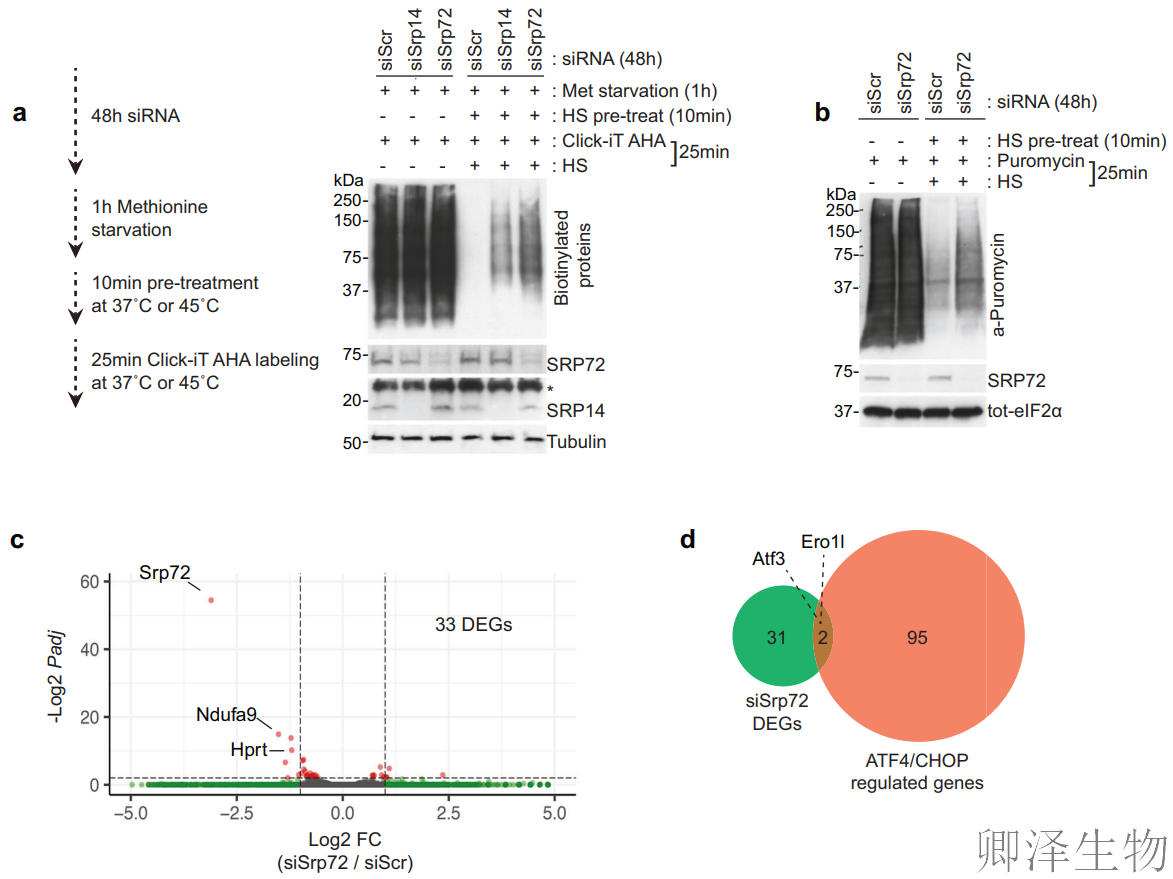
转录组分析(图5c)显示SRP72敲低仅在基础条件下引起33个差异基因,未激活大规模应激相关基因。而且,SRP72缺失基因集与ISR核心调控因子ATF4/CHOP的靶基因重叠极少(图5d),排除ISR间接参与。
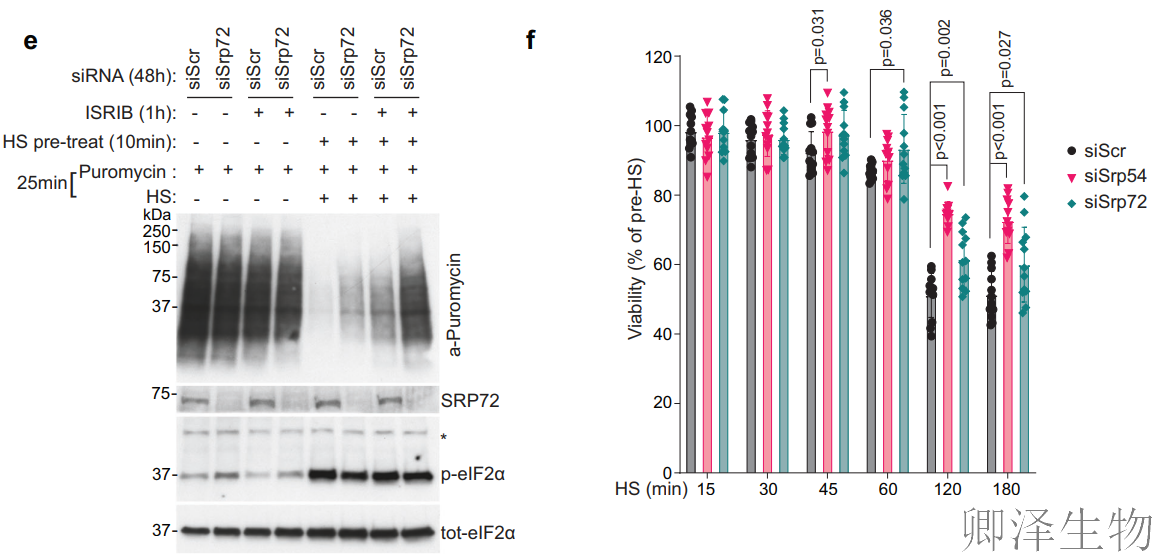
作者尝试进一步寻求建立SRP和ISR之间的关系(图5e)。ISR抑制剂实验中,ISRIB(ISR抑制剂)部分缓解热休克翻译抑制;SRP72敲低 + ISRIB联合处理几乎完全恢复翻译;eIF2α磷酸化水平在SRP72敲低后未改变,证实SRP独立于eIF2α通路。说明SRP与ISR形成双通路抑制模式,协同关闭翻译!
那SRPs是否会影响细胞在热应激条件下的存活?SRP54或SRP72敲低后,热休克(45°C)下的细胞存活率显著变化(p<0.01),表明SRP介导的翻译抑制直接影响应激生存命运(图5f)。
综上,SRP作为独立于ISR的翻译制动器,为理解应激响应中多层级调控提供新范式,并为干预蛋白质稳态相关疾病(如热休克损伤、神经退行性疾病)提供新靶点!
(6)Ribo-seq分析显示SRP选择性翻译抑制
那么,SRP抑制是在急性热应激期间影响所有mRNA,还是仅影响特定的一组正在翻译的mRNA?为了解决这一问题,作者进行了核糖体测序(Ribo-Seq),发现热休克下SRP以转录非依赖方式选择性抑制mRNA翻译,且该效应集中于翻译起始阶段,为应激响应提供新视角!
热休克(45°C)后,对照组(siScr)核糖体保护片段(RPF)信号显著降低(翻译抑制),而SRP72敲低(siSrp72)部分恢复RPF信号,证实SRP是热休克翻译抑制的关键介质。k-means将mRNA分为Cluster1(10%)和Cluster2(90%),后者对SRP缺失敏感(热休克下RPF信号恢复)。
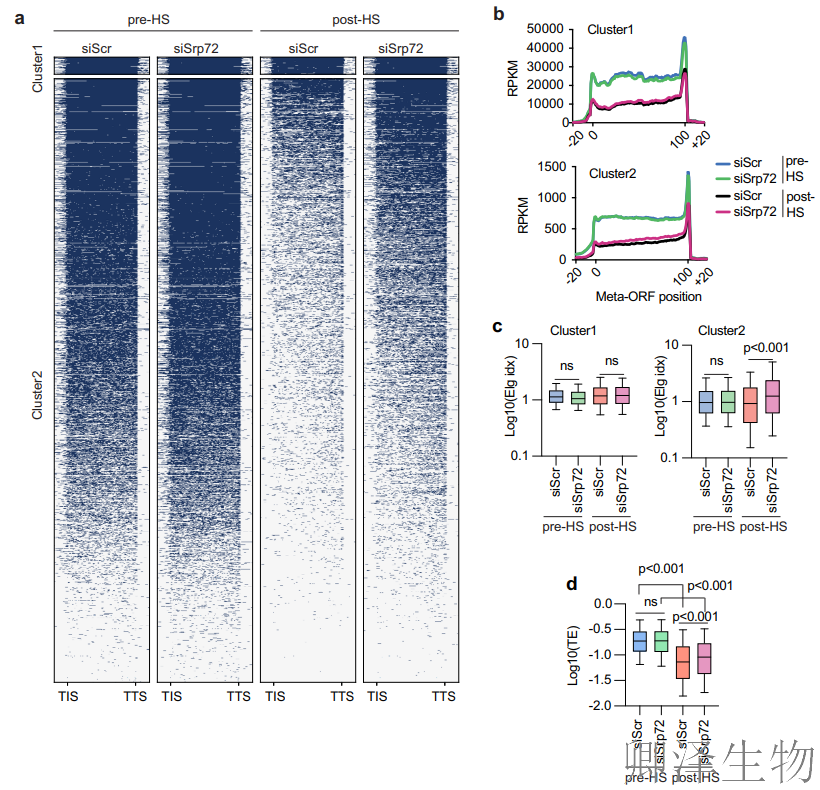
Metaplots分析(图 6b)显示:热休克后RPF信号在翻译起始位点(TIS)及整个编码区(CDS)显著下降,表明翻译起始和延伸同步受抑制。
延伸指数计算(图6c):Cluster2在热休克下延伸指数降低,SRP72敲低后指数回升,证实SRP通过阻碍起始-延伸转换抑制翻译。
TE分析(图6d):热休克导致整体TE下降,但SRP72敲低显著缓解该效应,且效应独立于mRNA水平变化(已标准化),排除转录干扰。
(7)SRP优先抑制线粒体蛋白合成,重塑细胞能量平衡!
最后,作者通过多组学整合分析揭示:热休克下,SRP特异性靶向核编码的线粒体相关mRNA,通过抑制其翻译效率(TE)优先阻断线粒体蛋白合成,揭示细胞在应激中“节能保生存”的新范式!
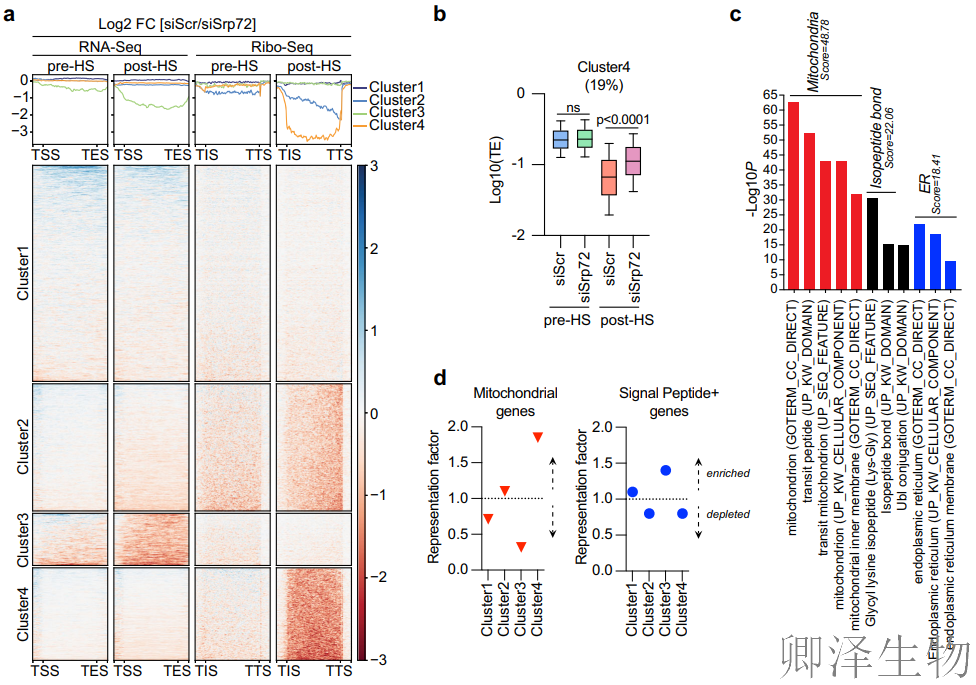
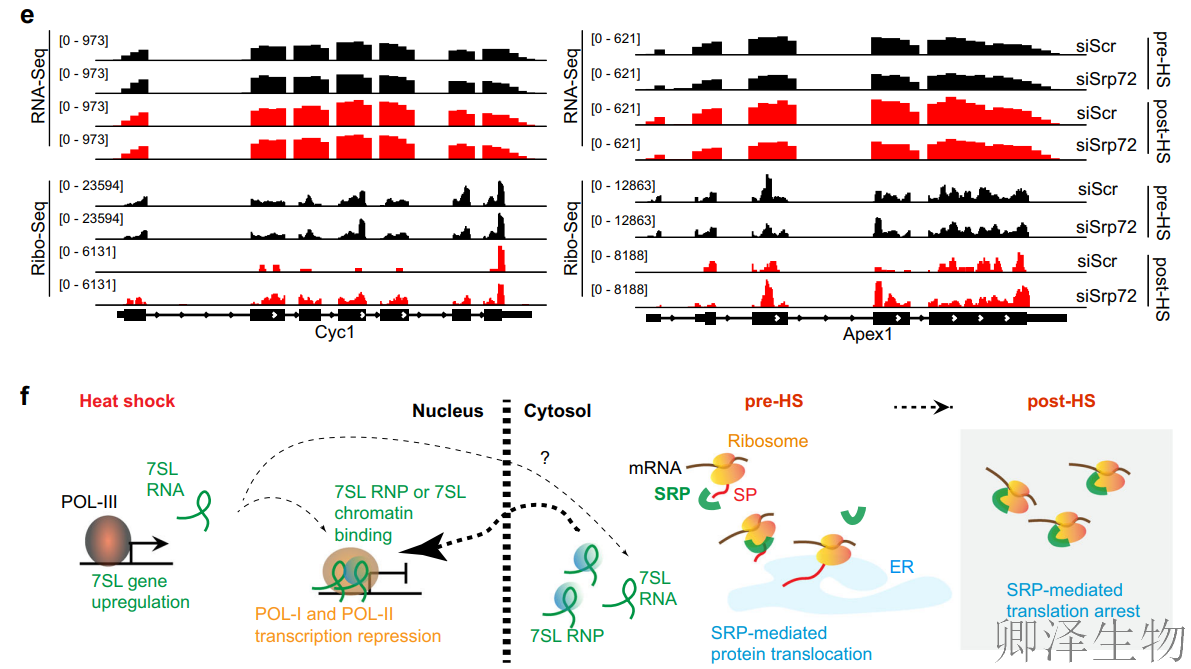
综上,7SL/SRP双轨调控应激响应的全局模型(图7f):热休克中,7SL/SRP协同执行转录-翻译双重关闭:
l 核内:7SL结合染色质抑制基因转录;
l 胞质:SRP结合核糖体抑制翻译延伸;
l 线粒体偏好性:通过抑制核编码线粒体蛋白合成,优先减少能量消耗,助力细胞存活。
研究结论
这项研究揭示了7SL/SRP的功能与蛋白质分泌无关。在急性热休克下,7SL和SRP在早期应激反应中共同选择性地抑制细胞转录和翻译机制。在热胁迫下,7SL被上调,在细胞核中积累,并结合到被热休克抑制的靶基因上。同时,在细胞质中,SRP与核糖体结合并抑制新蛋白的合成。翻译抑制独立于信号肽发生,并通过耗尽SRP而消除。翻译抑制延伸到线粒体,因为具有线粒体功能的核编码基因在SRP靶标中富集。
版权声明
本篇内容来源为第三方转载,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



