组织解离的常用方法以及应用方向全梳理
美天旎
1. 组织解离常用方法
组织解离主要依赖酶解法和机械分离法,或将两者结合以达到最佳效果
(1)酶解法(Enzymatic Digestion)
利用特异性蛋白酶水解构成组织结构的细胞外基质(ECM)和细胞间的连接蛋白,从而将细胞从组织微环境中释放出来。这是目前最主流且高效的解离方法。为防止死亡细胞释放的 DNA 导致细胞聚集,消化液中通常会添加 DNase I。
(2)机械分离法 (Mechanical Dissociation)
通过物理手段,如精细剪切、温和研磨、移液器吹打或自动化仪器震荡,破坏组织结构,分散细胞。此方法常用于结构松散的组织(如脾脏、淋巴结),或作为酶解法的辅助手段以增强解离效率。
(3)联合应用策略
大多数成熟的方案都采用「温和机械处理 + 高效酶解」的组合策略。首先通过机械方法将组织切成小块以增加酶作用的表面积,再进行酶解消化,最后通过轻柔的机械力辅助细胞的分散。这种策略旨在解离效率与细胞损伤之间取得最佳平衡。市面上已有成熟的自动化组织解离平台例如 gentleMACS 采用此种解离策略,极大地提升了效率,确保了结果的高活性、高得率和高重复性。
(4)常用消化酶及其作用

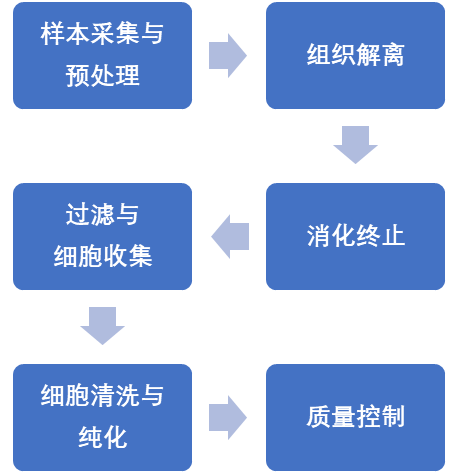
(5)主要实验流程
2.组织类型决定制备方案的差异
(1)方案差异化的决定因素
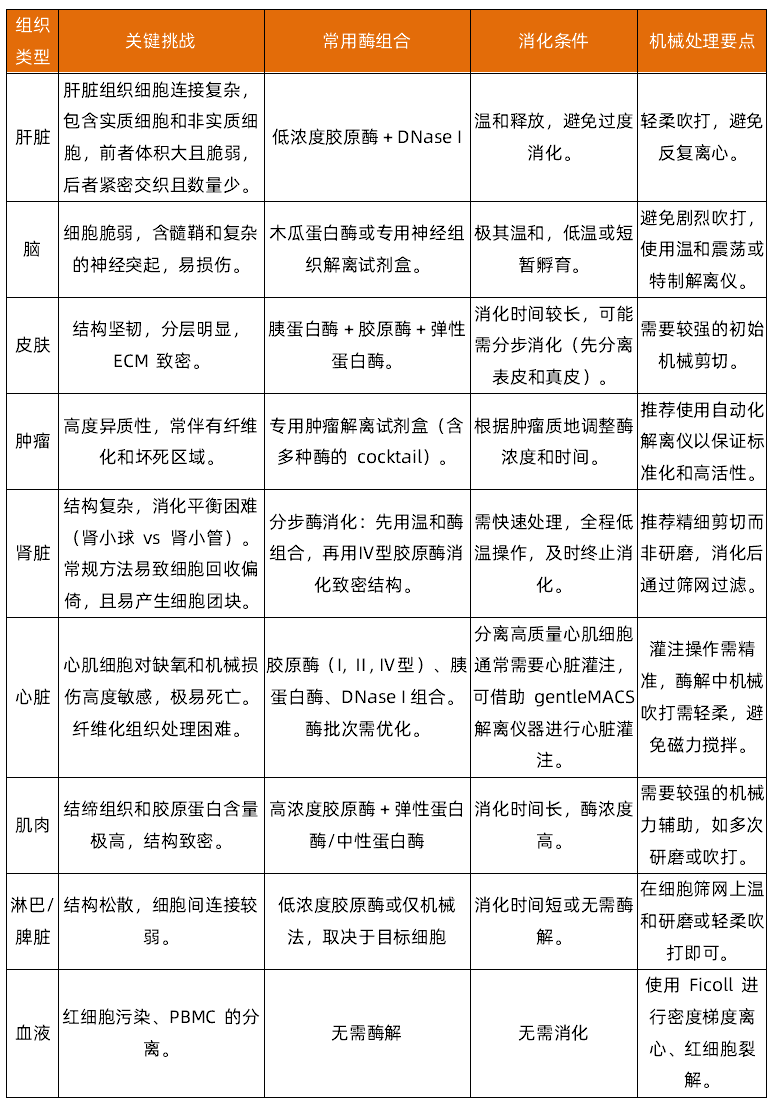
- 细胞外基质(ECM)的成分与密度:例如,纤维化肿瘤的胶原蛋白含量远高于脑组织。
- 细胞间连接的紧密程度:上皮组织的紧密连接比淋巴组织要牢固得多。
- 组织内源性酶的含量:胰腺等组织富含内源性蛋白酶,解离时易发生自溶。
- 目标细胞类型及其敏感性:神经元等细胞对酶解和机械力非常敏感,而肿瘤细胞通常较为耐受。
(2)一张表快速了解不同组织类型
神经组织的单细胞制备是所有组织类型中最具挑战性的领域之一,其制备方案需根据脑区、发育阶段和疾病模型进行精细化调整和优化。如对于胚胎或者新生脑组织,其髓鞘化低、ECM 松散以透明质酸为主,需要注重解离过程的温和处理。而成年神经组织因髓鞘致密,ECM 交联显著。必须采用更高强度、多酶联合且配合机械剪切和密度梯度去髓鞘的策略,以兼顾解离效率与细胞存活。
针对不同肿瘤类型,单细胞悬液制备需「因瘤施策」:血液瘤离心即可。实体瘤则先机械剪切,再以胶原酶、透明质酸酶和 DNA 酶破除致密细胞外基质,其中富含纤维和 ECM 胶原的胰腺癌或乳腺癌需更长酶解。对于常规 37℃ 长时间消化容易损伤目标细胞,有研究采用低温酶解方法进行改善;高级别肿瘤可借微流控按尺寸富集大且异质的细胞,低级别肿瘤因形态接近正常细胞需更温和条件,最终方案是在解离效率、细胞活力和亚群代表性之间动态权衡。
(3)特殊样本类型的处理考量
冷冻组织样本:冰晶的形成会严重损伤细胞膜,导致制备的单细胞活性普遍较低。因此,冷冻组织可以使用合适的缓冲液(如130-128-024)提取细胞核用于 snRNA-seq,对于复杂组织比如冷冻脑组织,也可以使用 Anti-Nucleus 磁珠(如130-132-997)进行进一步纯化以满足测序要求。
FFPE 样本(福尔马林固定石蜡包埋):甲醛固定导致蛋白质和核酸发生交联和片段化,无法用于制备活细胞。此类样本同样可以使用商业化试剂盒(130-134-089)分离细胞核进行 snRNA-seq 或使用解离试剂盒(130-118-052)解离分选后进行基因组分析。
- 自动化样本解离制备细胞平台
(1)传统细胞制备方法的局限性
传统的样本制备方法,尤其是对复杂实体组织(如肿瘤、脑组织、纤维化组织)的处理,长期以来严重依赖手动操作。手动解离,无论是通过机械剪切、研磨,还是化学酶解,都存在着难以克服的固有缺陷:
- 可重复性差: 操作者的技术熟练度、操作力度、时间控制等变量,都会导致批次间乃至同批次样本间的巨大差异,严重影响实验结果的可靠性。
- 细胞损伤严重: 过度的机械力或不精确的酶解时间与温度控制,极易破坏细胞膜的完整性,导致细胞活性显著下降,并可能选择性丢失某些脆弱的细胞亚群。
- 效率低下且耗时: 手动处理流程繁琐,耗费大量人力和时间,难以满足高通量研究的需求。
(2)自动化细胞制备
随着科学研究对数据质量和标准化要求的日益提高,样本制备流程的自动化和标准化已不再是一个选项,而是发展的必然趋势和主流。自动化组织解离平台通过集成的机械力、精确的温控和优化的酶解方案,将原本依赖个人经验的「手艺活」转变为标准化的工业流程。这不仅极大地提升了效率,更重要的是,它通过标准化的程序最大限度地降低了人为操作差异,确保了单细胞悬液的高活性、高得率和高重复性,为下游分析提供了可靠的起点。
(3)行业标杆:gentleMACS 自动化样本制备平台
在自动化样本解离领域,德国美天旎(Miltenyi Biotec)公司的gentleMACS平台是公认的行业标杆。它并非单一的仪器,而是一套集硬件、专用耗材和优化试剂于一体的完整生态系统,为研究人员提供了从组织到高质量单细胞的「一站式」标准化解决方案。
3.1 平台构成:硬件、耗材与试剂的协同生态
gentleMACS 平台的成功,源于其三大核心组件的无缝协同:
- gentleMACS Dissociator (解离仪): 作为平台的核心硬件,该仪器提供精确控制的、标准化的机械解离程序。其系列包括可处理 1~2 个样本的基础型号,以及可同时处理多达 8 个样本并带有独立温控加热模块的 gentleMACS™ Octo 八通道高通量型号。后者能够为每个样本提供 37°C 的精确孵育温度,确保酶解反应在最优条件下进行。搭载经验证优化过的解离程序:超过 80 个预定义的解离程序能满足绝大数不同组织的解离需求,此外还能针对样本创建定制化程序,解离几乎所有类型的组织。
- gentleMACS C 管: C 管是专为组织解离设计的密闭式一次性无菌耗材。其管盖中心集成了一个独特的转子-定子系统。当 C 管置于解离仪上时,仪器驱动转子高速旋转,对组织进行高效且温和的机械剪切和匀浆。全封闭的设计确保了整个过程的无菌性,并有效防止了样本间的交叉污染。
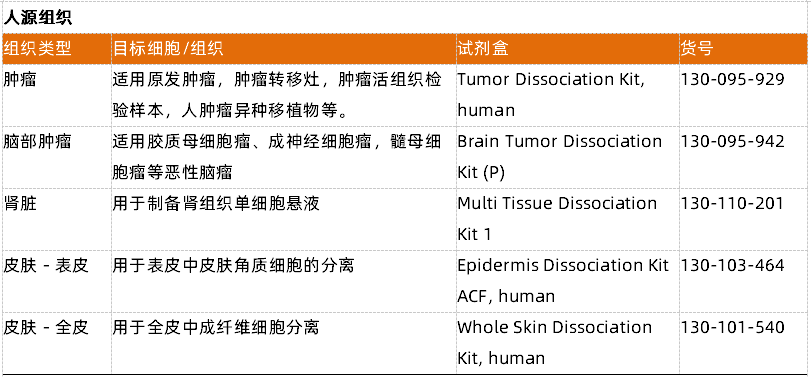
- 组织解离试剂盒:如果说解离仪和 C 管是「硬件」,那么针对不同组织优化的酶解试剂盒就是其「软件」。美天旎公司开发了覆盖几乎所有常见组织类型的专用试剂盒,如肿瘤、神经组织、皮肤、肝脏、肺等。每个试剂盒都包含经过严格验证的酶混合物和缓冲液,并与解离仪上的特定预设程序相匹配。
3.2 gentleMACS技术特点与科学优势
gentleMACS 平台通过其独特的设计,将复杂的组织解离过程简化为几个标准化步骤,其核心优势体现在以下几个方面:

- 一表弄清组织解离试剂盒选择
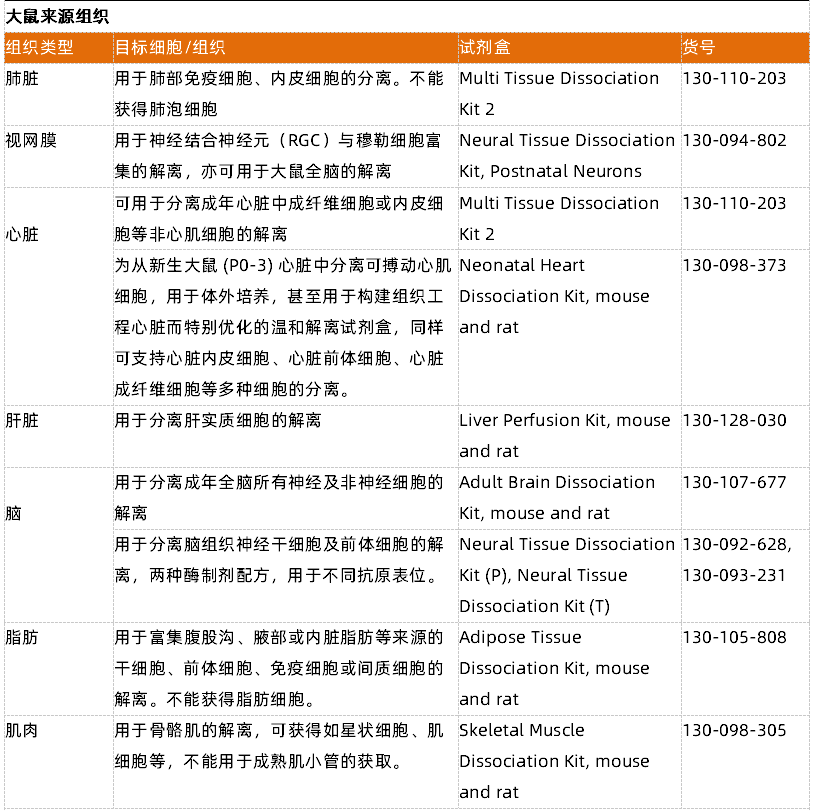
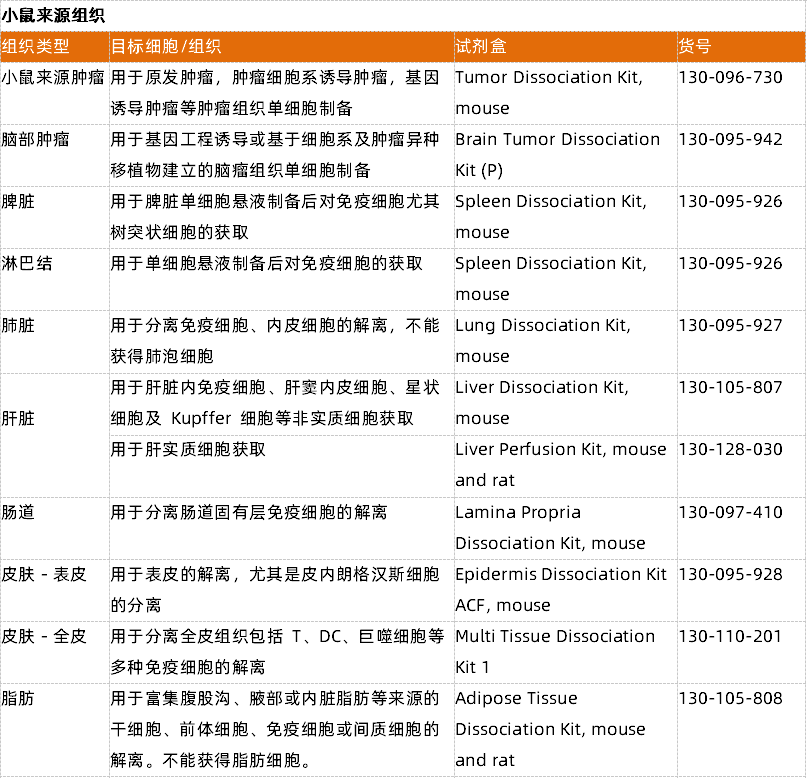
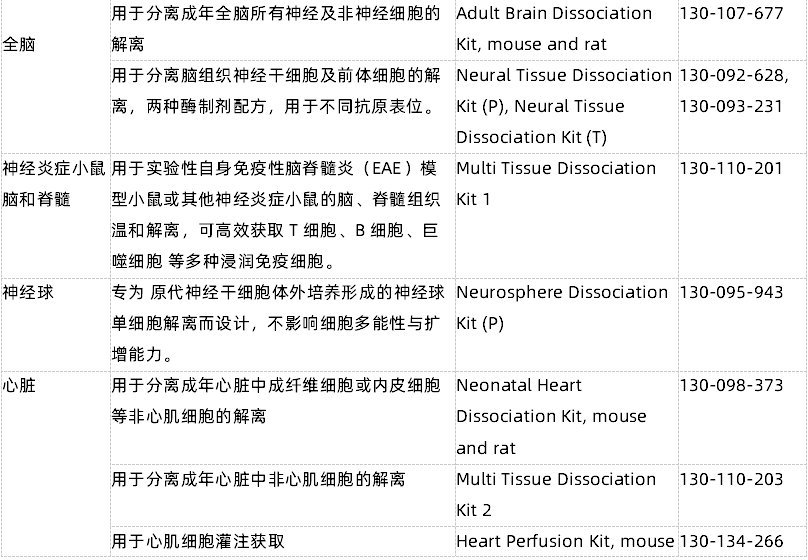

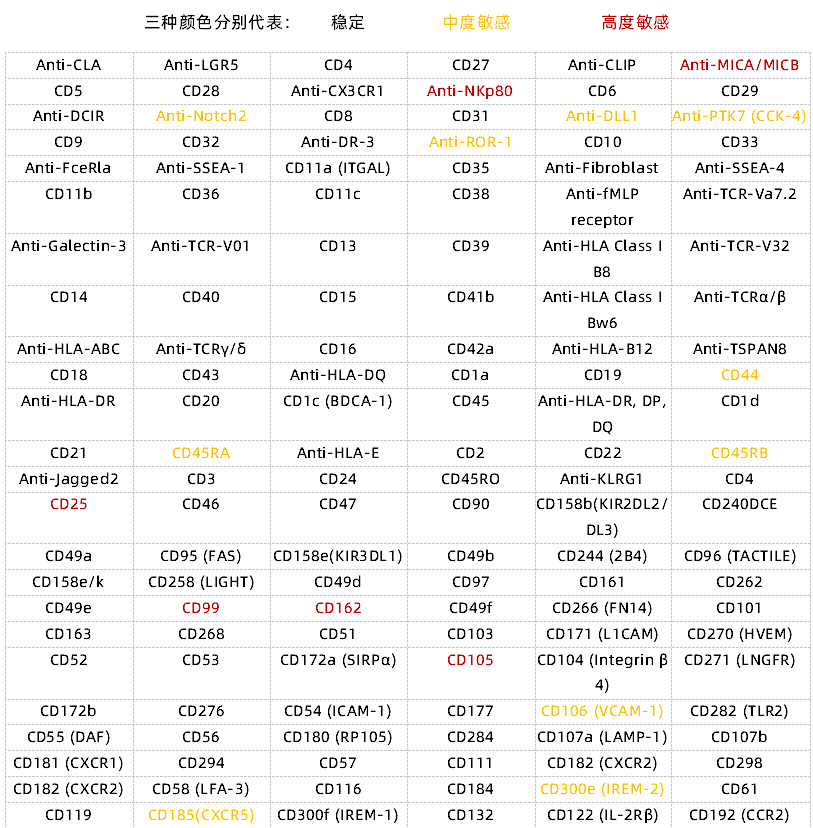
附表1 以人肿瘤解离试剂盒为例,细胞表面抗原保留验证信息
- 组织解离细胞应用
细胞异质性研究 (Cellular Heterogeneity Research): 通过单细胞测序(scRNA-seq, scATAC-seq等),分析单个细胞的基因表达、染色质开放状态等,绘制高分辨率的细胞图谱,揭示发育过程、疾病机制和药物响应的细胞异质性。
- 体外模型构建 (In Vitro Model Construction):
- 初代细胞培养 (Primary Cell Culture): 在短期内研究最接近生理状态的细胞功能。
- 稳定细胞系建立 (Stable Cell Line Establishment): 通过转染等手段建立,用于长期、可重复的实验。
- 类器官构建 (Organoid Construction): 利用干/祖细胞构建,在体外模拟器官的复杂结构和功能。
- 细胞功能分析与分选 (Functional Analysis and Sorting): 利用流式细胞术 (Flow Cytometry) 对细胞进行多参数分析(如表面/内部蛋白表达)、计数、活力评估,并通过荧光激活细胞分选(FACS)技术实现高纯度目标细胞群的分离。
- 转化医学与药物开发 (Translational Medicine & Drug Development):
- 细胞治疗 (Cell Therapy): 将分离、纯化甚至基因改造后的功能性细胞(如CAR-T细胞)回输至患者体内。
- 药物筛选 (Drug Screening): 利用初代细胞作为更具生理相关性的模型,评估候选药物的有效性和毒性。

表 应用导向的细胞制备方案优化