魏则西事件?诺贝尔奖的癌症免疫疗法表示,这锅我不背
丁香园
癌症可以说是人类健康的最大威胁之一了,每年因为癌症的死亡人数达到数百万人。癌症免疫疗法已经成为当今世界上最有前景的癌症治疗方法之一。两位做出突出贡献的科学家,本庶佑(Tasuku Honjo) 和 詹姆斯 · 艾利森(James P. Allison)也获得了 2018 年诺贝尔生理或医学奖。
诺奖官推发文祝贺两位获奖者 图源 Nature
然而,声名大噪的癌症免疫检查点阻断疗法是什么?又是什么原理呢?这个疗法跟 「魏则西事件」中出现的生物免疫疗法有什么区别和联系呢?
本文就从人体的免疫系统说起,循序渐进地为大家解析这些问题。免疫系统是由人体的免疫器官和细胞组成的防御体系,能够抵挡病毒,细菌等抗原的入侵。癌细胞也是抗原的一种,但是癌细胞要比一般的抗原难搞的多。可参考昨天的推文:癌症免疫疗法获得 2018 诺贝尔生理或医学奖
・・・
癌症免疫疗法的原理
再高超的伪装也会有一些破绽,露出些许马脚——癌细胞能够分泌新生抗原(neoantigens),这是一类由于基因突变或者转录翻译过程中出现错乱而产生的蛋白。
由于和正常的蛋白有差别,免疫系统会识别出来。但是癌细胞并不会善罢甘休——在许多情况下,它会诱导正常的细胞也产生类似的抗原,以至于人体的免疫系统不能发动大规模的清扫行动,除去这些癌细胞。这是免疫系统对自身细胞的保护机制。这个保护机制的核心成分就是 T 细胞[3-5]。
T 细胞会表达 T 细胞受体(T-cell receptors 简称,TCRs)告诉免疫系统:「这是友军,不能开炮!」但是,免疫系统不会存储含有高效 TCRs 的 T 细胞,只有那些含有低亲和力 TCRs 的 T 细胞存在人类的免疫系统中。这也是人体免疫系统在抗击抗原和保护自身细胞之间做出的平衡。
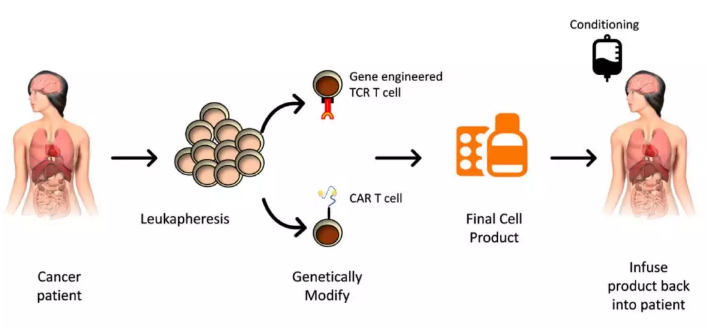
过继细胞疗法 (Michaela E. Sharpe.2018)
・・・
过继细胞疗法
那么,既然癌细胞能够利用免疫系统逃脱监管,科学家也可以利用免疫系统让癌细胞「束手就擒」——这就是所谓的癌症免疫疗法。癌症免疫疗法的策略包括[6]
1)通过基因工程手段改造 T 细胞,然后杀死癌细胞,即所谓的过继细胞免疫疗法。这种方法一般是抽取患者的 T 细胞,经过体外培养和基因工程改造以后,再注射到人体内。这种方法副作用很大,而且价格昂贵;
2)通过给人体直接注射白细胞介素 2(IL-2)或干扰素等细胞因子,增强人体的免疫,即所谓的非特异性免疫激活剂。缺点是没有特异性,效果较差,会产生严重的副作用;
3)设计或筛选能够直接改变 T 细胞的药物,阻断免疫抑制机制,告诉免疫系统:那不是友军,开炮!。这即是免疫检查点阻断剂疗法,缺点就是「敌我不分」,友军(正常的细胞)也会被连累;
4)最后一种策略是开发癌症疫苗,就如同乙肝疫苗,通过弱化的病毒来诱导人体的免疫系统一样,这是一个完美的策略,但目前美国食品药品管理局(FDA)只批准了 4 种,其中 3 种都是预防疫苗,真正针对癌细胞本身的只有 Provenge,但也仅仅能提高前列腺癌症患者 4 个月的生存期。
本次获奖的就是免疫检查点阻断疗法,虽然有缺陷,但优势大于劣势,仍然是目前比较有效的一种治疗方案。
・・・
免疫检查点阻断疗法
上文提到,人体免疫系统在抗击抗原和保护自身细胞之间做出的平衡,也就是控制 T 细胞分化。在做出相关决策之前,免疫系统会有一个审查机制,以了解人体内细胞的总体状态。这个审查机制需要很多蛋白分子的参与。
其中比较重要的就是被称为免疫检查点(immunecheckpoints)的蛋白分子[7],这些蛋白能够发出信号或者拒绝信号,目前研究最多的就是 CTLA-4 (cytotoxic T lymphocyteantigen 4),PD-1 (Programmed Death 1) 以及它的配体 PD-L12。也是两位诺奖获奖人的主要发现。CTLA-4 和 PD-1 在两个完全不同的信号通路中[8]。这也是两位科学家能同时获奖的原因之一。
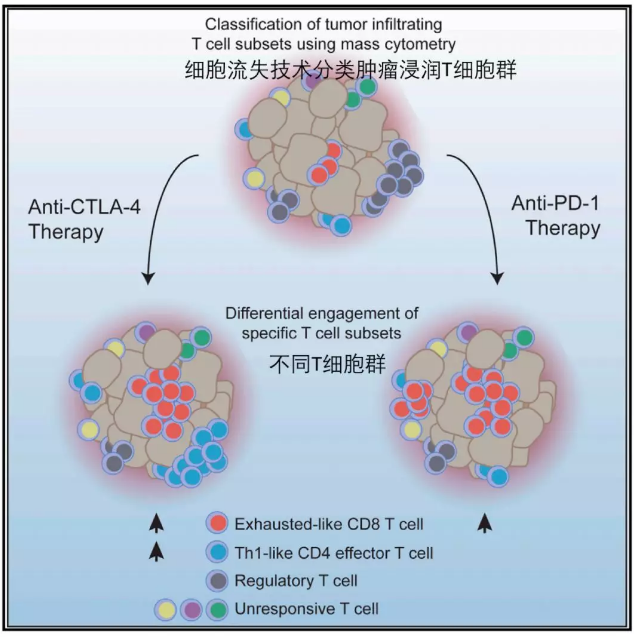
CTLA-4 和 PD-1 两种治疗方案分子机制不同 (Wei, et al., Cell,2017)
CTLA-4
CTLA-4 基因定位于 2 号染色体长臂 33 带 (2q33) ,主要表达于活化的 T 细胞表面,与 T 细胞表面的协同刺激分子受体(CD28)具有高度的同源性。
CTLA-4 和 CD28 均为免疫球蛋白超家族成员,二者与相同的配体 CD86 和 CD80 结合。与 CD28 的功能相反,CTLA-4 与 B7 分子结合后抑制 T 细胞活化。
CTLA-4 的作用机制尚未完全阐明,认为有以下几种可能[8,9]:
1) 通过其胞外域起竞争配体作用:CTLA4 与 B7 分子具有高度的亲合力,与 CD28 竞争结合抗原提呈细胞上的 B7 家族分子,阻断 CD28 与 B7 的信号传导通路,防止 CD28 分子促进 T 细胞激活。
2) 抑制 IL-2 的产生实现负性调节作用。
3) 抑制 T 细胞从 G 期进入 S 期,从而抑制 T 细胞的增殖、活化。
2011 年 FDA 批准了新药 Yervoy,即 CTLA-4 的抗体,主要用于晚期黑色素瘤的治疗。Yervoy 是商品名,又称 Ipilimumab,能够抑制 CTLA-4,消除 T 细胞的抑制效应,从而达到引导免疫系统杀死癌细胞的目的。
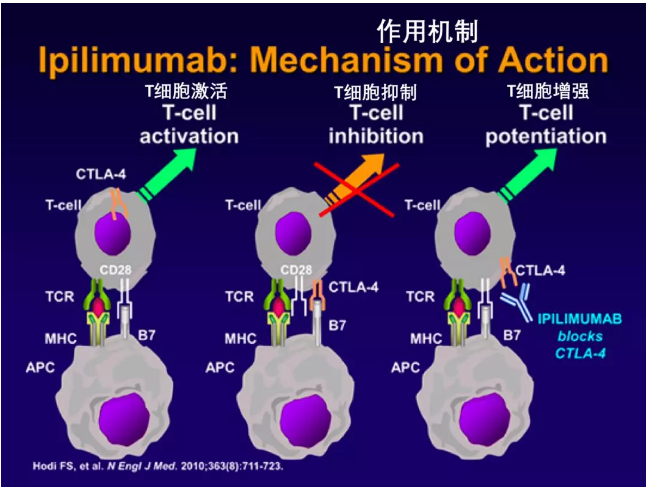
PD-1
PD-1 基因由日本京都大学本庶佑(HonjoTasuku)教授团队于 1992 年通过消减杂交技术首次发现,表明 PD-1 基因是免疫球蛋白超家族中的新基因,该基因的活化可能参与经典的程序性细胞死亡,并认为 PD-1 基因是细胞死亡的诱导者。研究结果发表于 1992 年的 EMBO Journal。
随后的研究发现,PD-1 是一个诱导表达蛋白,它有两个配体 PD-L1 和 PD-L2,其中 PD-1 与 PD-L1 相互作用,抑制 CD4 + 和 CD8+T 细胞的增殖和 IL-2 的分泌,使细胞周期停留在 G0-G1 期,但不会增加细胞的死亡。PD-1 的单克隆抗体能够阻断 PD-1 与配体的结合,而抗 PD-L1 的单克隆抗体可以阻断 PD-L1 与 PD-1、CD80 的相互作用[10,11],从而解除对 T 细胞的抑制。
截至到 2017 年 3 月,获批的 PD-1/PD-L1 免疫药物已经有四个,分别是 Nivolumab(Opdivo),Pembrolizumab(Keytruda),Atezolizumab(Tecentriq)和 Avelumab(Bavencio),前两个为抗 PD-1 抗体,后两个为抗 PD-L1 抗体。
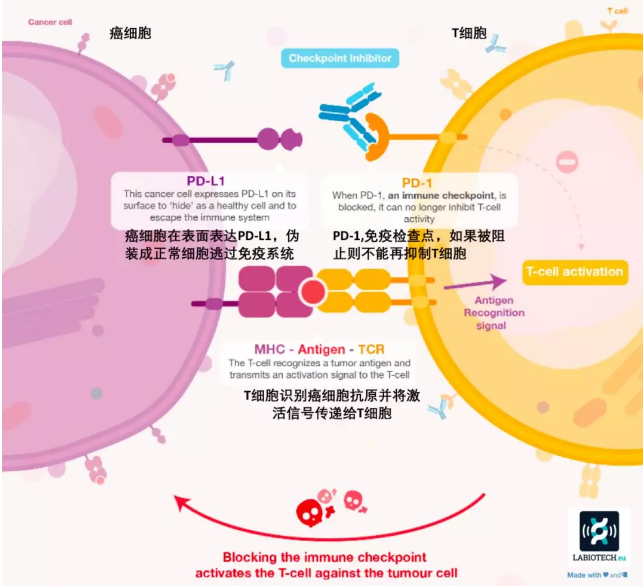
PD-1 和 PD-L1 的作用机制图源 labiotech.eu
・・・
魏则西事件
魏则西事件曾在 2016 年成为轰动中国的恶性事件,而导致魏则西最终死亡的生物免疫疗法,到底和现状甚嚣尘上的免疫检查点疗法有什么区别和联系呢?
魏则西采用的生物免疫疗法即 DC-CIK(Dendritic Cell(DC),Cytokine Induce Killer cells (CIK))。
DC 细胞是一种抗原递呈细胞,参与抗原的识别、加工处理与递呈,能够刺激初始型 T 细胞增殖活化,产生抗原特异性细胞毒性 T 细胞,帮助机体对抗原的清除。
CIK 细胞是在多种细胞因子(如白介素、干扰素)等刺激下,由外周血分离出来的单个核细胞在体外培养扩增而成,主要是 CD3+ 和 CD56+ 的一群异质性细胞,具有一定的非特异的抗肿瘤活性。DC 能够识别抗原、激发特异性免疫系统,CIK 细胞可以通过发挥自身细胞毒性和分泌细胞因子等途径杀伤肿瘤细胞。
将二者分别培养,联合回输,理论上可以起到相辅相成的共同对抗肿瘤的效果。这种疗法类似于上文提到的过继免疫细胞疗法,跟免疫检查点疗法没有关系。
由于其高昂的治疗成本和极低的治疗效果,早在 2010 年前后,相关公司就已经破产,DC-CIK 疗法也被淘汰。另外,大家需要注意的是截止到 2018 年,我国尚无企业或医院有资质进行细胞免疫疗法治疗癌症。国家有关部门仅在 2017 年发布一个试行的细胞治疗领域的指导原则。
魏则西事件的发生,本质上是因为无良医院打着免疫治疗的幌子,将外国淘汰的技术不经临床实验直接用于人体治疗的结果。
・・・
攻克癌症还需要更多努力
虽然,癌症免疫疗法尤其以上两种治疗策略已经在临床上取得很大的成功,但是,我们离攻克癌症似乎还有很长的一段路程。若说以前的治疗方法能让患者多活几个月,那么癌症免疫疗法可能能让人多活几年12 。
此外,正像我在开头提到的,虽然根据 CALT-4 和 PD-1/PD-L1 开发的药物能够在一定程度上缓解患者的症状,但是并不能根治,而且还有很强的副作用。因为本质上,这种方法就是人为的破坏人体的免疫保护机制,在杀死癌细胞的同时也对正常细胞产生攻击。
在 Yervoy 官网我们很容易地能找到,这种药物所产生的副作用,这些副作用有时会非常严重,甚至是致命的。好在,这种副作用产生的概率是比较小的。
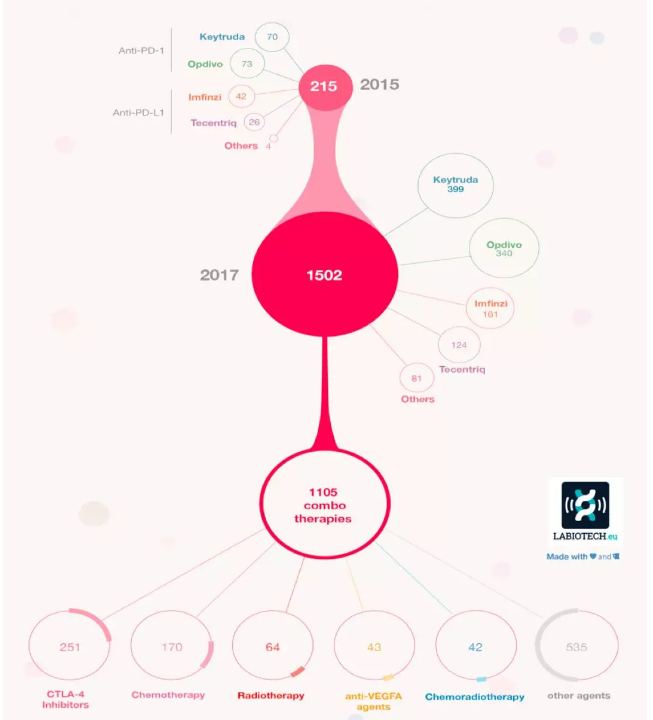
2015 年大约有 215 个癌症临床研究,到了 2017 年增加到 1502 个,其中有 1105 个都是关于癌症组合疗法的研究 图源 labiotech.eu
最后,虽然两位科学家获得了诺奖的桂冠,但为这个领域做出突出贡献的还有许多。比如达纳 - 法伯癌症中心的著名免疫学家 Gordon Freeman,哈佛医学院的免疫学家 Arlene Sharpe 以及耶鲁大学的陈列平教授。
陈列平教授也是研究 PD-1 的,同时首次发现了 PD-1 的配体 PD-L1,其贡献是非常突出的。虽然有些遗憾,Gordon Freeman 在采访中仍表示了对 Allison 的祝贺,以及对其工作的赞赏。总之,虽然很多人仍有遗憾,但不管怎样,人们都不会忘记那些为人类做出突出贡献科学家们的。