4.15 丁香实验科研资讯早报(每日更新)
互联网
4月15日 丁香实验科研早报
① Science杂志最受关注的文章(4月)
星形胶质细胞是中枢神经系统中的非神经元细胞,其支持及调节了神经元的功能。2013年,杜克大学的研究人员证实星形胶质细胞是中风或脑损伤后止血和促进修复的必要条件。
美国的《Science》杂志由爱迪生投资创办,是国际上著名的自然科学综合类学术期刊,与英国的《Nature》杂志被誉为世界上两大自然科学顶级杂志。Science杂志主要发表原始性科学成果、新闻和评论,许多世界上重要的科学报道都是首先出现在Science杂志上的,比如艾滋病与人类免疫缺陷病毒之间的关系,标志性基因组研究成果等。Science杂志近期下载量最多的文章包括:
Neurons diversify astrocytes in the adult brain through sonic hedgehog signaling
星形胶质细胞是中枢神经系统中的非神经元细胞,其支持及调节了神经元的功能。2013年,杜克大学的研究人员证实星形胶质细胞是中风或脑损伤后止血和促进修复的必要条件。
一项研究表明,成年小鼠大脑中的一些神经元塑造了附近星形胶质细胞的一些特征和生理。加拿大麦吉尔大学的研究人员和同事们,鉴别出由神经元分泌的一种叫做sonic hedgehog (Shh)的分子信号促成了这些改变。
“这篇论文令人兴奋之处在于,细胞在已经确立了在大脑中的形态和位置后,其命运有可能由它与邻居之间的互作所决定。且这种转换并非微不足道,它似乎从根本上重组了细胞的转录组。”
哺乳动物大脑有各种星形胶质细胞,执行多种多样专门的功能。新研究的领导者、麦吉尔大学的Keith Murai说,这种多样性很大程度上被认为是在胚胎发育及出生后早期发育过程中建立起来的。“但在那以后,人们认为这些细胞的一些特征在它们往后的一生中都是固化的。”
MuraiI和同事们却持不同的观点。“某些神经回路周围的星形胶质细胞如此特化,很难想象所有这些细胞的特性都是在发育中的这一时间点所决定。毕竟,神经回路自身直到很久以后才完全形成。”
为了调查围产期之后星形胶质细胞的身份是否有可能继续被塑造,Murai研究小组搜寻了在成体神经元和星形胶质细胞中有可能控制了继续发育的基因产物。为了简化问题,研究人员将焦点放到了小脑皮质上:在这一区域只存在两种星形胶质细胞:Bergmann胶质细胞,其环绕着浦肯野细胞(PCs)的神经冲动接收区;和velate星形胶质细胞(VAs),其围绕着颗粒细胞(GCs)。他们的搜寻结果揭示出了许多的候选因子,而有一个信号通路浮现了出来:Shh信号。
High-fructose corn syrupenhances intestinal tumor growth in mice
糖真的会直接促进癌症的生长吗?贝勒医学院和康奈尔大学医学院领导的一项研究表明,对于这个问题的答案,至少在小鼠身上是肯定的。研究人员指出每日摄入一定量的高果糖玉米糖浆(high-fructose corn syrup,高果糖浆),也就是相当于每天饮用约12盎司含糖饮料的个体,会加速肠道肿瘤的生长,这种作用与肥胖不同。
领导这一研究的是贝勒医学院Jihye Yun博士,她表示,“越来越多的观察性研究指出了饮用含糖饮料,肥胖和结直肠癌风险之间的关系,但是目前的观点是认为这主要因为摄入过多糖会导致肥胖,确实,肥胖增加了包括结肠直肠癌在内的多种癌症的风险,然而我们不确定是否存在直接和因果联系。”
Motor cortical control of vocal interaction in neotropical singing mice
来自麻省理工学院的进化发育生物学家Mansi Srivastava研究组近期发现了大量调控全身再生基因的DNA开关。
他们采用的是three-banded panther worms,一种研究再生的模式动物,研究发现一段非编码DNA可以调控一种被称为早期生长反应(early growth response,EGR)的“主控基因”,一旦EGR被激活,就可以调控其它基因,打开或关闭许多生理过程。
Srivastava表示,“观察自然界经常会提出这样一个问题,那就是为什么壁虎能做到,为什么我们不能?有许多物种可以再生,也有许多物种不能再生,事实证明,如果你比较所有动物的基因组,就会发现我们大多数的基因其实都差不多,因此我们认为这其中的答案可能并不是说某些基因是否存在,而是它们如何连接在一起的,也就是答案来自于基因组的非编码部分。”
“要使这个过程起作用,细胞中的DNA通常需要被紧密折叠和压实,”文章的另外一位作者,Andrew Gehrke说,“基因组中许多包装非常紧密的区域实际上变得可以更开放,因为那里有监管开关,打开或关闭基因。因此,本文的一个重要发现就是基因组实际上处于一种非常动态的状态中,在再生过程中真正发生变化的是不同的区域。”
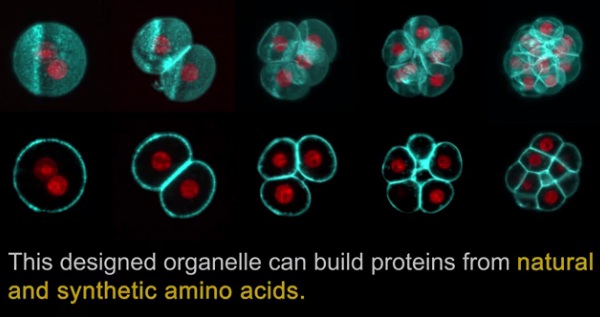
Designer membraneless organelles enable codon reassignment of selected mRNAs in eukaryotes
科学家们第一次将复杂的翻译过程设计成一个哺乳动物细胞中的人工合成细胞器。欧洲分子生物学实验室(EMBL)的Lemke小组与JGU Mainz和IMB Mainz合作进行了研究,利用这项技术创造了一种无膜细胞器,可以利用天然氨基酸和合成氨基酸构建蛋白质,具有新的功能。他们的研究结果发表在3月29日的Science杂志上,使科学家能够更详细地研究、调整和控制细胞功能。
在进化过程中,新细胞器的发展使得细胞和生物体变得更加复杂,这是因为它们能够将细胞过程分类到特定的进化热点中。“我们的工具可以用于工程学上的翻译,但也可能用于其他细胞过程,如转录和翻译后修饰。这甚至可以让我们设计出新型的细胞器,扩展复杂生物系统的功能。”EMBL和JGU Mainz的博士生,该文章的共同第一作者Christopher Reinkemeier说,“举例来说,我们可以通过含荧光分子基团的氨基酸,利用成像方法窥视细胞内部。”
“细胞器可以利用合成的非典型氨基酸来制造蛋白质。目前我们知道有300多种不同的非标准氨基酸,而天然存在的只有20种氨基酸。我们将不再局限于自然界存在的氨基酸,”文章的共一作Gemma Estrada Girona说。“我们介绍的新颖之处是能够在有限的空间中使用它们,即细胞器,这样将对宿主的影响降到最低。”
②《Science》杂志发表的一项研究揭示了大脑中的关键“电子开关”
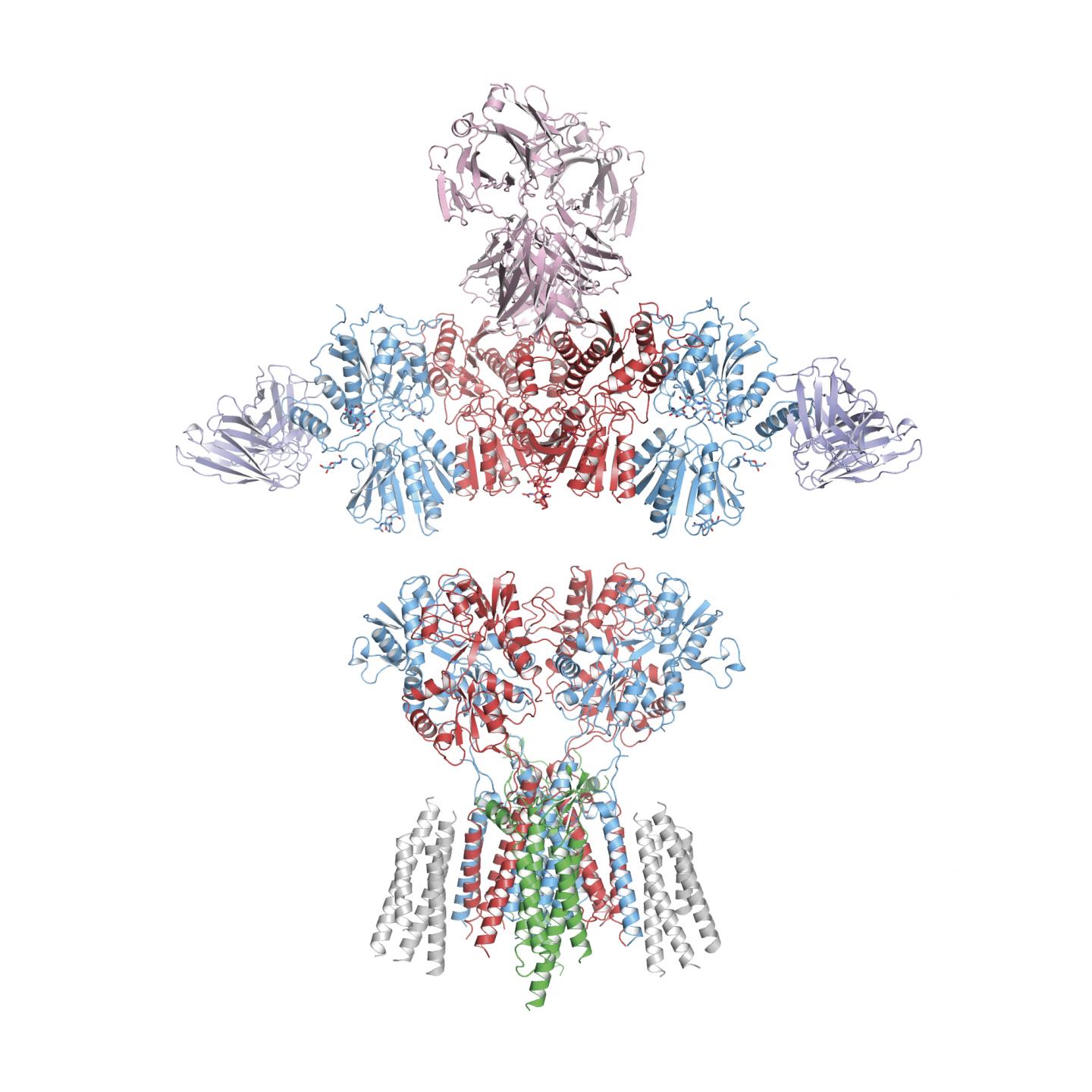
啮齿类动物模型中AMPA受体的天然结构可能有望解开阿尔茨海默病等疾病背后的真正机制。
科学家揭示了大脑中与学习、记忆、行为和情绪相关的关键受体的结构。
这项发表在《Science》杂志上的新研究首次揭示了AMPA受体在其天然状态下的结构。这一发现可能导致人们对神经系统紊乱和疾病背后的机制有了新的认识。
“这些是大脑的基本电子开关,”通讯作者、Jennifer和Bernard Lacroute神经科学终身席位高级科学家、霍华德休斯医学院研究员Eric Gouuux说。“如果这些开关不能正常工作,那么大脑就不能正常工作。它会导致癫痫发作、记忆力丧失和神经退行性疾病,如阿尔茨海默。”
俄勒冈健康与科学大学(OHSU)和美国能源部太平洋西北国家实验室的研究人员使用低温电子显微镜和靶向质谱来揭示啮齿类动物AMPA受体的结构和亚单位排列。AMPA受体被神经递质谷氨酸激活,形成可渗透的离子通道,在整个神经系统的细胞间传递信号。
通过辨别啮齿类动物的工作结构组成,科学家可以在人脑的尸检样本中分离出相同的结构,并进行了比较。随后,研究人员很快就会发现健康AMPA受体的结构和组织与神经退行性疾病患者的结构和组织之间的差异,事实上,OHSU的科学家们正在进行这项工作。
“这太令人兴奋了,”OHSU说。“我们还不能肯定,但我们要做的是了解这些受体在人类毁灭性疾病中的不同,这些疾病目前几乎没有治疗方法。如果我们能对这种疾病的机制有了新的认识,它将为治疗提供新的方向。”
这项新发现是通过一项正在彻底改变结构生物学领域的技术实现的。
低温冷冻电镜(cryo-EM)大大提高了科学家辨别自然或自然状态下单个受体的能力。以前,Gouaux依靠X射线结晶学来观察中枢神经系统的重要结构,然而,这项技术要求科学家们将大量相同的分子堆积起来,使它们能够结晶,从而形成一幅关于它们自身结构的人造图像。
cryo-EM使科学家能够看到原子细节附近的分子。
“这是一种敏感的技术,你只需要少量的分子,”Gouaux说。”现在我们可以检查真正的受体,因为它存在于其天然状态下。”
原文检索:Architecture and subunit arrangement of native AMPA receptors elucidated by cryo-EM
③ DNA测序是否破解了史上著名的悬案?
法医科学家近日宣称,他们已经确定了开膛手杰克(Jack the Ripper)的身份。这个臭名昭著的连环杀人犯在1888年相继杀害了五名女性,却始终未落入法网,一度引起英国社会的恐慌。
最近发表的遗传学检测将凶手的真实身份指向了当时23岁的波兰理发师Aaron Kosminski(亚伦•科斯明斯基),同时他也是警方的主要嫌疑人。不过,批评人士认为这些证据不足以宣布此案件结案。
让科学家得出结论的证据来自一条丝质披肩,它是在第四名受害者Catherine Eddowes的尸体旁发现的。披肩上沾有血液和精液,而后者被认为来自凶手。在前后三个月内,另外四名女性也被残忍地杀害。
Kosminski被认为是凶手,其实并非第一次。不过,支持性的DNA证据在同行评审的期刊上发表,还真的是第一次。
作家Russell Edwards在2007年买下披肩,并将它交给英国利物浦约翰摩尔斯大学的生物化学家Jari Louhelainen。Louhelainen对披肩上的样本进行了遗传学检测,但是未公布检测结果。Edwards在2014年出版了《Naming Jack the Ripper》一书,认为Kosminski正是开膛手杰克。不过,遗传学家认为检测细节太少,不予置评。
近期发表在《Journal of Forensic Sciences》的文章则提供了更多细节。Jari Louhelainen以及英国利兹大学的生殖专家David Miller表示,这是“到目前为止关于开膛手杰克谋杀案的最系统且最先进的遗传分析”。
研究人员提取并扩增了披肩上的DNA。他们将来自披肩的线粒体DNA片段与受害人Eddowes和嫌疑人Kosminski后代的线粒体DNA片段进行比较。他们发现,披肩上的DNA片段与Kosminski的后代相匹配。
分析还表明,凶手是一名有着棕色头发和棕色眼睛的男子,这与目击者的描述相一致。“这些特征肯定不是唯一的,”作者在文章中承认。不过他们指出,在英格兰,棕色眼睛不如蓝色眼睛常见。
然而,这些结果却无法让批评人士满意。文章并没有提供如何比较DNA样本以及发现遗传变异的关键细节。相反,作者用一张图片来表示,上面布满了彩色框框。他们说,框框重叠的地方就表示披肩DNA和现代DNA序列相匹配。
作者并没有公布Eddowes和Kosminski后代的线粒体DNA序列,理由是保护个人隐私。他们在文章中引用了英国的《数据保护法案》。同时,他们认为,图片结果更有利于非科学家理解,特别是那些对犯罪感兴趣的人。
奥地利因斯布鲁克医科大学的专家Hansi Weissensteiner对线粒体DNA分析提出质疑。他认为这只能可靠地证明两个DNA样本是无关的。“基于线粒体DNA,人们只能排除嫌疑人。”换句话说,披肩上的线粒体DNA可能来自Kosminski,但也可能来自当时居住在伦敦的几千人。
另外一些批评人士指出,没有证据表明披肩曾经出现在犯罪现场。况且案件已发生了很多年,披肩或许早已被污染。
尽管这篇文章受到了广泛关注,但作者否认该研究是基于犯罪学动机而开展的。“此项目的最初目的并不是要破获开膛手杰克谋杀案,而是要评估科学可以延伸到多远,如何分析100多年前的痕量样本,”他们解释说。
总而言之,开膛手杰克的真实身份仍然无法确定。不过,DNA测序也许能解开其他的历史谜团,帮助遗传学家成为现代福尔摩斯。(生物通 薄荷)
原文检索
Forensic Investigation of a Shawl Linked to the “Jack the Ripper” Murders
J. Forensic Sci. doi: 10.1111/1556-4029.14038 (2019)
④ CRISPR-Cas3有治愈疾病潜力
康奈尔大学开发新型基因编辑CRISPR系统的领导者们首次在人类细胞上使用了这种新方法,是该领域的一个重大进展。
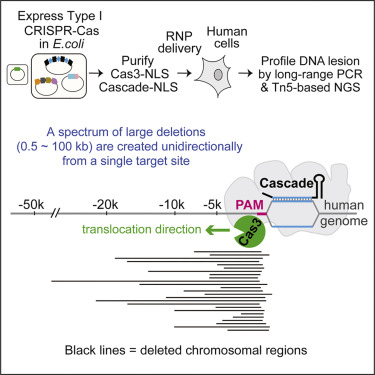
新系统被称为CRISPR-Cas3,可以有效地清除人类基因组中一个目标位置的长片段DNA,这种能力对传统的CRISPR-Cas9来说不容易实现。新系统有潜力找出并清除单纯疱疹、艾巴氏病毒和乙型肝炎病毒等异位病毒,这些病毒都属是公共卫生的主要威胁所在。
“过去十年,我的实验室一直在研究CRISPR-Cas3的工作原理,”分子生物学和遗传学教授4月8日发表在《Molecular Cell》杂志上这篇论文的通讯作者、Ailong Ke说。“我很高兴我的同事和我终于证明了它在人类细胞中的基因组编辑活性。我们的工具可以特异地针对这些病毒,然后非常有效地清除它们。理论上,它可以为这些病毒性疾病提供治疗方法。”
CRISPR-Cas3技术还允许研究人员扫描基因组并检测非编码遗传元件,这些元件占我们基因组的98%,但还没有被很好的表征。作为调控编码基因中蛋白质表达的调节因子,非编码DNA已经被发现是细胞分化和性别决定的关键。
CRISPR-Cas3可以有效地筛选非编码遗传元件和长序列DNA。一旦被删除,研究人员可能会观察到有机体中缺失的功能,以确定该遗传元件的作用。
Yan Zhang,密歇根大学生物化学副教授,也是本文的通讯作者之一,文章一作是Ke实验室的研究生dam Dolan和Zhang实验室的Zhonggang Hou。

CRISPR-Cas9系统使用细菌RNA作为引导,配对并识别DNA序列。当发现匹配时,引导RNA将CRISPR相关(Cas)蛋白质引导到精确的DNA串。一旦定位,Cas9蛋白就在正确的位置剪断目标DNA。CRISPR-Cas3使用相同的机制来定位特定的DNA序列,然而,它的核酸酶不是将DNA一分为二,而是连续擦除DNA,最多可擦除100kb。
Ke、Zhang和他们的同事首次成功地删除了人类胚胎干细胞和另一种称为HAP1的细胞类型中高达100kb的靶向DNA序列。
尽管CRISPR-Cas3拥有比CRISPR-Cas9更有效的基因组编辑潜力,研究人员还正在努力控制删除片段的长度。”我们不能精确地定义删除边界,这在治疗上是一个缺点。
该基因组编辑工具专利已通过“技术许可中心”审批。
原文检索:Introducing a Spectrum of Long-Range Genomic Deletions in Human Embryonic Stem Cells Using Type I CRISPR-Cas
⑤ 在小鼠体内,消除受损线粒体可减轻慢性炎症性疾病
胆碱激酶抑制剂的治疗能促使免疫细胞清除受损线粒体,从而降低NLRP3的炎症激活,预防炎症。
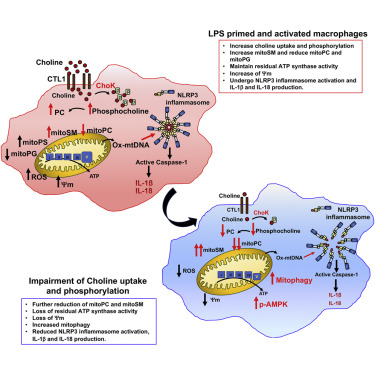
炎症是一种平衡的生理反应——身体需要它来消除入侵生物体和外来刺激物,但是过度的炎症会损害健康的细胞,导致衰老和慢性疾病。为了帮助控制炎症,免疫细胞使用一种叫做NLRP3炎症小体的分子机器。在健康的细胞中,NLRP3是没有活性的,但是当细胞的线粒体(产生能量的细胞器)受到压力或细菌毒素的损伤时,它会被激活。
然而,当NLRP3炎症小体一直处在激活的状态时,它会导致一些慢性炎症状态,包括痛风、骨关节炎、脂肪肝疾病和阿尔茨海默症和帕金森病。在一项新的小鼠研究中,加州大学圣地亚哥医学院的研究人员发现了一种独特的方法,可以帮助治疗一些慢性炎症疾病:在激活NLRP3炎症小体之前,迫使细胞清除受损的线粒体。
该研究发表在Cell Metabolism杂志上,由通讯作者,著名药理学和病理学教授Michael Karin博士以及第一作者Elsa Sanchez Lopez博士领导,他是Karin实验室的博士后研究人员。
在2018年发表在Nature杂志上的一项研究中,Karin团队发现受损的线粒体激活了NLRP3的炎症小体。研究人员还发现,当细胞内部物质循环再利用过程(称为线粒体自噬)移除线粒体时,NLRP3的炎症小体会被解除激活。
“在那之后,我们想知道我们是否可以通过促进线粒体自噬来减少有害的过度炎症,线粒体自噬可以消除受损的线粒体,进而先发制人地抑制NLRP3炎症激活。” Karin说,“但当时我们没有一个很好的方法来诱导线粒体自噬。”
最近,Sanchez-Lopez正在研究巨噬细胞如何调节其对胆碱的摄取,胆碱是新陈代谢的关键营养素,这里她发现了能引起线粒体自噬的东西:胆碱激酶(ChoK)的抑制剂。随着ChoK的抑制,胆碱不再与线粒体膜结合。结果,细胞就会检测到线粒体受损,并通过自噬将其清除。
“最重要的是,通过ChoK抑制剂来去除受损的线粒体,我们最终能够抑制NLRP3炎症激活,”Karin说。
为了测试这些抑制剂在体内控制NLRP3炎症小体的新能力,研究人员转向小鼠。他们发现用ChoK抑制剂治疗可以预防由尿酸(尿酸的积聚会引起痛风发作)和细菌毒素引起的急性炎症。
通过几项检测,发现ChoK抑制剂治疗还可以逆转遗传疾病Muckle-Well 综合征相关的慢性炎症,这种疾病是由NLRP3基因突变引起的。其中一个检测方法是脾脏的大小——脾脏越大,炎症就越多。Muckle-Well 综合征小鼠脾脏平均比正常小鼠大两倍,但经ChoK抑制剂处理后脾脏大小恢复正常。
NLRP3炎症小体促进炎症,因为它会触发释放两种称为细胞因子的非常有效的促炎分子的释放:白细胞介素IL-1和IL-18。根据Karin的说法,现有的药物可以阻断IL-1但不能阻断IL-18。他的团队发现,ChoK抑制剂可以降低这两种细胞因子。
“有几种疾病,包括红斑狼疮和骨关节炎,其治疗可能需要同时抑制IL-1和IL-18”Karin说。
加州大学圣地亚哥分校正在申请一项专利,涉及使用CTL1和/或胆碱激酶遗传/化学抑制剂治疗NLRP3炎性小体相关疾病。
原文检索:Choline Uptake and Metabolism Modulate Macrophage IL-1β and IL-18 Production
⑥ 断裂的线粒体用“吃我”蛋白质召唤“死神”
当线粒体受损时,它们通过向细胞蛋白发送信号来降解线粒体,从而避免引起进一步问题。在2019年4月11日发表在《Developmental Cell》杂志上的一篇论文中,挪威科学家报告说他们发现了细胞是如何触发这个过程的,这个过程被称为线粒体自噬(mitophagy)。
在线粒体断裂的细胞中,两种蛋白质——NIPSNAP 1和NIPSNAP 2——积聚在线粒体表面,起到“吃我”信号的作用,招募破坏它们的细胞机制。
NIPSNAP 1和2通常存在于健康的线粒体内,尽管它们在细胞内的功能未知,”奥斯陆大学(University of Oslo)基础医学科学研究所分子医学系教授Anne Simonsen说。“当细胞的呼吸链被破坏,线粒体受损时,这些蛋白质进入线粒体的基质和内膜空间就会被中断。在这种情况下,输入系统不起作用,它们仍然与受损线粒体表面结合,发出线粒体自噬信号。”
在这项研究中,研究人员研究了人类的Hela细胞,其中NIPSNAP 1和NIPSNAP 2功能都被消除了。”当我们这样做的时候,这些细胞在损伤后不能清除线粒体,”Simonsen说。然而,在含有功能性NIPSNAP蛋白的细胞中,当通过添加化学干扰剂诱导线粒体自噬后,他们观察到了NIPSNAP蛋白与PINK和PARKIN蛋白的协同作用,这些蛋白已知在触发自噬和在帕金森病中起作用。
PARKIN用泛素标记细胞,泛素是一种引导细胞降解的小蛋白。“泛素是招募自噬的经典信号,”共同作者、北极挪威大学特罗姆大学(University of Tromsø - The Arctic University of Norway)的Terje Johansen说。“我们发现,除了泛素外,NIPSNAP蛋白还需要招募自噬蛋白;除非这些NIPSNAP蛋白在线粒体表面被发现,否则它们不会针对线粒体。”
研究小组通过研究斑马鱼动物模型的NIPSNAP/PINK/PARKIN机制,证明这一发现在体内具有重要的生理意义。他们比较了野生型斑马鱼和NIPSNAP 1蛋白丰度降低的鱼系。
Simonsen说:“我们发现缺乏足够功能的NIPSNAP 1的突变鱼不能像野生型鱼那样移动。”它们具有帕金森样表型,多巴胺能神经元数量减少。然而,可以通过在水中加入左旋多巴(L-DOPA)来修复这种运动缺陷,左旋多巴是治疗人类帕金森病的同一种化合物。
更引人注目的是,完全缺乏NIPSNAP 1蛋白的动物在5天内死亡,”显然,线粒体的清除对于这些多巴胺能神经元的健康是重要的。这一点尤其重要,因为神经元通常不能分裂,”Johansen说。作为进化上保守的蛋白质,NIPSNAP蛋白质遍布动物界,包括人类。
原文检索:Developmental Cell, Abudu, Pankiv, and Mathai et al. NIPSNAP1 and NIPSNAP2 act as "eat me" signals for mitophagy
⑦ Blood:蛋白磷酸酶PTENα的调控新作用
研究人员首次揭示PTEN家族成员PTENα蛋白在调控中性粒细胞趋化过程中的重要作用,并推动了中性粒细胞趋化作用这一研究领域的重要进展。
PTEN蛋白是广为人知的抑癌因子,主要在PI3K/AKT通路上发挥重要的拮抗作用。PTEN在各种类型的肿瘤中发生高频突变,同时亦参与各类重要生理功能的调控作用。中性粒细胞是一类具有强大的趋化作用的细胞,在机体识别、抵抗清除入侵的病原体,抗细菌感染过程中发挥重要的作用。中性粒细胞趋化性主要需要依赖细胞正确识别趋化方向、正常产生细胞极性和有效形成伪足三方面的功能相互协调才可正常执行。
来自北京大学基础医学院系统生物医学研究所的尹玉新课题组近年来陆续鉴定了PTEN家族新亚型,为研究PTEN家族成员的新功能开启了新领域。
PTENα是尹玉新团队在2014年鉴定的PTEN家族第一个亚型蛋白。首先,通过检测 PTENα的组织分布,他们发现PTENα在免疫组织中,特别是骨髓组织中,呈现高表达。之后他们又通过质谱检测发现PTENα 与一类细胞骨架连接蛋白ERM家族蛋白呈现高度亲和,他们证实PTENα可以特异性结合ERM家族成员Moesin。
在最新一项研究:“PTENα promotes neutrophil chemotaxis through regulation of cell deformability”中,尹玉新课题组首次揭示PTEN家族成员PTENα蛋白在调控中性粒细胞趋化过程中的重要作用,并推动了中性粒细胞趋化作用这一研究领域的重要进展。
这一研究成果公布在Blood杂志上。
Moesin在细胞运动、伪足形成过程中起着重要作用,其发挥功能主要依赖于 T558 位点的磷酸化。对于静息态的中性粒细胞,磷酸化的Moesin 均匀分布在细胞膜内壁,当在趋化因子的刺激下,Moesin被快速去磷酸化,从而实现细胞形态的改变,促进趋化作用。
研究发现,PTENα磷酸酶可以去特异性去磷酸化Moesin T558位点。多种体内体外趋化实验显示,PTENα缺失的中性粒细胞的趋化能力明显弱于正常的中性粒细胞。在沙门氏菌感染小鼠诱导的败血症模型中,当 PTENα缺失时,实验小鼠对于细菌的抵抗能力大大下降,生存时间明显减少。
综上所述,PTENα通过调节Moesin促进中性粒细胞的趋化过程,进而在机体抗细菌感染中发挥重要作用。这一研究证明PTENα作为Moesin的磷酸酶,通过非依赖于PI3K的信号通路调控中性粒细胞趋化。而且,PTENα与PTEN虽然具有完全一致的功能结构域,但由于其亚细胞定位或作用的靶蛋白不同,可发挥相互独立又互相补充的重要生理功能。PTEN在中性粒细胞趋化性的调控中,主要决定其细胞是否能够明确趋化方向,而PTENα则主要决定趋化细胞是否能够有效形成伪足,发生明确的细胞变形并协助细胞运动,两者相辅相成,共同完成机体的抗感染功能。
原文标题:
PTENα promotes neutrophil chemotaxis through regulation of cell deformability
⑧ Nature子刊:长非编码RNA调控炎症小体组装激活新机制
在固有免疫反应中,巨噬细胞通过协调炎症反应发挥重要的功能。炎症小体是由胞浆内模式识别受体(PRRs)参与组装的多蛋白复合物,是炎症反应的关键效应器。
炎症小体能够识别病原相关分子模式(PAMPs)或宿主来源的危险信号分子(DAMPs),招募和激活促炎症蛋白酶caspase-1。而活化的caspase-1切割IL-1β和IL-18的前体, 产生相应的成熟细胞因子。炎症小体的活化还能够诱导细胞的炎症坏死,即焦亡(pyroptosis)。炎症小体活化与多种人类重大疾病的发生有着密切的关系。目前已发现的炎症小体主要有NLRP1、NLRP3、NLRC4和AIM等。
但是关于炎症小体组装以及其中的调控机制的了解还不是很清晰。长非编码RNA(lncRNA)作为生命科学领域研究的热点分子,在参与调控炎症小体激活的研究中鲜有报道。
来自中科大生科院的吴缅教授研究组今日在国际学术期刊Nature Communications上在线发表题为“The lncRNA Neat1 promotes activation of inflammasomes in macrophages”的研究论文,发现受低氧诱导因子HIF-2α转录激活的lncRNA Neat1可以直接参与炎症小体的组装和激活,Neat1通过其5’端与caspase-1 p20亚基直接结合,既可以结合在pro-caspase-1上稳定炎症小体复合物的组装,也可以结合在成熟的caspase-1四聚体上增加其稳定性和酶活性。
在巨噬细胞中,Neat1通过以上途径促进炎症小体的组装激活,增加成熟caspase-1四聚体的形成,从而上调促炎因子IL-1β和IL-18的成熟和分泌,并促进细胞焦亡。此外,在相关药物的诱导下,Neat1基因敲除小鼠较野生型小鼠表现出更低水平的腹膜炎和肺炎,进一步从体内证明了Neat1具有促进炎症反应的功能。
美国宾夕法尼亚大学杨小鲁教授是本文的共同通讯作者,吴缅教授研究组的博士研究生张鹏飞和曹利勉为该论文的共同第一作者。
原文标题:
The lncRNA Neat1 promotes activation of inflammasomes in macrophages