细胞因子启动 Th17 细胞分化新机制,深度解读董晨院士团队今年第三篇 Immunity!
辅助性 T 细胞 17(T helper cell 17,Th17)是一种能够分泌白介素 17(interleukin 17,IL-17)的 T 细胞亚群,在自身免疫性疾病和机体防御反应中具有重要的意义。作为 Th17 的发现者之一,董晨院士在今年 6 月的 Nature Immunology 上分享了发现 Th17 细胞的有趣经历 (1)。

图片来源:Nature Immunology
Naive CD4+ T 细胞可在细胞因子的影响下分化为不同类型的效应 T 细胞。Th17 细胞分化的启动需要白介素 6(IL-6)和转化生长因子 β(TGF-β)的作用,进而上调控制 Th17 细胞发育的谱系特异性转录因子 RORγt 的表达。
然而,关于 IL-6 和 TGF-β 如何在 Th17 细胞分化的早期阶段启动 RORγt 表达的认识仍然很少。
2020 年 8 月 21 日,清华大学医学院董晨院士团队在 Immunity 上在线发表了题为 The Conserved Non-coding Sequences CNS6 and CNS9 Control Cytokine-Induced Rorc Transcription during T Helper 17 Cell Differentiation 的研究成果 (2)。
该研究发现起始 Th17 细胞分化所必需的两个细胞因子 IL-6 和 TGF-β,通过 Rorc 基因上两个不同的保守非编码序列(conserved non-coding sequence, CNS)CNS6 和 CNS9 诱导 RORγt 转录,从而启动 Th17 细胞分化。

图片来源:Immunity
研究内容
CNS6 或 CNS9 缺失导致 Th17 细胞分化缺陷
IL-6 主要通过 STAT3 起作用,为了了解 STAT3 是如何启动 Th17 细胞发育的,作者研究了 STAT3 怎样通过 Rorc 基因(编码 RORγt)中的顺式调控元件调控其表达。
作者首先确认了 Rorc 基因的 11 个保守非编码序列(CNS1–CNS11)。通过分析已经发表的 ChIP-seq 数据,作者发现 CNS9 与 STAT3 的相互作用最强,CNS6 与 STAT3 也有较弱的相互作用,提示 CNS6 和 CNS9 是潜在的 STAT3 依赖性顺式调节元件。

图片来源:Immunity
为了确定 CNS6 和 CNS9 是否确实参与 Rorc 表达和 Th17 细胞分化,作者通过 CRISPR-Cas9 技术分别构建了 CNS6 和 CNS9 缺陷的小鼠,结果发现 CNS6 和 CNS9 缺陷并没有影响 RORγt+ 天然淋巴细胞的发育和功能,但显著导致了 Th17(CD4+RORγt+FOXP3−)和调节性 Th17(Tr17,CD4+RORγt+FOXP3+)细胞的分化缺陷。
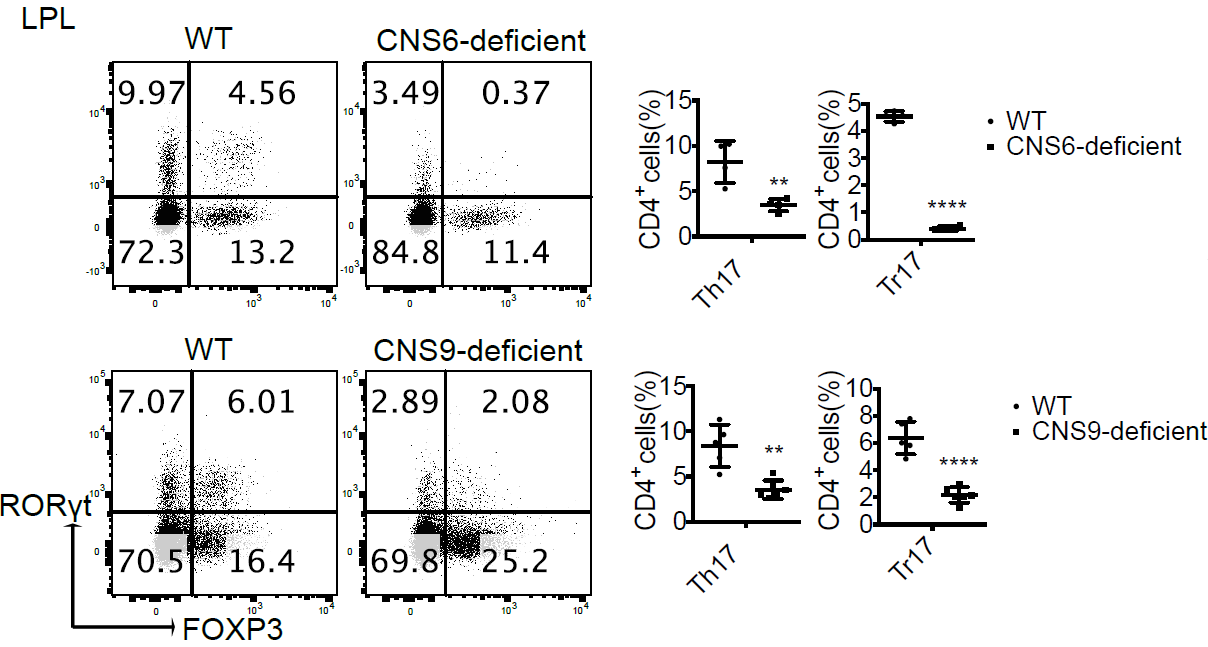
图片来源:Immunity
此外,CNS6 或 CNS9 缺陷的小鼠表现出对实验性自身反应性脑脊髓炎(EAE)的诱导产生不同程度的抵抗,和野生型小鼠相比,CNS6 缺陷小鼠的疾病严重程度较低,而 CNS9 缺陷小鼠几乎完全抵抗 EAE 疾病的诱导,提示体内致病性 Th17 细胞的产生在很大程度上取决于 CNS9,而对 CNS6 的依赖性较小。
CNS6 或 CNS9 缺失影响 RORγt 表达和 Th17 分化的机制是怎样的?
细胞实验表明 CNS6 或 CNS9 缺失显著降低了 RORγt 表达,并影响 Th17 的分化,那么其中的机制是怎样的呢?
IL-6 和 TGF-β 在 Th17 细胞的表观遗传激活中具有重要作用。ChIP 实验发现 IL-6 诱导 STAT3 与 Rorc 启动子以及 CNS6 和 CNS9 区直接结合,敲除 STAT3 会导致 CNS6 和 CNS9 区域 H3K4me3 和 H3Ac 表观遗传标记的消失,表明 CNS6 和 CNS9 是响应 IL-6-STAT3 信号转导的功能性顺式调节元件。
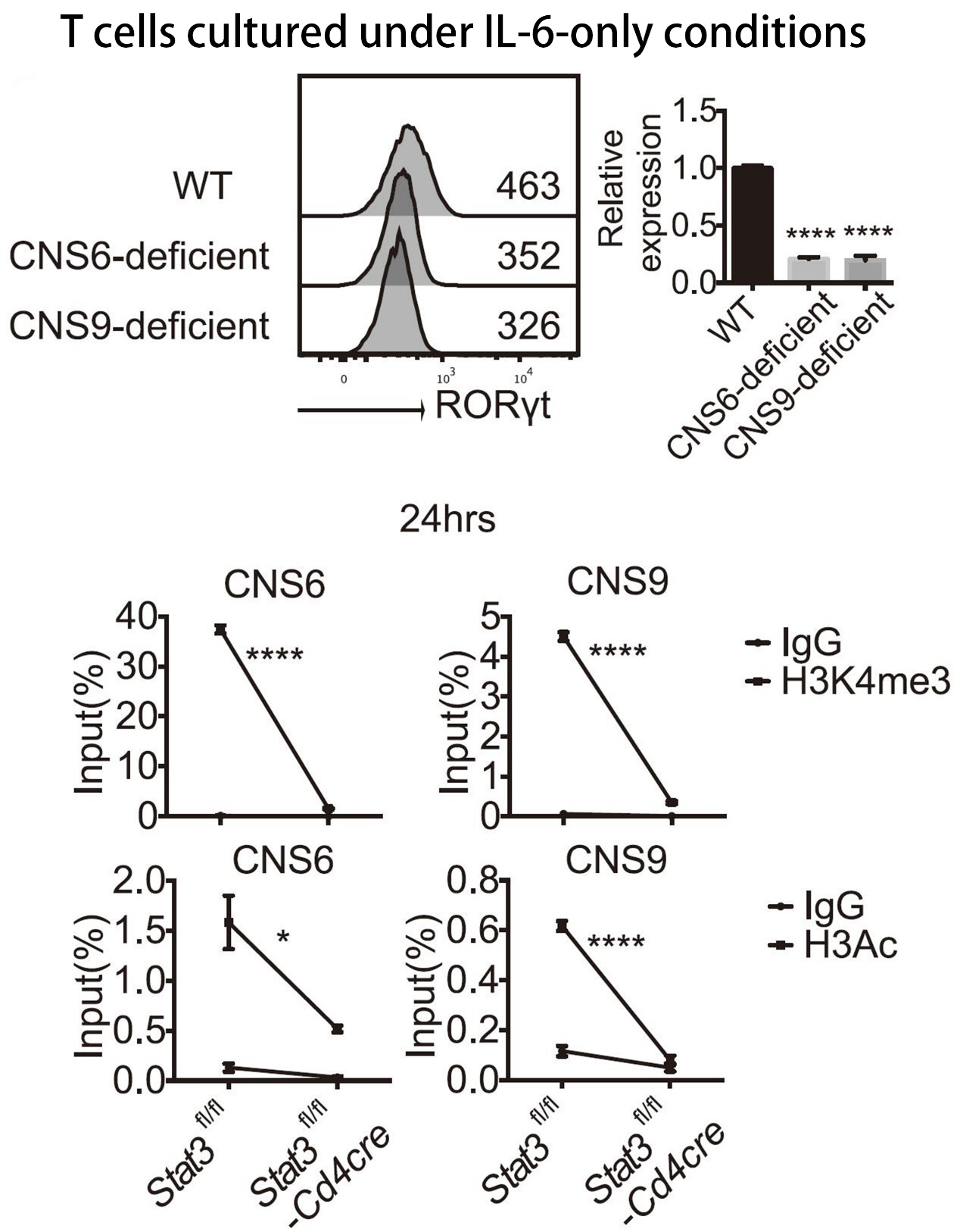
图片来源:Immunity
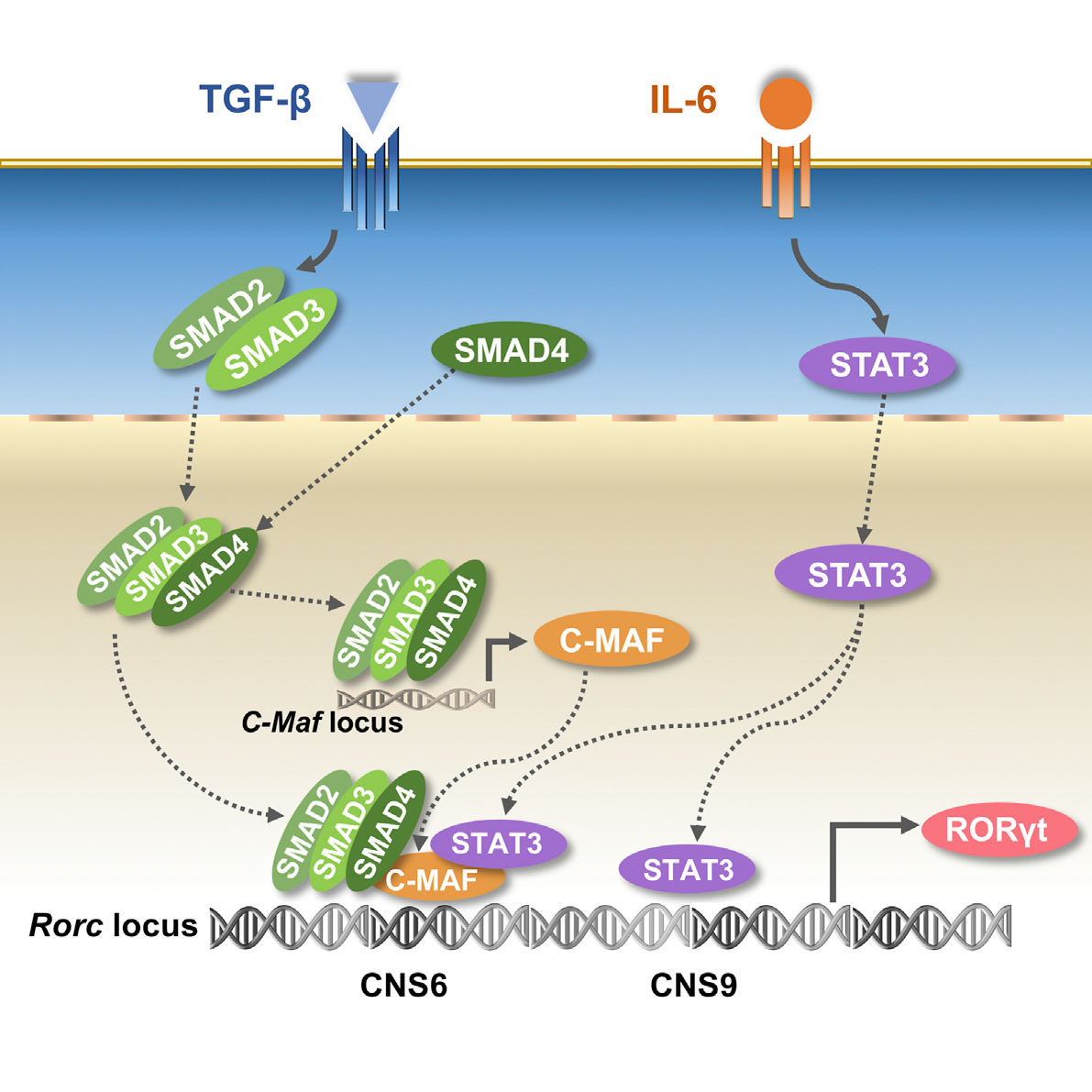
然而,TGF-β 的情况却有些不同,CNS6 缺失,而非 CNS9,显著降低了 TGF-β 诱导的 RORγt 表达。TGF-β 信号相关的染色质变化选择性地富集在 CNS6 和 Rorc 启动子上,而不是在 CNS9 上富集。ChIP 实验显示,TGF-β 信号下游的转录因子 SMAD2+SMAD3 和 SMAD4 与 CNS6 选择性相互作用,但不与 CNS9 相互作用。
此外,作者还发现 TGF-β 还可通过诱导 c-Maf 表达,进而与 CNS6 而非 CNS9 相互作用来激活 RORγt 表达。这些发现确认了 CNS6 可作为顺式调控元件,在 TGF-β 信号转导中起到重要作用。
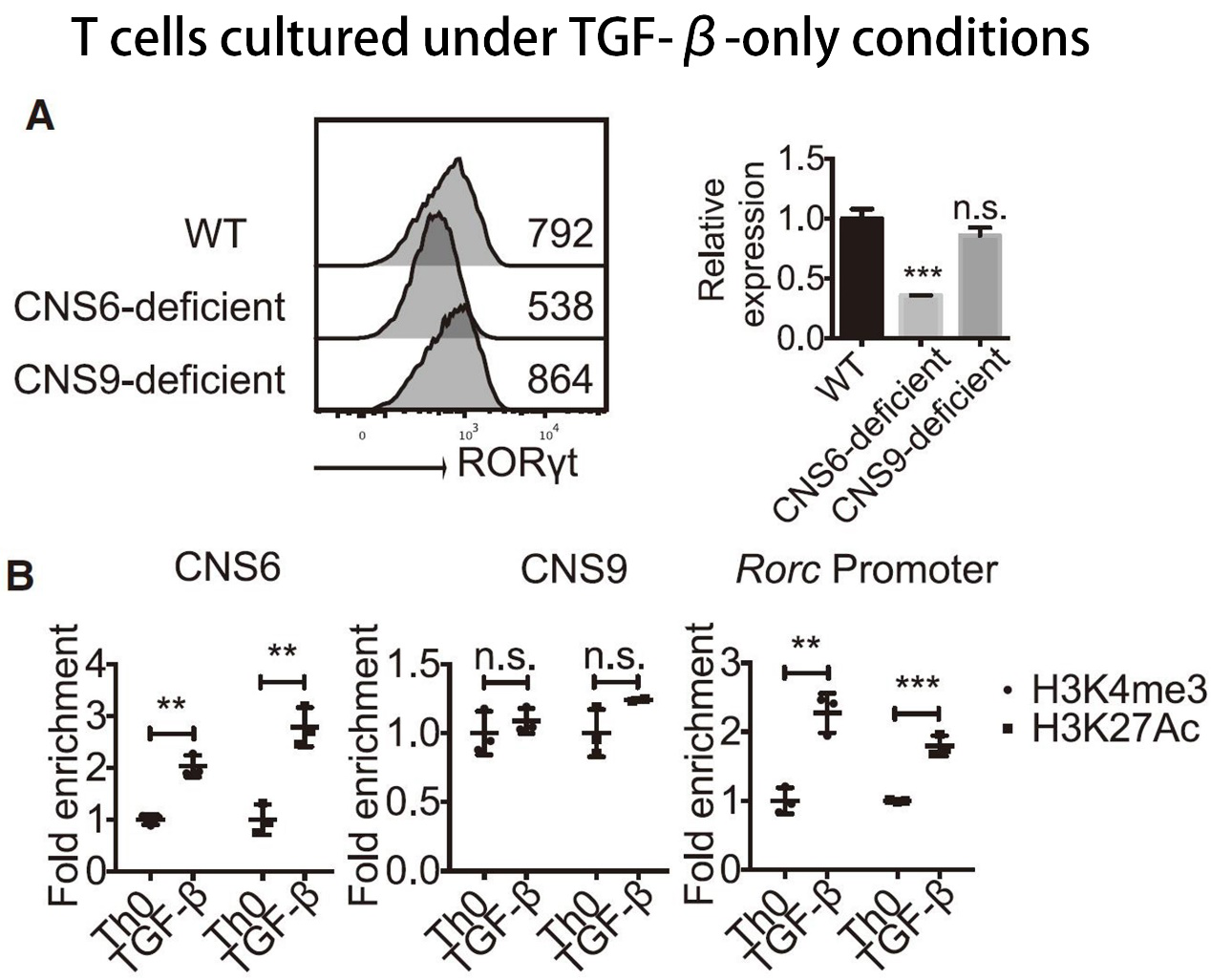
图片来源:Immunity
研究总结
本研究首次揭示了 IL-6 和 TGF-β 下游信号通过与不同的顺式调控元件相互作用,从表观和分子水平协同调控 RORγt 的表达和 Th17 细胞分化。
这个发现有助于理解顺式调控元件如何整合细胞因子信号,来驱动谱系特异性转录因子表达的分子机制。该研究也是继 Foxp3 基因之后,首次在辅助性 T 细胞亚群中系统研究首要转录因子相关的顺式调控机制。
图片来源:Immunity
清华大学医学院 2015 级直博生常德慧是本文章的第一作者,董晨教授和王小虎副研究员担任文章的共同通讯作者。本项目的研究受到了科技部重点研发项目、国家自然科学基金委、北京市科委等多个项目的支持。