蛋白分离纯化
在得不到足够信息的情况下,往往比较难以分析,大家多是在假定一些信息来回答问题,这样有时候碰巧符合了,但也有推断错误的时候。这样对解决问题是不利的。如果不涉及到技术保密问题,关于蛋白质纯化问题都建议按下列信息来提问。1、建议贴张SDS-PAGE图来分析一下,最好包括:Marker,胶浓度,变性还是非变性诱导前诱导后破菌上清破菌沉淀沉淀洗涤上清变性溶解上清变性溶解沉淀柱纯化前柱纯化穿透柱洗脱等各个样品。标上mark ...
蛋白纯化http://www.dxy.cn/bbs/actions/archive/post/4774978_1.html 幻灯片http://www.dxy.cn/bbs/actions/archive/post/1922610_1.html 原理图蛋白纯化网站(蛋白纯化方案均有详细PDF)http://www.dxy.cn/bbs/thread/7134009纯化后制备多抗及抗体蛋白保存http://www.dxy.cn/bbs/actio ...
在这个领域做了一段时间的工作了,下面根据个人经验,介绍几个“蛋白质表达”纯化相关的SCI/SCIE杂志,希望对新手能有所帮助。其实收载蛋白表达纯化的杂志有很多,只是看杂志主页的介绍,似乎多数biotech相关的杂志都是收载的,但实际上并非如此,很多杂志只要新蛋白,或者新技术,或者有别的特殊要求;而版上多数朋友的工作可能是应用相关的,研究没有好坏,杂志不分高低,只是在选择杂志时稍微用心一下,可能为后面的审稿及修稿省去 ...
在蛋白柱常见问题和日常维护分离时选择了合适的蛋白柱,有时往往不能成功地完成蛋白的分离,同一根蛋白分离柱在不同的使用者手中可能会有不同的柱寿命及分离效果,正确的使用蛋白柱和正确的日常维护是保证成功分离蛋白及延长柱寿命的关键。 不论使用什么类型的蛋白柱,首先必须对其填料的性能有基本了解。如该柱适用什么样的溶剂,什么类型的样品,流速及耐压范围等,GAT提供的各种类型的蛋白柱,在柱箱内均有详细的说明书,使用柱子前,务必要 ...
很多免疫教科书上描述,人和兔子,还有猪的抗体可以用proteinA亲和纯化。小鼠腹水单抗用protein G亲和介质进行纯化。但是在实际科研中,我们发现用新的rProtein A也可以对小鼠腹水进行有效纯化我和不少人说起过这个事,但是还是有很多怀疑和种种疑问挑战经典理论确实是件难事我摘抄了实验室一次实验与大家分享,希望对大家有所帮助简单的实验步骤,适合没有层析仪,又希望快速得到抗体的实验室(此次纯化实验耗时约2小时) ...
下列方法已在本实验室验证,复性任何包涵体,必定能得到目的蛋白:菌体为超声法裂解,裂解溶液中含50mM Tris-HCl, pH 8.0,100mM NaCl,5mM EDTA,0.1% NaN3,0.5% Triton-X100,在使用前加入 0.1mM PMSF每250毫升裂解液中加入约50克菌体,工作15s,间隔15秒,超声破碎45分钟,超声后加入10mM MgSO4 和0.1mg/ml 的溶菌酶和Dnase 0.01mg/ml,室温放置20分钟,6000RPM离心15分 ...
下面是本论坛的关于蛋白质纯化的文章,整理如下:蛋白质复性后进一步纯化时,加入氯化钠即会出现沉淀,怎么办?http://www.dxy.cn/bbs/actions/archive/post/136508_0.html蛋白质纯化方案http://www.dxy.cn/bbs/post/view?bid=65&id=1100586&sty=3&keywords=%B5%B0%B0%D7%D6%CA+%B4%BF%BB%AF蛋白质纯化、HPLC制 ...
与传统方式相似,重组蛋白的分离纯化也是利用其物理和化学性质的差异,即以分子的大小,形状,溶解度,等电点,亲疏水性以及与其它分子的亲和性等性质建立起来的。与此相对应的分离纯化方法参见表1。从表1可看出,当前蛋白质的纯化主要是依靠层析和电泳技术。由于重组蛋白在组织和细胞中仍以复杂混合物的形式存在,因此到目前为止还没有一个单独或一整套现成的方法把任何一种蛋白质从复杂的混合物中分离出来,而只能依据目标蛋白的物理化学性 ...
如何选择凝胶生物分子下游纯化的对象一般包括蛋白、酶、重组蛋白、单抗、抗体及抗原、肽类、病毒、核酸等。纯化前首先需要测定生物分子的各物理和化学特性,然后通过实验选择出最有效的纯化流程。1.测定------分子量、PI当目标蛋白的物理特性如分子量、PI等都不清楚时,可用PAGE电泳方法或层析方法加以测定。分离范围广阔的Superose HR预装柱很适合测定未知蛋白的分子量。用少量离子交换介质在多个含不同PH缓冲液的试管中,可简 ...
1 分离方法 采取何种分离纯化方法要由所提取的组织材料、所要提取物质的性质决定。对蛋白质、多肽提取分离常用的方法包括:盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法等。这些方法常常组合到一起对特定的物质进行分离纯化,同时上述这些方法也是蛋白、多肽类物质分析中常用的手段,如层析、叫泳等。 1.1 高效液相色谱(HPLC) HPLC的出现为肽类物质的分离提供了有利的方法手段,因为蛋白质、多肽的HP ...
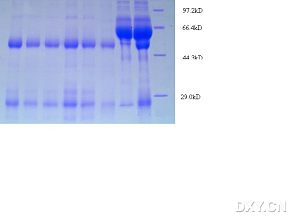
由于要做酶活性实验,所以选择真核表达His标签蛋白进行非变形的纯化。(避免了原核表达可能得到没功能的蛋白。)先上图上真相:这个说明了:细胞超声裂解后,离心沉淀的碎片里含少量His标签的过表达目的蛋白(第一道),上清里含大量His蛋白(第二道)。之后用特殊的含有镍的树脂小球纯化His蛋白,由于裂解液体积太大了,就分了两次加到柱子里。第一次加进去之后4度孵育1h,然后弃流出液(第三道),第二次把剩下的裂解液加进去,同样4度 ...
摘 要 综述了近几年来多肽类物质的提取分离与分析方法,主要包括高效液相色法、电泳、质谱及核磁共振等方法在肽类物质研究中的最新应用进展。 多肽类化合物广泛存在于自然界中,其中对具有一定生物活性的多肽的研究,一直是药物开发的一个主要方向。生物体内已知的活性多肽主要是从内分泌腺组织器官、分泌细胞和体液中产生或获得的,生命活动中的细胞分化、神经激素递质调节、肿瘤病变、免疫调节等均与活性多肽密切相关。随着现代科技的飞速发展,从天然产 ...
IMPACT™-TWIN 蛋白纯化系统(蛋白单柱亲和纯化、标记及连接)E6950S pdf下载概述:NEB在世界上最早开展内含肽(intein)技术的开发(1)。IMPACTTM 系统是一种新型的蛋白融合表达及纯化系统,能应用到蛋白质工程的许多重要领域(1-11)。IMPACTTM 表达的目的蛋白与蛋白自剪接元件(称为"内含肽",intein)及几丁质结合蛋白形成融合蛋白, 通过几丁质柱亲和纯化融合蛋白。然后诱导内含肽的肽键裂解活性,在几丁 ...
Protein A 柱之进化Protein A是一种金黄色葡萄球菌细胞壁蛋白质,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合。因而,将Protein A 与琼脂糖凝胶以一定的方式结合,可制备用于抗体纯化的亲和填料。早期的Protein A柱结合的都是天然Protein A。天然Protein A由5个IgG结合域和其它未知功能的非Fc结合域组成,分子量约42KD,结构如图1所示。这种柱子对IgG的亲和能力很强,可以吸附大量的lg ...
多肽物质分离与分析方法研究进展 摘 要 综述了近几年来多肽类物质的提取分离与分析方法,主要包括高效液相色谱法、电泳、质谱及核磁共振等方法在肽类物质研究中的最新应用进展。 关键词 多肽,分离,分析,进展 多肽类化合物广泛存在于自然界中,其中对具有一定生物学活性的多肽的研究,一直是药物开发的一个主要方向。生物体内已知的活性多肽主要是从内分泌腺组织器官、分泌细胞和体液中产生或获得的,生命活动中的细胞分化、神经激素递质调节、肿瘤病变、免疫调节 ...
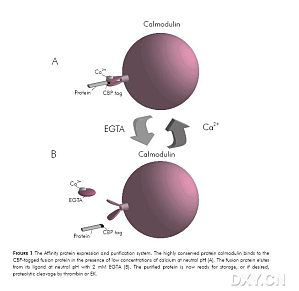
http://www.10150.com/com/changadhere/ns_detail.php?id=15589&nowmenuid=17102&cpath=&catid=0基于CBP标签技术的蛋白质表达与纯化系统 (用于高水平蛋白质表达和单步骤纯化)Protein Expression and Purification System是一种简单、温和、有效的方法,包括一个含有 calmodulin-binding peptide tag 钙调蛋白结 ...
其实研究王晓东的科研思路,发现这个规律是相当明显的,他自己也曾在讲课时提到科研的三板斧,其中的两板斧肯定是:建立体外生化检测系统,用这个系统跟踪蛋白纯化过程。他的过人之处就在于他的实验室能用 100升的细胞,过5,6个column最终纯化得到单一的生化组分。这个毅力有点像那个从几十万个猪脑提取某个激素的故事,他的实验比提激素可能要简单,但是他提取的不是一个,而可能是几个,这几个将细胞调亡线粒体途径阐述得相当干净明了 ...
转萜 觉得 这篇文章不错 介绍给大家 一起分享作者:佚名摘要:蛋白质的一级、二级、三级和四级结构决定了它的物理、化学、生物化学、物理化学和生物学性质,综述了不同蛋白质之间的性质存在差异或者改变条件是使之具有差异,利用一种同时多种性质差异,在兼顾收率和纯度的情况下,选择蛋白质提纯的方法。关键词:蛋白质 分离纯化前言蛋白质在组织或细胞中一般都是以复杂的混合物形式存在,每种类型的细胞都含有成千种不同的蛋白质。蛋白质的分离和提纯工作是一项 ...
北京xx生物医学科技有限公司蛋白质纯化介质选购指南一、生物大分子色谱纯化方法的选择思路通常在做纯化前对自己的目标物质特性了解越多对纯化将会越有利,如果不太了解,也可以通过电泳知道目标物质和杂质的情况,找到一种简单的鉴定方法,此外在纯化前必须先建立可靠的活性测定的方法。如果是未知的蛋白,那么通常可以有几种简单的摸索:1.凝胶过滤色谱。这个方法很常用,但是效率不高,对低浓度的样品没有富集作用,上样量小。2.离子交换 ...
冷泉港有一本很经典的书,叫《蛋白质纯化与鉴定实验指南》。其中的附录7给出了用亚氨基乙二酸(铁螯合)Sepharose 6B分离磷酸肽的方法。后面有2篇参考文献,最重要的那篇因为发表时间太久远了(Muszynska, G., L. Andersson, and J. Porath. 1986. Selective adsorption of phosphoproteins on gel-immobilizedferric chelate. Biochemistry 25:6850-68 ...