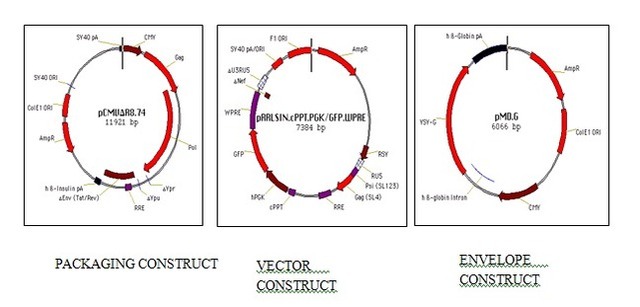
原理
慢病毒常用滴度检测方法解析:
1、荧光显微镜计数法
原理:通过荧光显微镜直接观察和计数表达荧光蛋白的阳性细胞,估算病毒滴度。
操作流程:
将病毒进行梯度稀释并感染目标细胞;
培养 48-72 小时;
荧光显微镜下观察计数阳性细胞。
计算公式:TU/mL = 阳性细胞数 × 稀释倍数 / 感染体积(mL)
优势:
设备要求较低;
可直观观察细胞形态和感染情况;
适合初步评估或小规模检测;
操作相对简便。
局限性:
统计效率低,样本量受限;
主观因素影响大;
精确度和重复性较低;
需要荧光报告基因。
2、qPCR检测法
原理:通过定量 PCR 检测整合到宿主细胞基因组中的病毒特定序列(如 WPRE 元件)拷贝数,推算活性病毒滴度。
操作流程:
用病毒感染靶细胞;
培养 48-72 小时后提取细胞基因组 DNA;
设计针对病毒特定序列的引物(如 WPRE)和内参基因(如白蛋白基因);
进行 qPCR 反应,并与标准品比较;
计算每个细胞中整合的病毒基因组拷贝数;
换算为病毒滴度。
换算方法:每个细胞的慢病毒拷贝数 =(WPRE 拷贝数/Alb 拷贝数)× 2;
滴度(TU/ml)=(第 1 天的细胞初始数量 × 样本的每个细胞的慢病毒拷贝数)/ 使用的慢病毒体积(ml)。
优势:
适用于不带荧光标记的病毒;
检测灵敏度高;
操作相对标准化;
定量准确。
局限性:
需要专业 qPCR 设备和经验;
标准曲线建立要求高;
可能受 DNA 提取效率影响;
检测时间约 24-48 小时。
材料与仪器
细胞、病毒
步骤
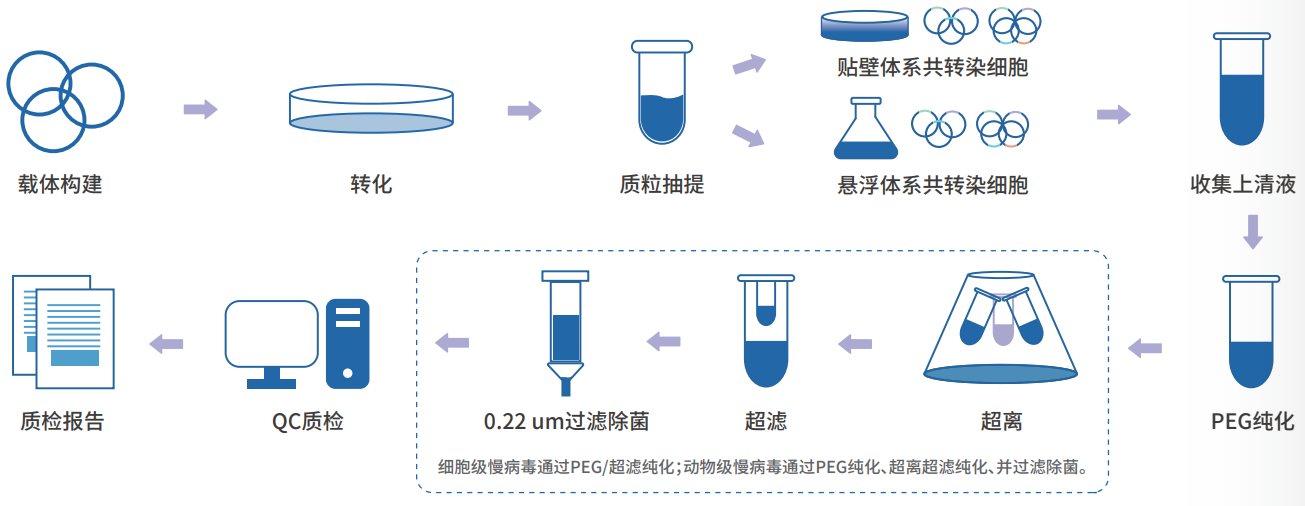
(1)穿梭质粒(GOI 质粒)制备:将目的基因片段构建到慢病毒载体中,转化大肠杆菌。挑选含有目的基因的单克隆,扩大培养后提取质粒。
(2)293T 细胞共转染:GOI 质粒和辅助质粒共转染到293T细胞中。
(3)病毒收获:转染 48-72h 后,离心收集细胞上清液。
(4)纯化浓缩:对上述细胞上清液进行 0.45μm 过滤、超离、超滤、除菌等处理。
(5)质量检测:滴度检测、物理状态检测和无菌检测。滴度检测常使用荧光显微镜计数法和 qPCR 检测法。
来源:丁香实验