Caspase-1 活性检测
最新修订时间:
合作专家 | 李锦斐博士
肿瘤学 北京协和医学院
审核专家 | 陈燚博士
肿瘤药理 中国科学院上海药物研究所
简介
Caspase (Cysteine-requiring Aspartate Protease) 是一个在细胞凋亡过程中起重要作用的蛋白酶家族。Caspase-1 主要参与促炎细胞因子的激活和细胞凋亡过程。FAM-YVAD-FMK 试剂旨在通过测量活细胞中的 caspase 1 活化来检测细胞凋亡。
原理
Caspase 活性检测基于 Caspase 的荧光抑制剂,这些抑制剂具有细胞渗透性和非细胞毒性。一旦进入细胞,Caspase 抑制剂与活性 Caspase 共价结合。已经证明 Caspase-1 对肽序列 Tyr-Val-Ala-Asp(YVAD)具有底物选择性。使用 FAM-YVAD-FMK 作为 Caspase-1 活性的荧光指示剂。
FAM-YVAD-FMK 在凋亡细胞中不可逆地结合活化的 Caspase-1。 一旦与 Caspase-1 结合,荧光试剂保留在细胞内。FAM 标签允许通过荧光显微镜、流式细胞术或荧光读板器直接检测凋亡细胞中活化的半胱天冬酶。
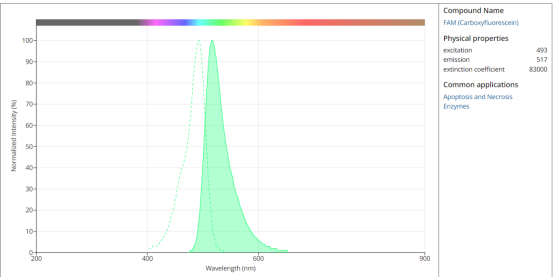
FAM 荧光光谱图
对于其他 Caspase 活性检测可以选用相应荧光试剂:
Poly Caspase FAM-VAD-FMK
Caspase-1, 4, & 5 FAM-YVAD-FMK
Caspase-1, 4, & 5 FAM-WEHD-FMK
Caspase-2 FAM-VDVAD-FMK
Caspase-3/7 FAM-DEVD-FMK
Caspase-6 FAM-VEID-FMK
Caspase-8 FAM-LETD-FMK
Caspase-9 FAM-LEHD-FMK
材料与仪器
细胞、FAM-YVAD-FMK 试剂
DMSO 试剂、Hepes 缓冲液
培养箱、流式细胞仪、荧光显微镜
荧光酶标仪
步骤
1、根据特异性诱导方案,将细胞培养至最适于细胞凋亡诱导的密度,但不超过 2x106 个细胞/mL。同时,培养非诱导的阴性对照细胞群时与诱导组在密度上保持一致。
2、通过向 FAM-YVAD-FMK 的小瓶中加入 50 μL DMSO 制备 150× FAM-YVAD-FMK DMSO 储备溶液。
3、将 150× FAM-YVAD-FMK DMSO 储备溶液以 1:150 的比例添加到细胞溶液中,并将细胞在 37 ℃,5% CO2 培养箱中孵育 1 小时。
4、将细胞以约 200 g 旋转 5 分钟,并用 Hepes 缓冲液洗涤细胞两次。将细胞重悬于所需量的洗涤缓冲液中。
5、如果需要,用 DNA 染色标记细胞(如用于死细胞的碘化丙锭,或用于细胞核染色的整个群体的 Hoechst)。
6、通过荧光显微镜,流式细胞仪或荧光酶标仪在 Ex / Em = 490 / 525 nm 处检测荧光强度(对于碘化丙锭,Ex / Em = 535 / 635 nm; 对于 Hoechst 染料,Ex / Em = 350 / 461 nm)。
(1)对于流式细胞仪,使用 FL1 通道监测荧光强度(FL2 通道用于碘化丙锭染色)。
(2)用于荧光显微镜和荧光酶标仪。将 100 μL 细胞悬浮液置于 96 孔黑壁/微量滴定板透明底部的每个孔中。
(3)使用 FITC 通道在荧光显微镜下观察细胞(用于碘化丙啶染色的 TRITC 通道,用于 Hoechst 染色的 DAPI 通道)。
(4)使用荧光酶标仪,使用 Ex / Em = 490 / 525 nm(在 515 nm 处截止)底部读取模式监测荧光强度。
注意事项
1. 应对每个细胞系进行单独评估,以确定诱导细胞凋亡的最佳细胞密度。
2. 对于 FAM-YVAD-FMK 标记,细胞可以浓缩至 ~ 5×106 个细胞/mL。未使用的 150× FAM-YVAD-FMK DMSO 储备溶液应分为单次使用的等分试样并储存在 -20 ℃;
3. 对于贴壁细胞,用 0.5 mM EDTA 轻微消化细胞以保持细胞完整,并在用 FAM-YVAD-FMK 孵育之前用含血清的培养基洗涤细胞一次。
4. 适当的孵育时间取决于所用的细胞类型和细胞浓度。优化每个实验的孵育时间。
5. 如果需要平衡细胞浓度,调整诱导细胞的悬浮体积以接近非诱导细胞群的细胞密度。如果您的细胞治疗不会导致受刺激细胞群数量的显着损失,则此调整步骤是可选的。
6. FAM-YVAD-FMK 是荧光的,因此清除任何未结合的试剂以消除背景非常重要。
7. 对于分离的细胞,应将细胞浓度调节至每个微量滴定板孔中 2~5×105 个细胞/100 μL 等分试样,用于步骤 6。
常见问题
诱导悬浮培养细胞凋亡的方案?
常见诱导方案如下:
(1)用 2 μg/ml 喜树碱处理 Jurkat 细胞 3 小时。
(2)用 1 μM 星形孢菌素处理 Jurkat 细胞 3 小时。
(3)用 4 μg/ml 喜树碱处理 HL-60 细胞 4 小时。
(4)用 1 μM 星形孢菌素处理 HL-60 细胞 4 小时。
来源:丁香实验