原理
MOI: 复感染指数,是指病毒对细胞的感染能力,MOI 越高,细胞越难被感染。通常把某株细胞有 80% 被感染时所用的病毒颗粒数和细胞数目的比值作为该株细胞的 MOI。
MOI=(病毒滴度 × 病毒体积)/ 细胞数目
用途
通过感染预实验确定慢病毒对细胞的感染 MOI 和最佳感染条件,如接种细胞量,感染试剂,感染后换液时间,这些将为正式实验提供参考。
材料与仪器
【材料试剂】胎牛血清、基础培养基、HitransG A、HitransG P、胰酶
【仪器用品】荧光显微镜、CO2 培养箱、倒置显微镜、离心机、生物安全柜
步骤
- 为了确认合适的感染条件,按照不同培养条件将实验分为 4 组:
A 组:常规培养基组,观察常规培养条件下病毒对细胞的感染效果;
B 组:添加 HitransG A(简称 A 液)的常规培养基组,观察 HitransG A 是否可以提升感染效果;
C 组:添加 HitransG P(简称 P 液)的常规培养基组,观察 HitransG P 是否可以提升感染效果;
Control 组:监控实验过程中细胞生长是否正常。
注:HitransG A(25X,简称 A 液) HitransG P(25X,简称 P 液)
- 贴壁细胞的感染
(1) 保证细胞的良好生长状态,实验前一天制备密度为 3~5×104 个/ml 细胞悬液,接种 100 μL 细胞悬液于 96 孔板中。预感染时共需 13 个孔,一般不使用边缘孔。不同种类的细胞生长速度有所差异,为保证较好的实验结果,进行慢病毒感染时细胞的融合率应为 20%-40%。
(2) 感染预实验共设置三组感染条件,每组均设置四个不同梯度 MOI。用目的细胞培养基 Normal(不含血清)将慢病毒梯度稀释成 1×108 TU/mL、5×107 TU/mL 、1×107TU/mL、1×106TU/mL 4 个组,各 50 µL,对应不同梯度的 MOI。
(3) 吸掉上清液,并按照表 1 向各孔中加入相应体积的溶液,混匀,继续培养。此时,1-4 组加入的病毒量分别为 1×106 TU、5×105 TU 、1×105 TU、1×104 TU,细胞数目大约为 1×104个,
所以 1-3 组的 MOI 分别为100、50、10、1。
表 1. 感染预实验分组和感染条件
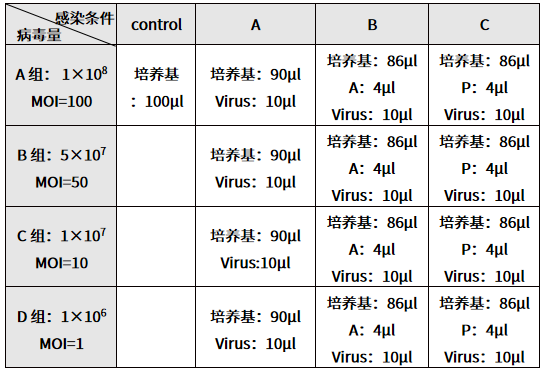
(4) 感染 16 h 后换回常规培养基,观察细胞形态,发生变化时可以提前到 8 h 换液,保持细胞正常生长。
(5) 感染约 72 h,显微镜观察荧光表达情况。感染效率 80% 左右,且细胞生长良好的组所对应的感染条件和 MOI 即可以作为后续感染实验的依据。
- 悬浮细胞的感染
(1) 实验前保证细胞处于良好的生长状态,将目的细胞收集后离心,去掉上清液,用完全培养基将细胞稀释成 1~2×105 个/ml,各 1 mL。取完全培养基稀释的细胞悬液 86 µL/孔加入 96 孔板中,接 13 个孔。
(2) 病毒的稀释过程同贴壁细胞。
(3) 按表 2,将病毒稀释液加入细胞悬液中,混匀,继续培养。
表 2. 悬浮细胞慢病毒感染预实验分组
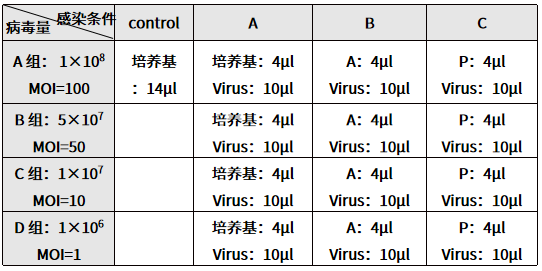
(4) 8-16 h 以后观察细胞状态,补加 100 μL 新鲜培养基重悬培养。
(5) 感染约72 h,显微镜观察荧光表达情况。感染效率80%左右,且细胞生长良好的组所对应的感染条件和MOI即可以作为后续感染实验的依据。
注意事项
(1)选择感染效率80%左右的作为最佳感染条件。
(2)在细胞形态丌受影响的情况下尽可能用少的病毒感染细胞。
(3)感染效率及细胞状态相当的情况下尽量选择常规培养基进行感染。
来源:丁香实验









