相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 规格:
1 mL×10
GST标签蛋白纯化琼脂糖凝胶
Glutathione Agarose Resin
本产品 4℃运输;保存于 4℃,禁止产品冻结,长期存放请保证试剂管竖立向上,凝胶浸没于保护液中,保质期24 个月。
货号规格
goodYJ105 1 mL×10
产品简介
good本产品可用于纯化各种表达系统融合表达的 GST 重组蛋白,其是以由高度交联的 4% 琼脂糖凝胶为基质,通过 12 个原子的间隔臂,用化学方法共价结合还原型谷胱甘肽制作而成。
产品参数
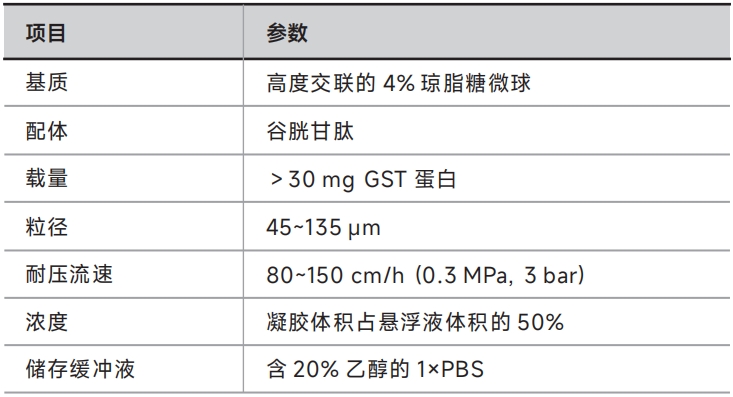
自备试剂

操作步骤
good◆ 样本处理(以大肠杆菌表达系统为例)
good◆gg1. 离心收集大肠杆菌(4℃,4,000×g,30 min),弃上清;
good◆gg2. 用冷1×PBS(货号:PS110)重悬细胞, 如果需要,可加入适量的添加剂,如非离子去污剂(NP-40)或蛋白酶抑制剂(货号:GRF101);
good◆gg3. 用超声波破碎法在冰上破碎菌体,直到样品破碎完全;
good◆gg4. (可选)如果裂解物太过粘稠,可以加入RNase A(终浓度10 μg/mL)和DNase I(终浓度5 μg/mL)并在冰上孵育10~15 min;
good◆gg5. 离心收集上清(4℃,12,000×g,20 min);
good◆gg6. SDS-PAGE分析GST融合蛋白的含量及可溶性;
good◆ 纯化重组GST融合蛋白
good◆gg7. 轻轻重悬GST标签蛋白纯化琼脂糖凝胶 ,吸取适量加入重力柱中,用10倍柱体积的冷1×PBS(货号:PS110)平衡GST琼脂糖凝胶;
good◆gg8. 将步骤5制备好的含有GST融合蛋白的上清液加入到纯化柱中,流速控制为0.5~1 mL/min;
good◆gg9. 蛋白上清液全部流出纯化柱后,立刻加入1×PBS清洗纯化柱,所需量大约为柱体积的 20倍或者直到流出液的A280值达到最低且稳定;
good◆g10. 用10~15倍柱体积的现配 洗脱缓冲液 以0.5~1 mL/min的流速洗脱,收集洗脱液。或者根据流出液A280值判断,当数值陡然上升时开始接收洗脱液,直到A280数值降至最低且稳定时,停止收集。后续可根据目的蛋白的性质和用途,4℃透析到20 mM Tris-HCl,pH 8.0或者1×PBS,pH 7.4中,以去除游离的谷胱甘肽。
good◆ 凝胶再生及储存
good◆ GST标签蛋白纯化琼脂糖凝胶 可以重复使用,但随着使用次数增多,非特异性结合的蛋白聚集往往会造成流速和蛋白结合载量的下降,这时便需要对琼脂糖凝胶填料进行清洗。
good◆g11. 使用5倍纯化柱体积去离子水清洗琼脂糖凝胶填料;
good◆g12. 使用2倍柱体积的6 M盐酸胍溶液进行清洗;
good◆g13. 使用5倍柱体积去离子水清洗填料;
good◆g14. 使用3~4倍柱体积70%乙醇或2倍柱体积的1%Triton X-100清洗填料;
good◆g15. 使用5倍柱体积去离子水清洗填料,即完成琼脂糖凝胶填料再生。
good◆g15. 注:填料再生后,可以立即使用,如不立即使用,需要将填料悬浮于等体积的20%乙醇中,置于 4℃保存。
注意事项
good1. 琼脂糖凝胶应保存在储存溶液中,防止干燥;
good2. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
good3. 本产品仅限科研使用。
常见问题解析
| 问题 | 原因 | 解决方案 |
| GST融合蛋白的产量低或无法检测到 | 融合蛋白形成包涵体 | 采用低温(16~25℃)培养细胞,或者诱导过程中降低诱 导剂的终浓度至1 mM,或者缩短诱导时间 |
| 纯化前需要完全融解和复性。将裂解液与GST标签蛋白纯化琼脂糖凝胶在摇床上轻摇2个小时或者更长时间(过夜),充分结合 | ||
| 融合蛋白可能失活 | 采用温和的超声破碎条件或者其它的裂解条件,比如采用溶菌酶 | |
| 融合蛋白被蛋白酶降解 | 在裂解步骤或洗涤步骤加入适量的蛋白酶抑制剂 | |
| 融合蛋白不能有效地从树脂上洗脱下来 | 延长洗脱时间,或者增加洗脱缓冲液中还原性谷胱甘肽的浓度至15 mM或者更高 | |
| 调节洗脱缓冲液的pH值至8.0~9.0 | ||
| 在洗脱缓冲液中加入Triton X-100(终浓度0.1%)、辛基-葡萄糖苷(终浓度2%)或者NaCl(终浓度0.1~0.2 M) | ||
| 洗脱缓冲液中有较多杂带 | 融合蛋白被蛋白酶降解 | 在裂解步骤或漂洗步骤加入适量的蛋白酶抑制剂 |
| 一些宿主蛋白,比如伴侣蛋白,可能会和融合蛋白互相作用 | 在漂洗缓冲液中加入DTT(终浓度5 mM)。在纯化前将重组蛋白溶液和伴侣蛋白溶液(2 mM ATP, 10 mM MgSO4, 50 mM Tris-HCl)37℃振荡10 min | |
| 过度的超声处理会导致一些蛋白与融合蛋白相结合 | 采用温和的超声破碎条件或者其它的裂解条件 | |
| 有些蛋白会与融合蛋白或树脂发生非特异性结合 | 优化漂洗条件:加入一些洗涤剂如1% Triton X-100、 1% Tween-20、0.03% SDS或者0.1% NP-40可以降低非特异性吸附;优化漂洗缓冲液中的盐浓度也可以降低非特异性吸附 |
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验HIS 标签蛋白纯化效果不理想,宝宝心里苦呀。今天,小编来跟大家一起找找原因。 纯化所得组分中没有收集到重组的 HIS 标签蛋白。该问题主要可以分为以下两个方面: 1、HIS 标签蛋白没有结合到填料上就流穿了 原因一 超声的功率不对。超声功率过高,容易导致蛋白炭化;功率过低,蛋白释放不出来。 建议 改变超声功率,同时可以在超声前加入溶菌酶。 原因二 结合缓冲液条件不合适。 建议 检查结合缓冲液中是否有影响结合的因素,如:金属离子螫合剂、强还原剂、过高的咪唑浓度。同时,优化缓冲
Strep-Tactin®XT 纯化步骤来啦! 各位在实验室中都是怎样做纯化的呢?视频中来自IBA Lifesciences的师姐给大家完整演示了她的纯化实验流程~ 从实验前的试剂、纯化柱的准备,到纯化以及柱子的再生步骤。希望能对大家的纯化所有帮助!建议快快点赞收藏,转发给身边做纯化的小伙伴一起看哦!
StrepⅡ-六组氨酸-蛋白 02双标签蛋白可促进目的蛋白增溶性和特异性双重提高 当组氨酸标签蛋白表达量低,或纯化过程中蛋白不稳定时,可能是由于目的蛋白疏水性强导致溶解性不高、或未能正确折叠形成包涵体影响纯化效果。大分子增溶性蛋白标签,如 GST、MBP 标签可改善这一问题。但一步亲和难以满足高纯度蛋白的要求。大分子标签与小分子标签组合的双标签蛋白不仅可以提高目的蛋白溶解性和稳定性,还可以提高目的蛋白的特异性。 下图展示的是双标签绿色荧光蛋白(六组氨酸-绿色












