QPCR分子实验0元专场,预实验+引物优化一律免费!PCR分
子实验0元收藏
分享
- ¥100
- 通过qPCR准确进行miRNA在细胞或组织样本中的表达分析是研究miRNA功能的基础。
- 上海
- 2026年01月19日
相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 技术资料
- 提供商:
锐赛生物
- 服务名称:
常用基因表达检测实验服务
年底促销
锐赛生物本期促销活动:「PCR分子实验0元专场」,预实验+引物优化一律免费!千万不要错过!
锐赛生物优秀的技术团队将上下游实验与细胞功能实验完善整合,通过良好的对照设置与过往项目的经验,将诸多问题消灭在实验设计阶段。拥有多年操作经验的实验团队在荧光定量PCR、拷贝数分析、WB、RNAi干扰筛选、免疫组化、ELISA、石蜡样本DNA提取、基因合成方面拥有丰富的经验,为您提供真实可靠的实验数据。
qPCR检测
实验原理
通过qPCR准确进行miRNA在细胞或组织样本中的表达分析是研究miRNA功能的基础。将小片段的miRNA通过聚合酶A加尾,再通过含有通用序列的Oligo序列进行反转录,合成特异性的miRNA引物及通用引物即可对miRNA进行qPCR检测工作。
实验流程:
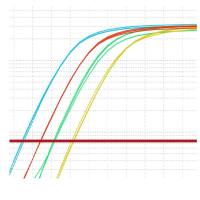
实验结果展示:
目的基因hsa-miR-9-1在不同样本中的qPCR相对定量检测结果的
1)目的基因hsa-miR-9-1 的扩增曲线和熔解曲线;
2)内参基因人 snRNA U6的扩增曲线和熔解曲线;
3)hsa-miR-9-1 在不同样本中的qPCR相对定量检测柱形图。
TROUBLESHOOTING
常见问题FAQ
Q:qPCR与普通PCR的区别是什么?
Q:请问进行相对定量检测前提供组织样本时需要将组织块定量吗?
A:不需要,采用qPCR相对定量法主要是以表达量稳定的内参基因作为对照从而判断目的基因相对表达丰度。我们在实验操作中会对各个环节进行把控,确保实验结果的客观性:1)组织抽提的RNA会进行定量;2)正式上机前对样本进行RT-PCR检测确定反应条件;3)上机检测后的相对定量数据分析,计算每个样本目的基因对相对稳定的内参基因的表达差异,可以排除上样量的差别对数据分析的影响。
Q:可以进行miRNA的荧光定量PCR检测服务吗?与编码基因的qPCR操作流程上有何区别?
A:可以,采用专用的miRNA荧光定量PCR试剂盒即可。与编码基因的qPCR检测流程上的主要区别是需要将提取后的RNA,用poly(A) 聚合酶在其3’末端加尾,再用5’端带40nt延伸序列的单碱基锚定Oligo-dT引物进行反转录,得到约80nt的cDNA,然后用特异引物进行SYBR Green实时定量PCR扩增。其中miRNA的引物设计需要大量摸索,才能获得重复性高可信度高的数据。
Q:如何制备绝对定量 PCR 的标准品?
A:将欲定量基因的一小段序列(200-300bp)克隆到T载体上,经测序验证后,进行小量抽提,采用分光光度计定量,按照公式计算拷贝数后梯度稀释,用于上机绘制标准曲线,从而计算待检测基因的拷贝数多少。
Q:荧光定量PCR有哪些注意要点?
A:荧光定量PCR的关键步骤在于RNA的抽提和引物的设计。RNA的抽提需要严格进行RNase
free的操作,抽提的RNAOD260/OD280需严格控制在1.9-2.1之间。引物设计主要的考虑是其PCR反应特异性好和扩增效率高,进行PCR反应时无非特异性的条带和引物聚合体出现,尽量选取GC含量在40-60%的区段进行扩增。另外,还需要适应荧光定量PCR仪上机条件的设定,退火温度在55-65° C之间。除此之外,其他各个环节如试剂的稳定性,RNA反转的质量好坏,PCR上机条件的设定,加样的手法和熟练度等等也要注意。
Q:荧光定量PCR引物的设计原则是什么?
A:1)扩增产物长度在80-200bp;引物应在核酸序列保守区内设计并有特异性;引物通常设计为跨内含子。2)产物不能形成二级结构;引物长度在18-30bp之间,其中碱基应随机分布;待扩增的片段Tm值应在55-65°C之间;待扩增的片段GC含量在40-60%之间;引物自身及引物之间不能有连续4个碱基的互补。3)引物5′端可进行修饰,3′端不能进行修饰; 引物3′端要避开密码子的第3位。
Q:如何设计荧光定量PCR的TaqMan探针?
A:TaqMan探针的设计原则为尽量靠近上游引物;长度一般为30-45bp,Tm 值至少比扩增引物高 5° C;5′端不能为 G,因为 G 会淬灭荧光,从而影响定量;设计时,需要通过软件来进行设计,网络上有许多免费的以及在线的设计软件可以使用。
Q:可否设计羊源、猪源等其他物种基因的qPCR引物?
A:可以设计,但对于人,大鼠,小鼠常规模式生物以外的基因(由于无法在NCBI获得完整的基因序列信息),在进行PCR优化的时候难度远远大于常规生物基因,周期会增加,且可能需设计多对引物才可能获得满意的实验结果。
Q:判断扩增曲线是否良好的指标有哪些?
A:1)曲线拐点清楚,特别是低浓度样本指数期明显。
2)曲线指数期斜率与扩增率成正比,斜率越大扩增效率越高。
3)标准的基线平直或者略微下降,无明显的上扬趋势。
4)各管的扩增曲线平行性好,表明各反应管的扩增效率相近。
参考文献
1.Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods 2001,25:402–408.
2.Michael A. Innis,David H. Gelfand,John J. Sninsky. PCR Applications: Protocols for Functional Genomics. Academic.
锐赛生物
锐赛生物本期促销活动:「PCR分子实验0元专场」,预实验+引物优化一律免费!千万不要错过!
锐赛生物优秀的技术团队将上下游实验与细胞功能实验完善整合,通过良好的对照设置与过往项目的经验,将诸多问题消灭在实验设计阶段。拥有多年操作经验的实验团队在荧光定量PCR、拷贝数分析、WB、RNAi干扰筛选、免疫组化、ELISA、石蜡样本DNA提取、基因合成方面拥有丰富的经验,为您提供真实可靠的实验数据。
qPCR检测
实验原理
通过qPCR准确进行miRNA在细胞或组织样本中的表达分析是研究miRNA功能的基础。将小片段的miRNA通过聚合酶A加尾,再通过含有通用序列的Oligo序列进行反转录,合成特异性的miRNA引物及通用引物即可对miRNA进行qPCR检测工作。
实验流程:
实验结果展示:
目的基因hsa-miR-9-1在不同样本中的qPCR相对定量检测结果的
1)目的基因hsa-miR-9-1 的扩增曲线和熔解曲线;
2)内参基因人 snRNA U6的扩增曲线和熔解曲线;
3)hsa-miR-9-1 在不同样本中的qPCR相对定量检测柱形图。
TROUBLESHOOTING
常见问题FAQ
Q:qPCR与普通PCR的区别是什么?
Q:请问进行相对定量检测前提供组织样本时需要将组织块定量吗?
A:不需要,采用qPCR相对定量法主要是以表达量稳定的内参基因作为对照从而判断目的基因相对表达丰度。我们在实验操作中会对各个环节进行把控,确保实验结果的客观性:1)组织抽提的RNA会进行定量;2)正式上机前对样本进行RT-PCR检测确定反应条件;3)上机检测后的相对定量数据分析,计算每个样本目的基因对相对稳定的内参基因的表达差异,可以排除上样量的差别对数据分析的影响。
Q:可以进行miRNA的荧光定量PCR检测服务吗?与编码基因的qPCR操作流程上有何区别?
A:可以,采用专用的miRNA荧光定量PCR试剂盒即可。与编码基因的qPCR检测流程上的主要区别是需要将提取后的RNA,用poly(A) 聚合酶在其3’末端加尾,再用5’端带40nt延伸序列的单碱基锚定Oligo-dT引物进行反转录,得到约80nt的cDNA,然后用特异引物进行SYBR Green实时定量PCR扩增。其中miRNA的引物设计需要大量摸索,才能获得重复性高可信度高的数据。
Q:如何制备绝对定量 PCR 的标准品?
A:将欲定量基因的一小段序列(200-300bp)克隆到T载体上,经测序验证后,进行小量抽提,采用分光光度计定量,按照公式计算拷贝数后梯度稀释,用于上机绘制标准曲线,从而计算待检测基因的拷贝数多少。
Q:荧光定量PCR有哪些注意要点?
A:荧光定量PCR的关键步骤在于RNA的抽提和引物的设计。RNA的抽提需要严格进行RNase
free的操作,抽提的RNAOD260/OD280需严格控制在1.9-2.1之间。引物设计主要的考虑是其PCR反应特异性好和扩增效率高,进行PCR反应时无非特异性的条带和引物聚合体出现,尽量选取GC含量在40-60%的区段进行扩增。另外,还需要适应荧光定量PCR仪上机条件的设定,退火温度在55-65° C之间。除此之外,其他各个环节如试剂的稳定性,RNA反转的质量好坏,PCR上机条件的设定,加样的手法和熟练度等等也要注意。
Q:荧光定量PCR引物的设计原则是什么?
A:1)扩增产物长度在80-200bp;引物应在核酸序列保守区内设计并有特异性;引物通常设计为跨内含子。2)产物不能形成二级结构;引物长度在18-30bp之间,其中碱基应随机分布;待扩增的片段Tm值应在55-65°C之间;待扩增的片段GC含量在40-60%之间;引物自身及引物之间不能有连续4个碱基的互补。3)引物5′端可进行修饰,3′端不能进行修饰; 引物3′端要避开密码子的第3位。
Q:如何设计荧光定量PCR的TaqMan探针?
A:TaqMan探针的设计原则为尽量靠近上游引物;长度一般为30-45bp,Tm 值至少比扩增引物高 5° C;5′端不能为 G,因为 G 会淬灭荧光,从而影响定量;设计时,需要通过软件来进行设计,网络上有许多免费的以及在线的设计软件可以使用。
Q:可否设计羊源、猪源等其他物种基因的qPCR引物?
A:可以设计,但对于人,大鼠,小鼠常规模式生物以外的基因(由于无法在NCBI获得完整的基因序列信息),在进行PCR优化的时候难度远远大于常规生物基因,周期会增加,且可能需设计多对引物才可能获得满意的实验结果。
Q:判断扩增曲线是否良好的指标有哪些?
A:1)曲线拐点清楚,特别是低浓度样本指数期明显。
2)曲线指数期斜率与扩增率成正比,斜率越大扩增效率越高。
3)标准的基线平直或者略微下降,无明显的上扬趋势。
4)各管的扩增曲线平行性好,表明各反应管的扩增效率相近。
参考文献
1.Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods 2001,25:402–408.
2.Michael A. Innis,David H. Gelfand,John J. Sninsky. PCR Applications: Protocols for Functional Genomics. Academic.
锐赛生物
电话:021-64197338
全国服务热线:137-6147-5994
Email:Service@research-bio.com
地址:上海市浦东新区康新公路3399弄
(时代医创园)25号楼17层
快,关注锐赛生物一起涨姿势~
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 技术资料
技术资料暂无技术资料 索取技术资料
QPCR分子实验0元专场,预实验+引物优化一律免费!PCR分子实验0元
¥100