相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 提供商:
GeneCopoeia
- 服务名称:
GeneCopoeia
- 规格:
100ul-200ul
产品介绍
GeneCopoeia全新推出的AAVPrime™腺相关病毒(Adeno-associated virus, AAV)可高效介导外源基因感染多种不同类型的分裂或非分裂细胞,对人体无致病性,是理想的基因转导研究工具。AAVPrime™包装系统是由非致病性的野生型腺相关病毒改造优化而成,不需应用腺病毒即可完成包装过程,进一步降低潜在致病性,使用过程更安全。
GeneCopoeia科研团队现提供定制AAV包装服务,可包装长度低于3 kb的目标基因;同时也提供多种常用报告基因的预制AAV病毒,满足多种科研需求,适用于体外、活体实验研究。
针对不同细胞、组织类型,现有23种血清型可供选择,合适的血清型可进一步提高实验效率,详情可点击上方[可选血清型及载体]按钮查询。
产品优势
- 高滴度:纯化型AAV病毒滴度高达10^14 GC/ml (genome copies/ml)
- 适用性广泛:广泛适用于多种分裂及非分裂宿主细胞/组织
- 低细胞毒性:AAV为非整合型病毒,不对宿主细胞基因组产生负面影响
- 低免疫原性:进行活体实验时,实验动物免疫反应小
- 生物安全级别高:对人体无致病性
AAVPrime™预制AAV病毒 – eGFP表达
| 0.005 μl | 0.05 μl | 0.5 μl |
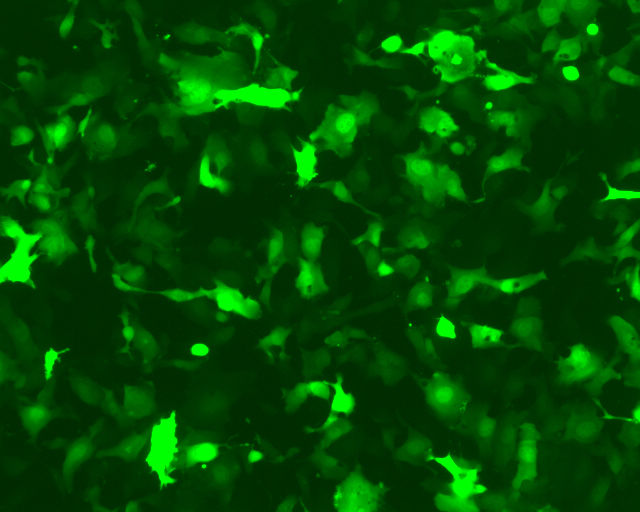 | 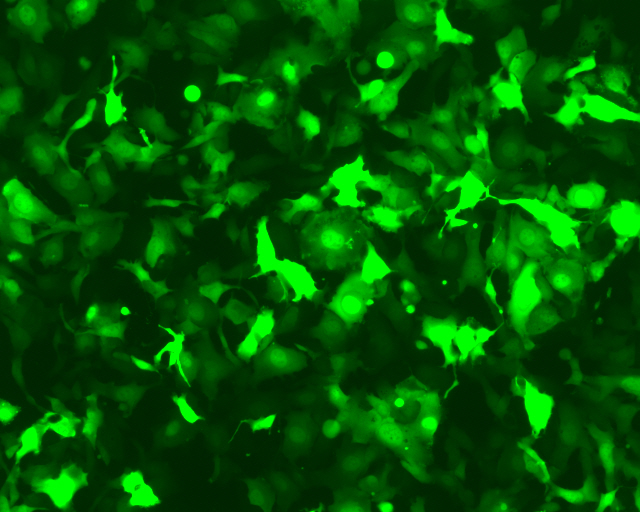 | 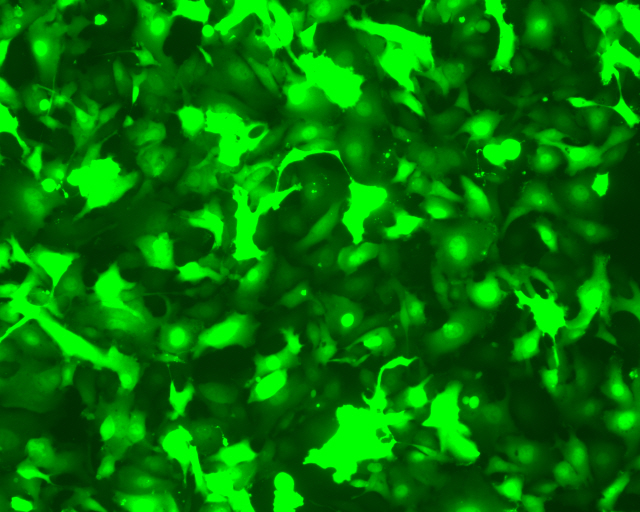 |
图1. 于24孔板中,使用上图所示用量的纯化型AAV病毒感染HT1080细胞(ATCC)表达绿色荧光蛋白eGFP。感染后,使用荧光显微镜观察荧光蛋白表达情况。 (曝光时间:400 ms)
不同血清型的GFP-AAV感染H1299细胞
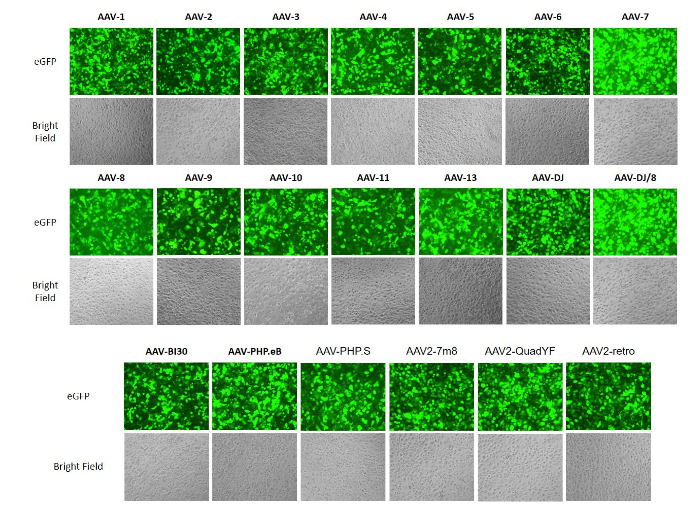
图2. 不同血清型的GFP-AAV感染H1299细胞,如图所示。
携带GFP的AAV-9、MyoAAV和AAV-MG感染细胞
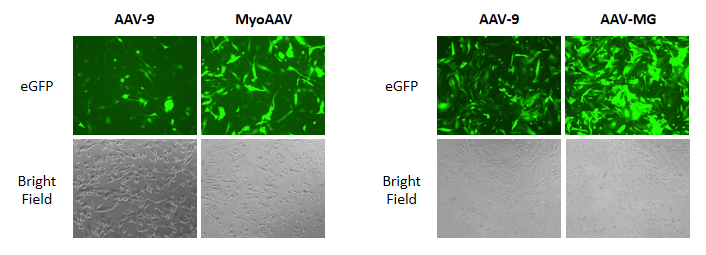
图3. MyoAAV和AAV-MG在体外感染中表现出组织特异性。用携带GFP的AAV-9、MyoAAV和AAV-MG感染横纹肌肉瘤(RD)细胞系(左)或人小胶质细胞细胞系(HmC3)(右)。
可选AAV血清型
GeneCopoeia提供多种适用性最广泛的血清型以供科研工作者选择。血清型是腺相关病毒的一个重要概念,不同血清型的差异主要在于衣壳蛋白的不同,外源基因在特定细胞/组织的表达效率和组织亲和性往往和所选择的血清型密切相关。
选择合适靶细胞的血清型,对基因在特定宿主的高效表达非常重要。您可通过以下表格的建议进行血清型的初步选择,也可来电咨询技术支持。
| 血清型 | 主要适用组织 | 血清型描述 |
| AAV-1 | 肌肉 | 对心肌、骨骼肌、神经元、神经胶质细胞组织的效果较好。 |
| AAV-2 | 肌肉、肝脏、视网膜 | 使用历史最长,同时也是适用性较广泛的血清型,对神经细胞、肌肉、肝脏、脑组织的效果较好。 |
| AAV-3 | 巨核细胞 | 对巨核细胞、肌肉、肝脏、肺脏、视网膜组织的效果较好。 |
| AAV-4 | 视网膜 | 对神经元、肌肉、脑、视网膜组织的效果较好。 |
| AAV-5 | 肺脏 | 对肺脏、神经元、滑膜关节、视网膜、胰腺组织的效果较好。 |
| AAV-6 | 肌肉、肺脏 | 对肺脏、肝脏、心脏的效果较好。 |
| AAV-7 | 肌肉、视网膜、神经元 | 对肌肉、神经元、肝脏的效果较好。 |
| AAV-8 | 肝脏 | 对肌肉、脑、肝脏、视网膜的效果较好。 |
| AAV-9 | 广泛适用 | 对肌肉、心脏、肺脏、肝脏、脑的效果较好。 |
| AAV-10 | 胸膜、中枢神经系统 | 对肺脏、肌肉、心脏、中枢神经系统的效果较好。 |
| AAV-11 | 脊神经 | 有效的逆行靶向投射神经元和增强星形细胞定向转导。 |
| AAV-12 | 唾液腺、骨骼肌 | 转导不依赖细胞表面的硫酸肝素或唾液酸,可感染唾液腺、骨骼肌。 |
| AAV-13 | 中枢神经 | 适用于精确标记,如针对大脑中的小核 |
| AAV-DJ | 广泛适用 | 该血清型是8种天然存在的血清型的优化混合,对多种人源组织及器官有较好的感染效果。其中,AAV-DJ对肝源细胞的导向性较强。 |
| AAV-DJ/8 | 广泛适用 | 该血清型由AAV-DJ进一步改造所得。通过删除AAV-DJ的HBD位点(heparin binding domain),降低该血清型在活体实验中对肝导向性干扰,从而相对提高在非肝源细胞的感染效率。 |
| MyoAAV | 肌肉组织 | 对肌肉组织的特异性较好。 |
| AAV-MG | 小胶质细胞 | 对大脑中小胶质细胞的特异性较好。 |
| AAV-PHP.eB | 中枢神经系统 | 穿过血脑屏障(BBB)并增强中枢神经系统趋向性。 |
| AAV-BI30 | 中枢神经系统 | 特异、高效地转导整个中枢神经系统的内皮细胞。 |
| AAV-PHP.S | 周围神经系统 | 有效感染全外周神经。 |
| AAV2.7m8 | 视网膜,内耳 | 有效感染视网膜细胞、内耳耳蜗毛细胞。 |
| AAV2-QuadYF | 视网膜,内皮细胞 | 有效感染视网膜细胞、血管内皮细胞。 |
| AAV2-retro | 脊神经 | 逆向非跨突触转导。 |
可选载体
GeneCopoeia提供以下ORF AAV病毒载体,所有载体均适用于搭配不同血清型进行包装。载体可包装的最大片段长度为3 kb。
| 载体名称 | 启动子 | 启动子介绍 | 报告基因 | 可包装片段长度 |
| pEZ-AV01 | CMV | 强启动子,应用范围较广。 | N/A | 2.5 kb |
| pEZ-AV02 | EF-1α | 也是应用范围较广的启动子。在活体实验的表现基本优于CMV。 | N/A | 3.2 kb |
| pEZ-AV04 | CAG | 在活体实验中常用的强启动子。 | N/A | 2.0 kb |
| pEZ-AV06 | CBH | 强启动子,且表达时间较长。 | N/A | 2.8 kb |
| pEZ-AV07 | CMV | 强启动子,应用范围较广。 | IRES-eGFP | 1.3 kb |
| pEZ-AV08 | EF-1α | 也是应用范围较广的启动子。在活体实验的表现基本优于CMV。 | IRES-eGFP | 2.1 kb |
| pEZ-AV09 | CAG | 在活体实验中常用的强启动子。 | IRES-eGFP | 0.9 kb |
| pEZ-AV11 | CBH | 强启动子,且表达时间较长。 | IRES-eGFP | 1.7 kb |
| pEZ-AV12 | CAMKlla | 在大脑皮层和海马体中的兴奋性神经元有特异性表达。 | N/A | 2.4 kb |
| pEZ-AV13 | hSYN | 人源synapsin-1基因启动子,是神经元特异启动子。 | N/A | 3.2 kb |
| pEZ-AV15 | MHC | 一种人源的心肌细胞特异启动子。 | N/A | 3.3 kb |
* 更多载体将陆续推出!
GeneCopoeia提供以下CRISPR AAV病毒载体,所有载体均适用于搭配不同血清型进行包装。
| 载体名称 | CRISPR | 载体介绍 | 报告基因 |
| pCRISPR-AD01 | SaCas9 & sgRNA | All-in-one AAV vector with SaCas9 and sgRNA | N/A |
| pCRISPR-AV20 | sgRNA only | AAV vector expressing sgRNA driven by U6 promoter | N/A |
GeneCopoeia提供以下shRNA AAV病毒载体,所有载体均适用于搭配不同血清型进行包装。
| 载体名称 | 启动子 | 启动子介绍 | 报告基因 |
| psi-AV03 | U6 | Pol III promoter-driven shRNA | N/A |
| psi-AVE001 | CMV | Pol II promoter-driven shRNA | eGFP |
| psi-AVE002 | CMV | Pol II promoter-driven shRNA | mCherry |
| psi-AVE003 | EF1a | Pol II promoter-driven shRNA | eGFP |
| psi-AVE004 | EF1a | Pol II promoter-driven shRNA | mCherry |
GeneCopoeia提供以下miRNA/inhibitor AAV病毒载体,所有载体均适用于搭配不同血清型进行包装。
| 载体名称 | 启动子 | 筛选标记 | 报告基因 |
| pEZX-MR14 | CMV | Puromycin | eGFP |
| pEZX-MR15 | CMV | Puromycin | mCherry |
| pEZX-AM06 | H1 | Hygromycin | mCherry |
| pEZX-AM07 | U6 | Hygromycin | mCherry |
相关产品
OmicsLink™ 即用型ORF表达克隆
Lentifect™ 纯化慢病毒颗粒
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验-
Hasan, K.M., et al. (2023). Fatty Acid Excess Dysregulates CARF to Initiate the Development of Hepatic Steatosis. Cells doi: 10.3390/cells12071069 [AAVPrime™ AAV particles expressing CARF and AAV-empty vector; OMICSLINK™ CARF Lentiviral ORF expression clone]
Hasan, M.N., et al. (2023). Combining ASBT inhibitor and FGF15 treatments enhances therapeutic efficacy against cholangiopathy in female but not male Cyp2c70 KO mice. J Lipid Res doi: 10.1016/j.jlr.2023.100340 [OMICSLINK™ Fgf15 ORF expression clone; AAVPrime™ AAV particles expressing Fgf15]
Gannon, A-L., et al. (2022). A Novel Model Using AAV9-Cre to Knockout Adult Leydig Cell Gene Expression Reveals a Physiological Role of Glucocorticoid Receptor Signalling in Leydig Cell Function Int J Mol Sci doi: 10.3390/ijms232315015 [AAVPrime™ AAV particles expressing CRE and GFP]
Chen, X., et al. (2022). Pitx3 deficiency promotes age-dependent alterations in striatal medium spiny neurons. Front Aging Neurosci doi: 10.3389/fnagi.2022.960479 [AAV-hSyn1-eGFP]
Hogan, T.B., et al. (2022). Caveolin-1 Peptide Regulates p53-microRNA-34a Feedback in Fibrotic Lung Fibroblasts. iScience doi: 10.1016/j.isci.2022.104022 [AAVPrime™ AAV particles expressing microRNA inhibitors]
Yang, B., et al. (2022). Evaluation of Early Biomarkers of Atherosclerosis Associated with Polychlorinated Biphenyl Exposure: An in Vitro and in Vivo Study. Environmental Health Perspectives doi: 10.1289/EHP9833 [AAVPrime™ AAV particles expressing HDAC7]
Xia, Y., et al. (2022). Neuronal C/EBPb/AEP pathway shortens life span via selective GABAnergic neuronal degeneration by FOXO repression. Science Advances doi: 10.1126/sciadv.abj8658 [AAVPrime™ AAV particles expressing FOXO1, shRNA targeting FOXO1]
Song, M-Y., et al. (2022). Sirt6 reprograms myofibers to oxidative type through CREB-dependent Sox6 suppression. Nature Communications doi: 10.1038/s41467-022-29472-5 [AAVPrime™ AAV particles expressing Sirt6, shRNA targeting Sirt6]
Lio, J., et al. (2022). C/EBPβ/AEP signaling couples atherosclerosis to the pathogenesis of Alzheimer’s disease. Molecular Psychiatry doi: 10.1038/s41380-022-01556-0 [AAVPrime™ AAV particles expressing shRNA targeting ApoE]
Toan, N.K., et al. (2021). Choline Acetyltransferase Induces the Functional Regeneration of the Salivary Gland in Aging SAMP1/Kl -/- Mice. International Journal of Molecular Sciences doi: 10.3390/ijms22010404 [AAVPrime™ AAV particles expressing shRNA targeting ChAT]
Zhang, W-B., et al. (2021). Activation of Nrf2 by miR-152 Inhibits Doxorubicin-InducedCardiotoxicity via Attenuation of Oxidative Stress, Inflammation,and Apoptosis. Oxidative Medicine and Cellular Longevity doi: 10.1155/2021/8860883 [AAVPrime™ AAV particles expressing mir-152 miRNA; AAVPrime™ AAV particles expressing shRNA targeting Nrf2]
Kang, S.S., et al. (2021). ApoE4 inhibition of VMAT2 in the locus coeruleus exacerbates Tau pathology in Alzheimer’s disease. Acta Neuropathologica doi: 10.1007/s00401-021-02315-1 [AAVPrime™ AAV particles expressing ApoE4]
Quan, D.N. and Shiloach, J. (2021). rAAV production and titration at the microscale for high- throughput screening. Human Gene Therapy doi: 10.1089/hum.2021.080 [AAVPrime™ AAV particles expressing EGFP]
Han, L., et al. (2020). Homocysteine-induced electrical remodeling via the mediation of IP3R1/Nav1.5 signaling pathway. Am J Transl Res. 2020; 12(7): 3822–3841 [AAVPrime™ AAV particles expressing shRNA targeting IP3R1]
Luo, Y., et al. (2020). Upregulation of circ_0000199 in circulating exosomes is associated with survival outcome in OSCC. Scientific Reports doi: 10.1038/s41598-020-70747-y [AAVPrime™ AAV particles expressing shRNA targeting circ_0000199]
Luo, Y., et al. (2020). A novel epigenetic regulation of circFoxp1 on Foxp1 in colon cancer cells. Cell Death & Disease doi: 10.1038/s41419-020-03007-6 [AAVPrime™ AAV particles expressing shRNA targeting circ_FoxP1]
Millett, P.J., et al. (2020). Gene Editing to Impove Joint Function. United States Patent Applicaitons doi: 20200360454K [AAVPrime™ AAV particles expressing GFP]
Zhao, Y. and Ren, J. (2019). MODIFIED IMMUNE CELLS HAVING ENHANCED FUNCTION AND METHODS FOR SCREENING FOR SAME. United States Patent Application 20190345491 [AAVPrime™ AAV particles expressing DNMT3A]
技术、TALEN技术和CRISPR/Cas9技术的基因敲除研究。 实验流程1. 基因组DNA的准备:提取野生型和突变型细胞的基因组DNA。Genloci公司专为阳性克隆筛选设计的TNA抽提试剂盒也能帮您的忙,只需500个左右的细胞即可提取全基因组DNA。 2. 杂交DNA的准备:a) PCR引物设计:一般扩增产物长度为300~600 bpb) PCR扩增:获得杂交DNA 3. Cruiser™酶筛选阳性克隆:无需纯化DNA,直接使用PCR产物,混合体系后45℃下反应15~20 min K562细胞中
NEB 发布:GenomONE™ 为诱导 iPSC 形成「保驾护航」
间充质干细胞(MSC, mesenchymal stem cells)是干细胞家族的重要成员,属于多能干细胞,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注。诱导性多能性的间充质干细胞(iPMSCs)是药物筛选、再生医学和细胞治疗的新型候选药物。然而,用于生成骨髓间充质干细胞的诱导性多能性间充质干细胞(iPSC),在导入编码基因的转录因子中,往往伴随有在靶细胞基因组的插入时发生突变的风险。 由于近年来对骨髓间充质干细胞认知地深入,在造血系统、免疫
。基因打靶技术目前已被广泛认为是一种理想的特定修饰与改造生物体遗传物质的最佳方法。尤其是条件性和诱导性基因打靶系统的建立,使得对基因在时间和空间上的靶位修饰更加明确、效果更加精确可靠。尽管如此,漫长的构建周期(需时8-12个月)却使很多研究者望而却步。很明显,TALEN、CIRSPR/Cas9和传统ES打靶基因敲除技术有着互补的作用,而TetraOneTM KO技术却是两者优势的结合。这在目前基因组编辑的技术研究中,无疑是最为值得关注的新一代革命性技术。它使更加快速精准构建基因打靶小鼠成为可能
 技术资料
技术资料暂无技术资料 索取技术资料