相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
AAV在神经科学中的应用
一、神经研究病毒载体的选择| 慢病毒 | 腺病毒 | 腺相关病毒 | |
| 优势 | 整合到基因组,可构建稳定过表达或干扰。一般只适合细胞系及原代神经元细胞 | 适合原代细胞,如原代神经元等;包装容量大,高达6kb;体内、体外快速表达(24-36 小时); | 适合在体基因转导;安全性高(免疫原性低)、均一性好(分子小,可均匀扩散)、长效性(稳定表达3-6个月),特异性强(有不同的组织亲和性) |
| 局限 | 滴度低,在体感染心脏效率低;随机插入基因组,有致瘤风险; | 免疫原性高,可能引发强烈的免疫反应,导致动物死亡或者腺病毒被免疫;表达周期短,大约2周时间;只能开胸进行心肌原位注射,静脉注射效果差; | 表达到高峰所需的时间长,通常需要三周。 |
二、腺相关病毒的选择
1、 不同的血清型和特异性启动子:
AAV有不用的血清型,可以特异性亲和不同的组织,对于脑部,一般选择AAV2/AAV9。但是,脑部有不同种类的神经细胞,无论是AAV2还是AAV9,都不能只在某种神经细胞中绝对特异性表达,于是针对不同的神经细胞,我们研发出了不同的启动子类型,以期能在特定细胞中表达:
| Syn | 感染全脑神经元细胞 |
| CaMKII | 感染全脑兴奋性神经元细胞 |
| GFAP | 感染全脑星形胶质细胞 |
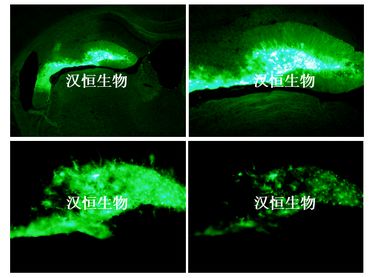
图1::星型胶质细胞特异性启动子的AAV注射小鼠海马组织效果图
病毒:HBAAV-GFAP-GFP,10^12vg/ml
实验动物:C57小鼠,8周龄
注射方法与体积:脑定位注射,海马区,1ul
检测方法:注射3周后冰冻切片,荧光显微镜检测
2、 DIO元件:
对于特异性更高的实验,比如只需要在脑区表达某个基因,可以用含有DIO元件的病毒。DIO原件的病毒只有在cre动物模型中才会表达。因此,只需用cre敲入动物某个脑区,再将含有DIO元件的病毒打入特定脑区,便能实现绝对的特异性表达。
3、穿透血脑屏障的AAV/BBB:
因为血脑屏障的存在,通过尾静脉或者其他脑部以下部位给药,很难到达脑部,但是脑部注射操作麻烦而且对动物伤害比较大,汉恒生物研发出了一种可以穿透血脑屏障的AAV,可以直接通过尾静脉注射感染全脑。
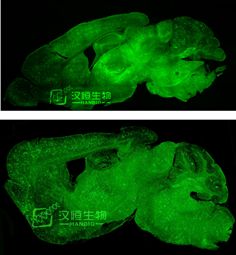
图2:HBAAV/BBB注射小鼠尾静脉可透过血脑屏障感染脑组织
病毒:汉恒生物穿血脑屏障AAV2/BBB-CAG-Zsgreen
滴度:1.4x10^12vg/ml
注射量:100 微升
注射部位:尾静脉
检测方法:注射感染3周,取材切片,confocol检测拍照
4、神经逆行标记AAV-Retro:
人体的感知、运动等功能都和神经元的长距离信号传导密切相关。在科学研究中,如何高效标记和操作投射神经元一直是广大科研工作者所面对的难题。标记物在神经元中沿其轴突从胞体行末梢进行示踪为顺行标记,从末梢行胞体进行示踪的为逆行标记,而拥有逆行标记能力的研究工具比较缺乏。
汉恒生物采用自包装神经逆行标记病毒AAV2/retro-EGFP病毒注射小鼠SNc(黑质致密部)部位,3周后取材切脑片检测其他脑区的荧光表达情况。发现在MGP(内侧苍白球)、LGP(外侧苍白球)、PFC(前额叶皮层)等部位可以检测到明显荧光表达,证明SNc神经元对MGP、LGP、PFC等区域均有大量投射。
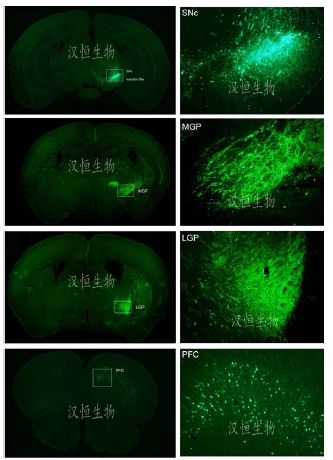
图3:AAV2/retro-EGFP病毒注射小鼠SNc部位可逆行标记至MGP、LGP、PFC部位
病毒:AAV2/retro-EGFP
滴度:1.3x10^12vg/ml
注射量:1 微升
注射部位:SNc(黑质致密部)
检测方法:注射感染3周,取材切片,confocol检测拍照
5、光遗传学和化学遗传学AAV:
光遗传学(optogenetics)是结合了光学(optics)及遗传学(genetics)的技术,能在活体动物甚至是自由运动的动物脑内,精准地控制特定种类神经元的活动。光遗传学在时间上的精确度可达到毫秒级别,在空间上的精确度则能达到单个细胞级别。这项技术目前在神经科学领域应用非常广泛,未来可能会应用于多种神经和精神疾病的治疗,如帕金森氏病、阿尔茨海默病、脊髓损伤、精神分裂症等。
化学遗传学是指:对一些生物大分子实行改造,使其能和先前无法识别的小分子进行相互作用的过程。化学遗传学和分子遗传学一样,均是遗传学的一个分支,由于其可控的、可逆的(可以随时加入或除去化合物,从而启动或中断特定的反应)特性,已经在信号转导、药物开发、功能基因组学等方面的研究中得到了广泛的应用。如下左图为光遗传学原理,右图是化学遗传学原理:
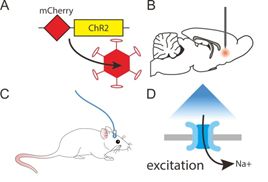
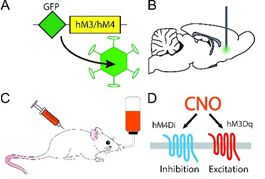
图4:上图为光遗传示意图;下图为化学遗传示意图
三、AAV血清型选择及注射方式
| 感染部位 | 推荐的血清型 | 注射方式 | 动物 | 注射体积( ul) |
| 全脑 | AAV-BBB | 尾静脉注射 | 大鼠 | 250-300 |
| 小鼠 | 100 | |||
| 侧脑室 | 9型 | 立体定位注射 | 大鼠 | 1-5 |
| 小鼠 | 1-5 | |||
| 脑组织 | 9型 | 立体定位注射 | 大鼠 | 2-3 |
| 小鼠 | 1-2 | |||
| 脊髓 | 9型 | 鞘内注射 | 大鼠 | 查阅文献确认 |
| 小鼠 |
脑定位/鞘内注射/尾静脉注射视频,请关注汉恒生物公众号:

四、客户发表文章节选
| 名称 | 杂志名称 | IF | 单位 | 使用方法 |
| Laterodorsal tegmentum interneuron subtypes oppositely regulate olfactory cue-induced innate fear | NATURE NEUROSCIENCE | 17.839 | 浙江大学 | AAV光遗传-小鼠大脑外侧僵核(LHB) |
| Local GABAergic signaling within sensory ganglia controls peripheral nociceptive transmission | The Journal of Clinical Investigation | 12.784 | 河北医科大学 | AAV9感染DRG,脊椎注射 |
| Pre-ischemia melatonin treatment alleviated acute neuronal injury after ischemic stroke by inhibiting ER stress-dependent autophagy via PERK and IRE1 signalings | JOURNAL OF PINEAL RESEARCH | 10.391 | 第四军医大学唐都医院 | AAV-LC3双标,感染小鼠大脑皮质(ipsilateral cortex)监测自噬流 |
| Endoplasmic reticulum stress induced by tunicamycin and thapsigargin protects against transient ischemic brain injury: Involvement of PARK2-dependent mitophagy | Autophagy | 8.593 | 浙江大学 | AAV9-LC3 感染小鼠原代神经元 |
| BNIP3L/NIX-mediated mitophagy protects against ischemic brain injury independent of PARK2 | Autophagy | 8.593 | 浙江大学 | AAV9单标LC3感染原代神经元 |
| Cholinergic Grb2-Associated-Binding Protein 1 Regulates Cognitive Function | Cerebral Cortex | 6.559 | 浙江大学 | AAV9-DIO注射CRE小鼠胆碱能神经元 |
| Adeno-associated virus 9–mediated Cdk5 inhibitory peptide reverses pathologic changes and behavioral deficits in the Alzheimer’s disease mouse model | FASEB JOURNAL | 5.498 | 南方医科大学南方医院 | AAV9立体定位小鼠侧脑室注射 |
| Neuroinflammation contributes to autophagy flux blockage in the neurons of rostral ventrolateral medulla in stress-induced hypertension rats | Journal of Neuroinflammation | 5.102 | 复旦大学医学院 | AAV9,感染大鼠延髓头端腹外侧区神经元 |
| MiR-134 modulates chronic stress-induced structural plasticity and depression-like behaviors via downregulation of Limk1/cofilin signaling in rats | Neuropharmacology | 5.012 | 山东大学 | AAV8-大鼠大脑 |
| Kainate receptor mediated presynaptic LTP in agranular insular cortex contributes to fear and anxiety in mice | Neuropharmacology | 5.012 | 北京药理毒理研究所 | AAV9-小鼠大脑 |
| CRISPR/Cas9-mediated targeting of the Rosa26 locus produces Cre reporter rat strains for monitoring Cre–loxP-mediated lineage tracing | FEBS Journal | 3.902 | 中国医学科学院北京协和医院 | AV9-CAG-Cre感染大鼠海马和肌肉 |
| Central administration of tert-butylhydroquinone attenuates hypertension via regulating Nrf2 signaling in the hypothalamic paraventricular nucleus of hypertensive rats | Toxicology and Applied Pharmacology | 3.791 | 西安交通大学 | AAV9感染大鼠下丘脑室旁核(PVN) |
| Astrocyte Autophagy Flux Protects Neurons Against Oxygen-Glucose Deprivation and Ischemic/Reperfusion Injury | Rejuvenation Research | 2.827 | 第四军医大学西京医院 | AAV9-GFAP启动子注射小鼠半影区神经元 |
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验rAAV 在神经科学研究中的应用方向 rAAV 血清型的选择 01 用于神经元示踪的血清型⸺AAV2-retro、AAV1、AAV9 使用 AAV 精确标记神经回路需要考虑可逆性,包括神经元的顺行和逆行标记,以及是否跨突触(图 2)。目前,只有两种血清型可 以用于神经元顺行标记,即 AAV1(图 3)和 AAV9,高滴度的 AAV9 可顺向跨突触。唯一可用于逆行标记是 AAV2-retro(图 4)。 图 2 AAV 等工具病毒在神经环路示踪应用中的传播方向和层级 [Neurosci
遗传性眼病是一类由于基因缺陷而导致的疾病,目前已报道大约有 200 种遗传性眼病和超过 400 种具有眼部表现的系统性疾 病。遗传性眼病引起的视觉功能丧失通常很难通过传统的手术、激光治疗和局部药物治疗来治愈。基因治疗已成为治疗这类疾 病最重要的手段。腺相关病毒(AAV)由于具有安全性好、免疫原性低、表达时间长、有多种组织和细胞特异性血清型可选 择、高稳定性等优势,已被广泛应用于眼科疾病基因治疗。首款获批上市的遗传性视网膜疾病基因治疗药物 Luxturna(约 85 万 美元/剂)采用了 AAV
and mitophagy in lung fibroblasts 的研究论文。 该研究表明,骨形态发生蛋白 4 (BMP4) 在 人肺中的下调,在 IPF 疾病发生和进展中起 关键作用,BMP4 信号通路通过调节肺成 纤维细胞的衰老和线粒体自噬抑制肺纤维 化。因此,BMP4 信号的激活可能是治疗 IPF 肺纤维化的一种新型有效的治疗方法。 血清型:AAV9 注射方式:气管内注射 病毒滴度:1x1010 vp/ml 靶向部位:肺 动物模型:C57BL/6 BMP4+/+ and BMP4+/- mice
 技术资料
技术资料暂无技术资料 索取技术资料






