相关产品推荐更多 >

银染试剂盒(Silver Stain Kit)(10T/20T/40T)
¥99
双荧光素酶检测实验|双荧光素酶检测试剂盒| 双荧光素酶报告基因检测试剂盒(50T/100T)|(萤火虫-海肾)双荧光素酶报告系统检测| 双荧光素酶报告基因(DLR)验证实验|双荧光试剂盒
¥299
DNA pull-down Kit for plant | 植物、组织等样本 DNA pull-down 试剂盒 | 蛋白互作试剂盒小规格
¥499
RNA Binding Protein Immunoprecipitation (RIP)Kit | RIP 检测试剂盒 |蛋白互作类小规格试剂盒
¥299
Chromatin Immunoprecipitation (ChIP)Kit | ChIP试剂盒|蛋白互作类试剂盒小规格
¥499
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 库存:
6T
- 英文名:
DNA pull-down Kit for Animals
- 保质期:
参照shuomingshu
- 供应商:
武汉金开瑞生物工程有限公司
- 保存条件:
参照shuomingshu
- 规格:
具体报价请联系
实验原理
DNA pull down技术是体外研究DNA与蛋白质互作的有力工具。该技术针对目标区域 设计特异性DNA 探针并经过脱硫生物素标记,脱硫生物素探针可以和偶联在磁珠上的 链霉亲和素亲和结合(Wang,Yu et al.2004)。然后,细胞提取物与磁珠-DNA 探针孵育, 作用蛋白质分子可以和DNA 探针特异性结合;经过洗涤可以将非特异性结合蛋白质去 除;最后,经洗脱液洗脱,得到目的DNA 探针-蛋白质复合物,再经过Western Blot或质 谱(MS) 鉴定蛋白质类型。其原理图如1.1:
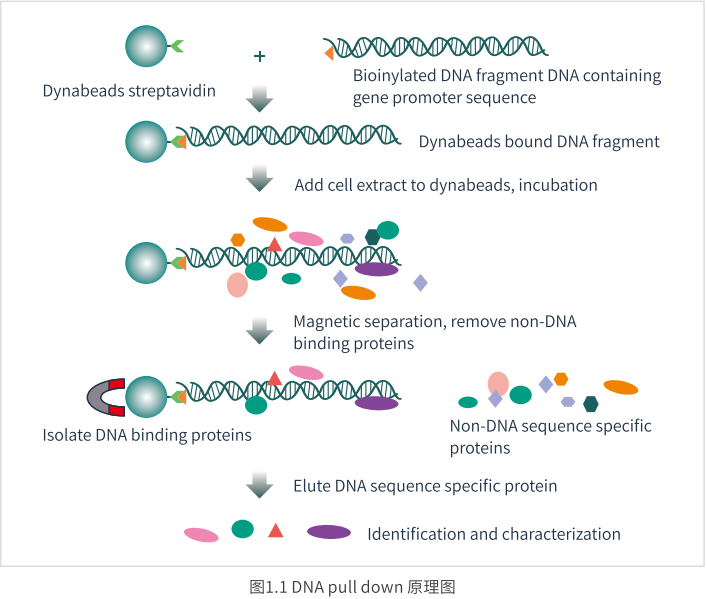
实验流程
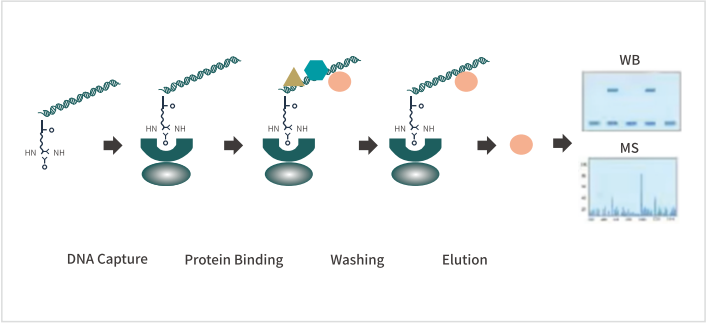
试剂盒组分、操作步骤等更多细节请查看zuixinban版说明书
常见问题与解析
Q1:通过pull-down 后银染验证发现,没有想要的目的条带?
1)有可能是样品被蛋白酶降解,对应的策略是需要添加蛋白酶抑制剂,所有操作保持 4℃以下冰上操作并防止冻融;
2)有可能是加入生物素标记DNA 量不足,可以增加生物 素标记DNA 量;
3)裂解液盐碱度太高,需用低盐碱度的裂解液;
4)加入细胞裂解液不 够,可以增加细胞裂解量。
Q2:如何提高DNA pull down实验的准确性和可靠性?
解析:提高DNA pull down实验的准确性和可靠性可以从多个方面入手。首先,优化DNA探针的设计和合成,确保其能够特异性地结合目标蛋白。其次,选择合适的磁珠和孵育条件,以提高蛋白与DNA探针的结合效率。此外,严格控制实验操作,避免污染和误差,也是提高实验准确性的关键。最后,结合后续的质谱检测等技术手段,对捕获的蛋白进行精确鉴定和分析,可以进一步提高实验的可靠性。
Q3:DNA pull down实验的原理是什么?
解析:DNA pull down实验的原理是基于体外结合。首先,根据启动子区域设计DNA探针并进行生物素标记,这些标记的探针随后结合到链霉亲和素修饰的磁珠上,形成磁珠-探针复合体。然后,将这个复合体与提取的蛋白孵育,以鉴定与DNA探针有特异性结合的蛋白质。
Q4:DNA pull down实验的成功率会受到哪些因素的影响?
解析:DNA pull down实验的成功率受到多种因素的影响。其中,蛋白的表达丰度是一个关键因素,低丰度的蛋白可能难以被捕获。此外,蛋白与DNA结合的强弱程度也会影响实验结果。实验操作中,如DNA探针的设计、磁珠的选择、孵育条件等,也都可能对成功率产生影响。
Q5:为什么实验对照组也能鉴定出蛋白?
解析:实验对照组鉴定出蛋白的可能原因有多种。首先,如果物种蛋白数据库完整度低或肽段注释质量差,可能导致非特异性结合。其次,实验过程中使用的试剂或外部环境中的蛋白污染,如人的角蛋白污染,也可能导致对照组出现蛋白信号。
Q6:DNA pull down实验中为什么选择双链DNA作为探针?
解析:在DNA pull down实验中,通常选择双链DNA作为探针。这是因为双链DNA能够形成稳定的双螺旋结构,相比于单链DNA或RNA,其结构更为稳定,不易发生自我折叠或形成复杂空间结构,从而提高了与蛋白结合的特异性和稳定性。
技术应用
DNA pull down技术的应用广泛,主要集中在以下几个方面:
-
转录因子结合位点分析:研究特定转录因子如何识别并结合到DNA上的特定序列,从而调控基因表达。通过设计含有潜在结合位点的DNA探针,进行pull down实验,可以鉴定与这些位点结合的转录因子,深入了解基因调控网络。
-
染色质相互作用研究:探索DNA与组蛋白修饰、染色质重塑复合体以及其他DNA结合蛋白的相互作用,揭示表观遗传调控机制。
-
疾病相关蛋白研究:在某些疾病中,特定蛋白质与DNA的异常结合可能导致基因表达异常。通过DNA pull down技术,可以发现这些疾病相关的蛋白质因子,为疾病机理研究和药物靶点筛选提供线索。
-
基因编辑验证:在CRISPR/Cas9等基因编辑技术中,DNA pull down可以用来验证编辑后是否成功改变了特定蛋白质与DNA的结合模式,评估基因编辑的效果。
为了提高DNA pull down实验结果的可靠性和准确性,常结合以下方法进行验证:
-
质谱分析与生物信息学:将pull down得到的蛋白质进行质谱分析,鉴定出的蛋白质列表可通过生物信息学工具进一步筛选,寻找功能相关的蛋白质群或已知的DNA结合蛋白,以排除假阳性结果。
-
ChIP-qPCR/ChIP-seq:结合染色质免疫沉淀(Chromatin Immunoprecipitation, ChIP)技术,特别是ChIP-qPCR或ChIP-seq,可以验证特定蛋白质是否在活细胞中确实与特定DNA序列结合,提供体内证据。
-
EMSA(Electrophoretic Mobility Shift Assay)或Shift-Western:这些技术可以直观地观察蛋白质-DNA复合体的形成,通过凝胶电泳观察蛋白质对特定DNA探针的迁移影响,进一步确认DNA pull down的结果。
-
体外结合实验:通过纯化感兴趣的蛋白质,并在体外条件下与标记的DNA探针进行结合实验,验证两者的直接相互作用,排除细胞内其他因素的干扰。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验纯化方法。本文对从陆生动物、植物、微生物以及海洋生物来源的DNA的传统提取方法及近年来诸多的改良方法进行综述。1.动物来源的DNA的提取1. 1经典提取方法酚抽提法 、异丙醇沉淀法以及甲酞胺裂解法是提取DNA最为经典的方法,目前很多方法的改进都是在这些方法的基础上进行的,这三种方法均利用蛋白酶K和十二烷基硫酸钠(SDS)消化破碎细胞。在前两种方法中裂解液先用酚/氯仿去除蛋白质,再分别用乙醇或异丙醇沉淀DNA。甲酞胺法是利用高浓度的甲酞胺解聚蛋白质与DNA的结合,然后利用透析来处理DNA样品。这些经典方法获得
而在无磁场时无磁性。7、不同的Dynabeads类型特殊的亲水和疏水特性能促进分子结合到它们的表面上。Dynal Biotech提供各种在其表面已包被或未包被有配基的磁珠。二、Dynabeads的大小在细胞分离和细胞修饰过程中,标准尺度的Dynabeads 磁珠是4.5 μm,可应用于各种样本(如全血、骨髓、白细胞层)的细胞分离。而2.8 μm的Dynabeads通常用于分子水平上,如DNA、RNA、蛋白质的分离等。Dynal Biotech拥有专门的技术来生产直径为1~10 μm的Dynabeads
基因 [例如 Ezh2] 的结合)就可能会低于检测阈值。 相比之下,酶消化方法使用微球菌核酸酶切入染色质核小体之间的连接区域,柔和地把染色质剪切成均一片段。酶消化无需高热或去污剂,且如果使用与细胞数量成比例的酶用量,还可得到一致的结果。因此,酶消化方法更易于控制,可避免抗原表位和 DNA 被剪切或变性,且得到的一致、高品质的染色质样品还有利于免疫沉淀。 下方显示的实验分别使用 SimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic
 技术资料
技术资料




