武汉傲星生物科技有限公司
2 年
手机商铺
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
武汉傲星生物科技有限公司
入驻年限:2 年
- 联系人:
李彬
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
技术服务、ELISA 试剂盒、细胞库 / 细胞培养、抗体、试剂、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 代理商 经销商
公司新闻/正文
IF:8.3,转录组测序+网络药理学验证,揭秘百年中药如何唤醒“沉睡”毛囊!
10356 人阅读发布时间:2025-10-20 10:17
题目:转录组测序揭示祛湿育发汤通过上调FOXN1和TGM3促进毛周期和角化治疗雄激素性脱发
英文名:Transcriptomics sequencing reveals Qu-shi-yu-fa Decoction promotes hair cycle and keratinization by upregulating FOXN1 and TGM3 to treat androgenetic alopecia
杂志:Phytomedicine
影响因子:8.3
发表时间:2025年5月12日
研究背景:雄激素性脱发(AGA)影响超过90%的脱发患者,且男性更为常见。祛湿育发汤(QSYF)是一种传统中药方剂,在临床实践中对AGA显示出积极效果,但其确切治疗机制尚未完全阐明。
研究思路:本研究首先通过UPLC-MS/MS分析鉴定QSYF的活性成分,建立C57BL/6小鼠的AGA模型评估QSYF效果,通过皮肤镜观察毛发生长情况,组织学检查皮肤组织,对小鼠皮肤样本进行RNA-seq以确定生物过程和靶点,通过Western blotting、RT-PCR和免疫荧光测定评估RNA-seq分析获得的生物过程和靶点,使用靶点抑制剂处理小鼠并观察毛发生长进行反向验证,利用网络药理学确定靶点发挥作用的关键信号通路,并通过Western blotting进行验证。
研究结果:
1、祛湿育发汤(QSYF)的化学成分表征
总离子流图如图1所示。已鉴定出的成分包括15种黄酮类化合物、6种有机酸以及其他成分。
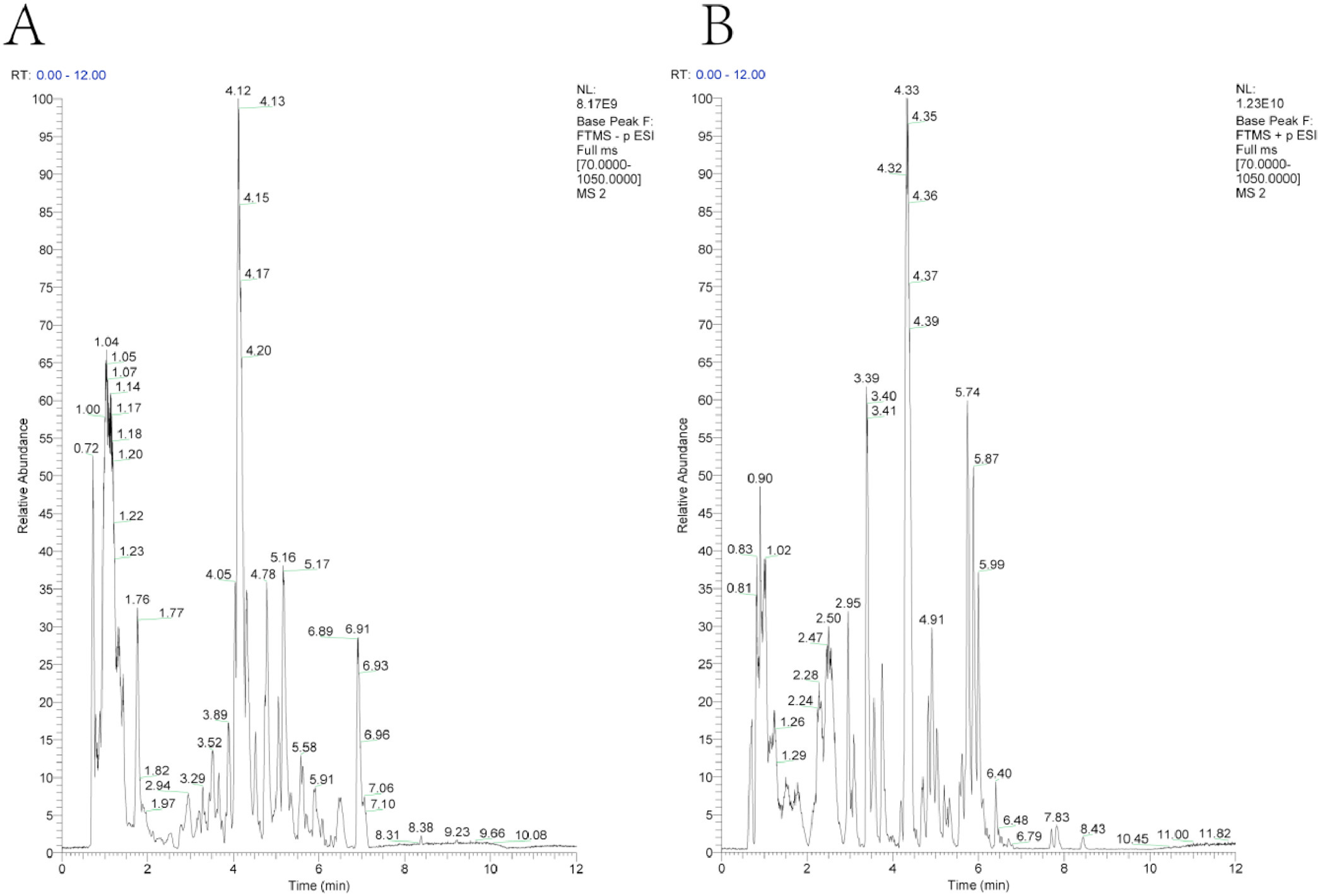
图1
2、祛湿育发汤(QSYF)促进雄激素性脱发(AGA)模型小鼠毛发生长
本研究率先探究了QSYF在AGA模型中的治疗效果,具体造模流程与给药方法详见图2A。为直观评估治疗效果,我们在小鼠脱毛后第0、3、7、10、14、17和21天进行拍照(图2B)。对小鼠皮肤颜色进行量化评分,评分标准见图2C。结果显示(图2D),脱毛后第3天起,AGA模型组小鼠的皮肤颜色评分开始低于对照组,而经非那雄胺和QSYF处理后,小鼠皮肤颜色评分显著升高。各组小鼠体重无显著差异(图2E)。上述结果提示,QSYF可促进AGA模型小鼠毛发再生。
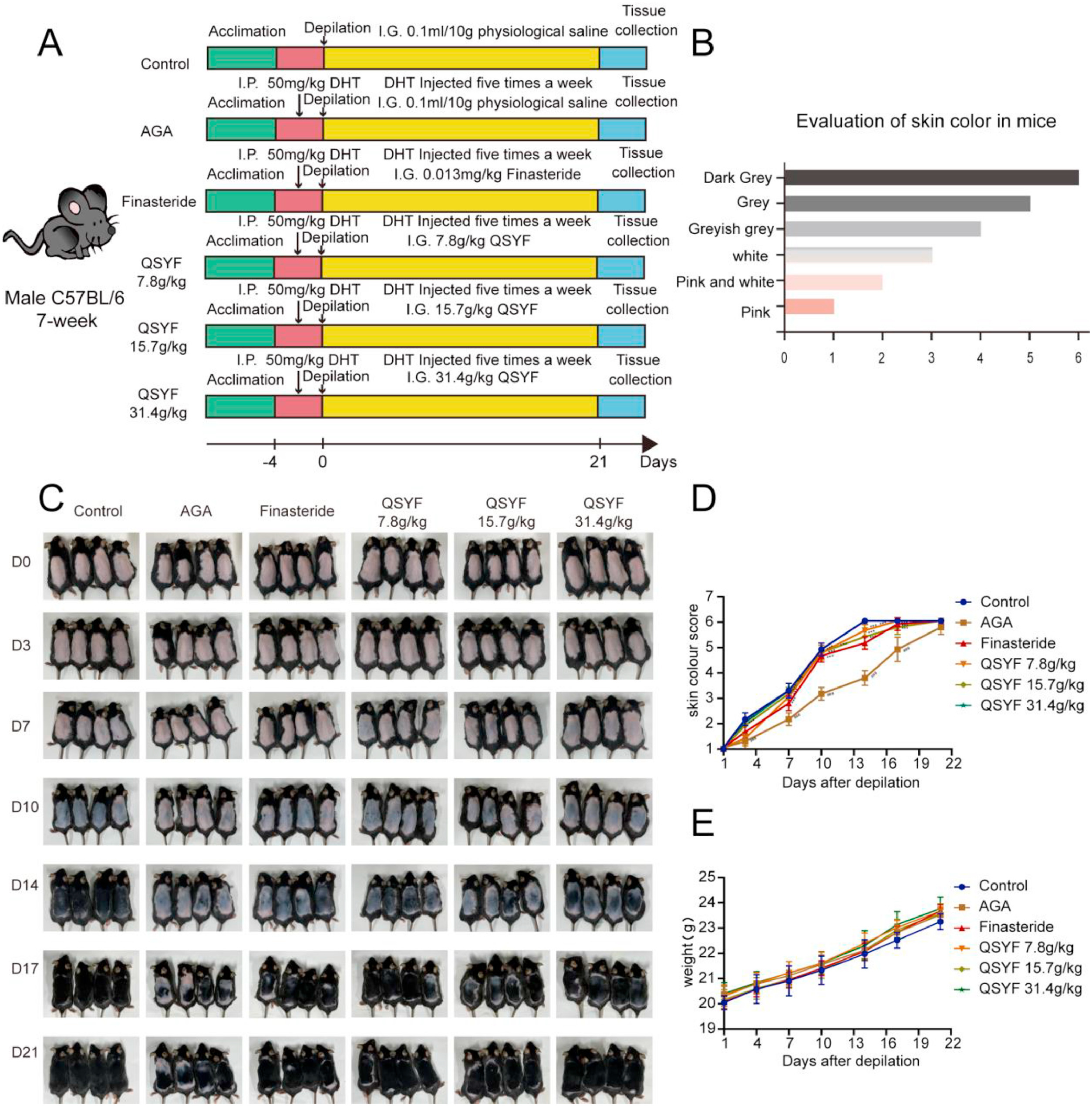
图2
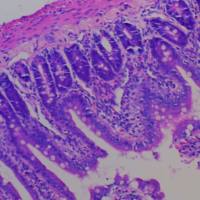
3、祛湿育发汤(QSYF)增加皮肤厚度与毛球直径,改善毛囊周期
小鼠皮肤镜结果(图3A)与整体拍照结果一致。小鼠皮肤组织苏木-伊红(HE)染色结果(图3B)显示,脱毛后第0天,各组毛球大小和皮肤厚度无显著差异,说明此阶段各组小鼠毛囊处于相同周期阶段。脱毛后第7天,对照组毛囊进入生长期,毛球直径和皮肤厚度(图3C、G)显著大于AGA模型组,而AGA模型组毛囊仍处于休止期。脱毛后第10天和第14天(图3D、E、H、I)。上述结果表明,QSYF可增加皮肤厚度和毛球直径,改善毛囊周期。
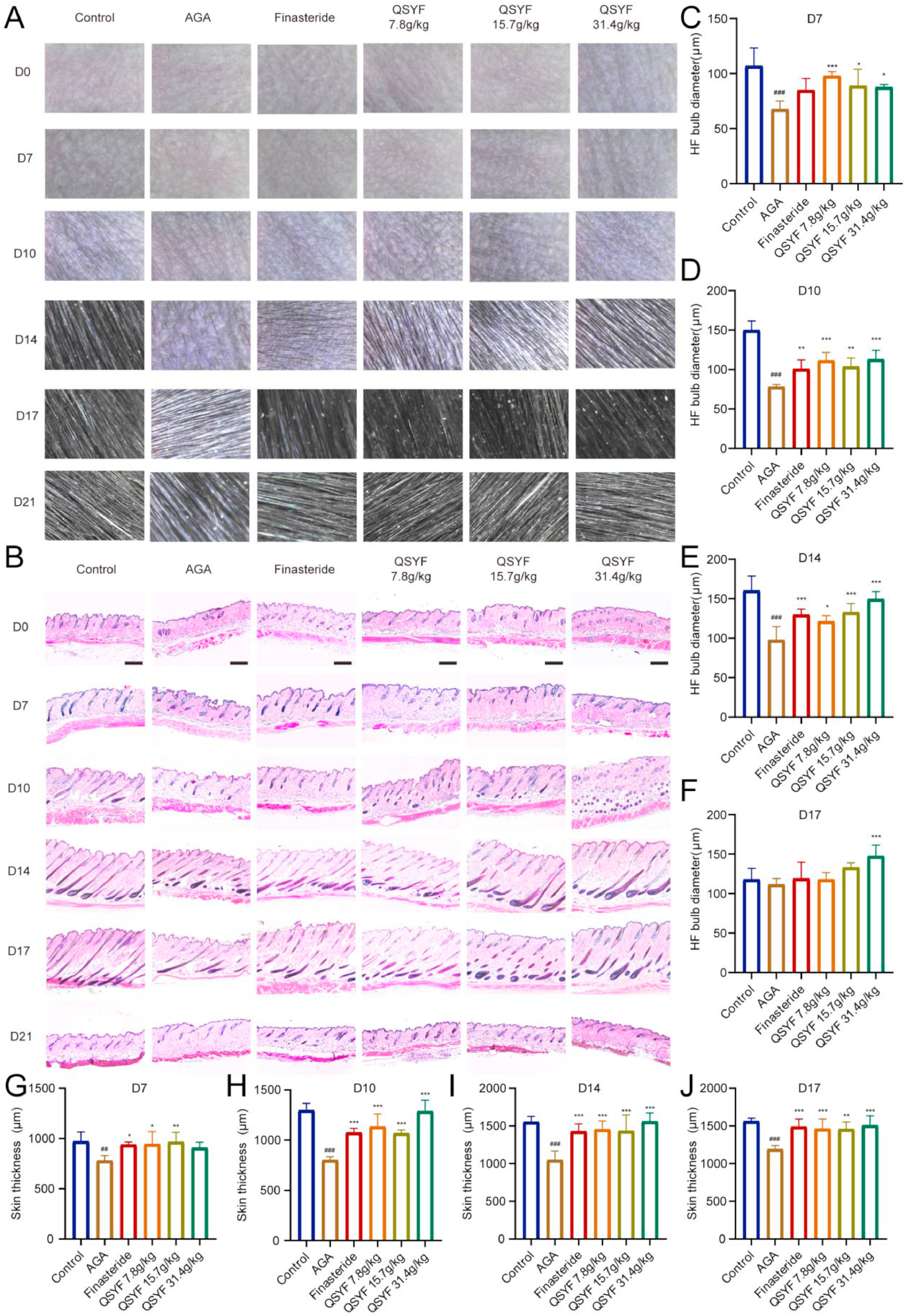
图3
4、祛湿育发汤(QSYF)通过上调毛囊周期与角化过程治疗雄激素性脱发(AGA)
为阐明QSYF治疗AGA的分子机制,对小鼠皮肤组织进行了精细的mRNA测序(RNA-seq)(图4A),并通过热图展示AGA模型组与QSYF处理组之间的差异表达基因(DEGs)(图4B)。
将这些差异表达基因用于基因本体论-生物学过程(GO-BP)分析,并筛选出与脱发相关的生物学过程进行作图(图4C),发现这些基因主要富集于角化、毛囊周期、皮肤发育等生物学过程。为探究QSYF如何调控这些生物学过程,我们进行了基因集富集分析(GSEA),结果显示QSYF可上调角化、毛囊周期和皮肤发育相关生物学过程(图4D、E、F);随后对其中差异基因对应的蛋白质进行相互作用分析,并计算其度值和中期值,为后续深入研究奠定基础。
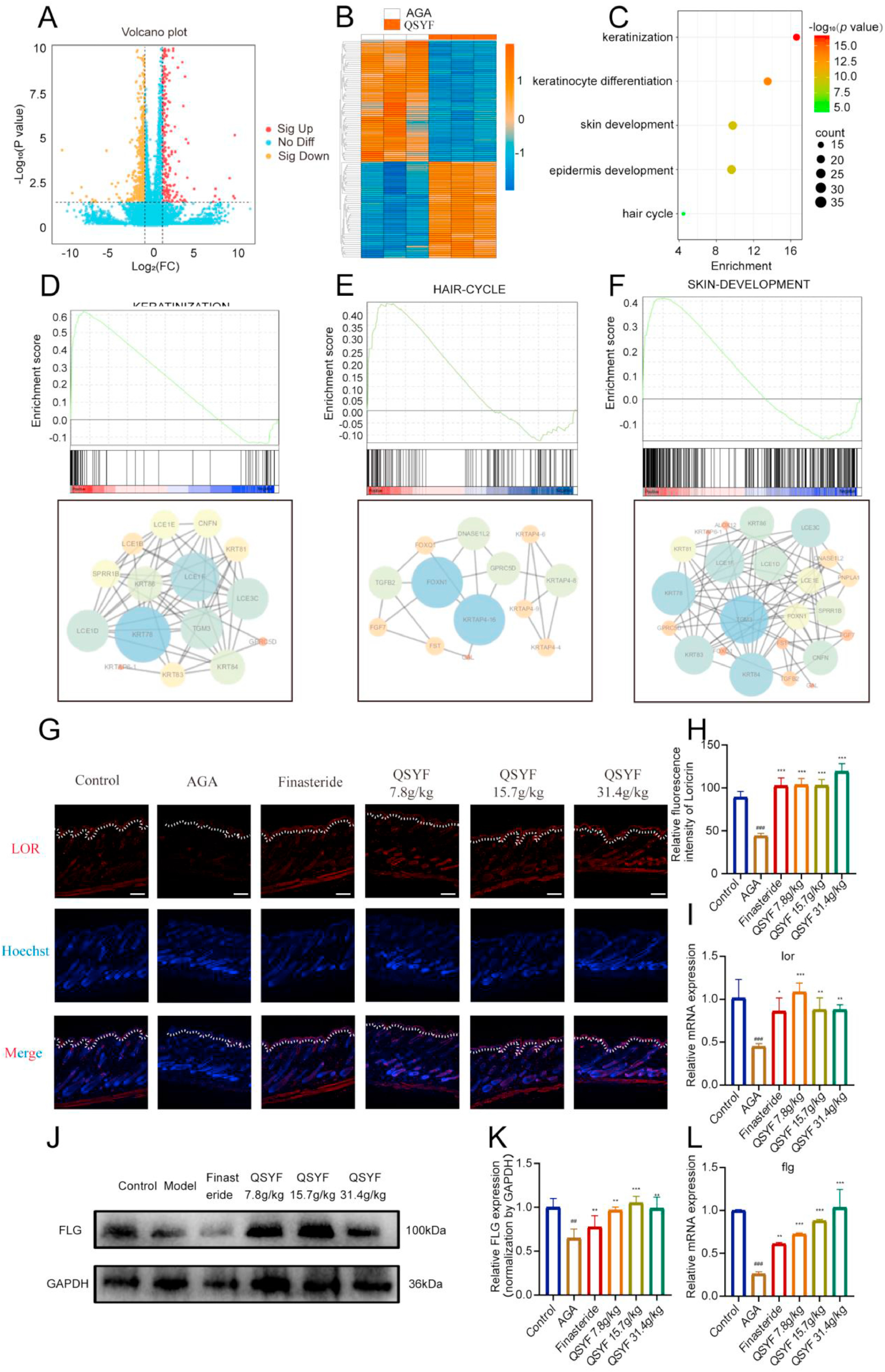
图4
5、祛湿育发汤(QSYF)通过激活WNT信号通路、增强毛囊活性改善毛囊周期
为探究QSYF作用的详细机制,对皮肤组织进行Ki67染色(图5A、B)。检测了小鼠皮肤组织中与WNT信号通路相关的蛋白质,蛋白质印迹法(Western blot)结果(图5C)显示,DHT处理后,小鼠皮肤组织中Wnt3a和β-连环蛋白(β-Catenin)的蛋白表达显著下调(p<0.05),糖原合成酶激酶-3β(Gsk-3β)的磷酸化水平显著降低(p<0.05),而非那雄胺和QSYF处理可逆转这一现象(图5D、E、F)。β-连环蛋白(β-Catenin)的免疫荧光染色结果(图5I)与Western blot结果一致。定量PCR结果(图5G、H)也与上述结果一致,QSYF处理可调控WNT3A和β-连环蛋白(β-Catenin)的转录水平。上述结果提示,QSYF可激活WNT信号通路,促进毛囊乳头细胞增殖。
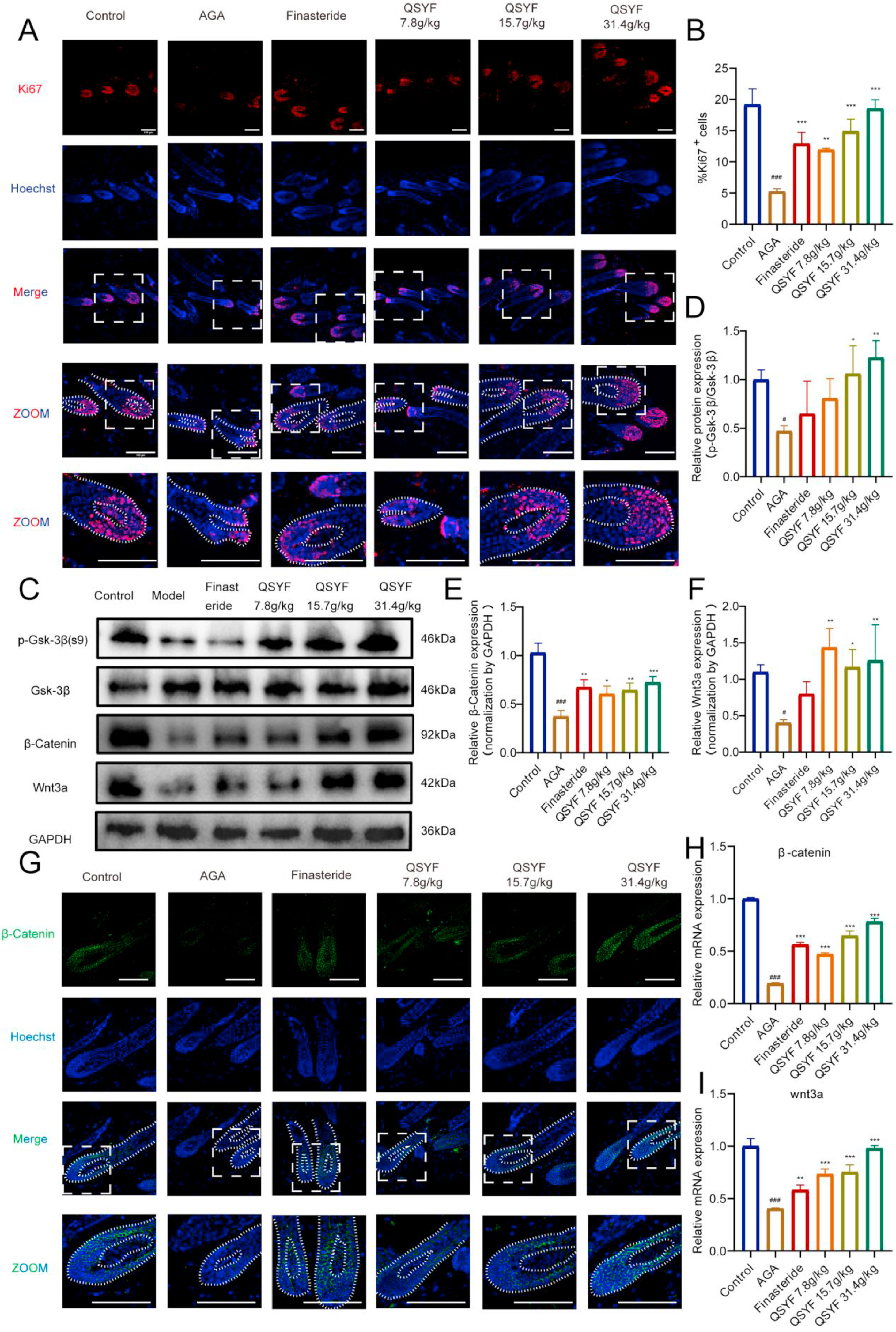
图5
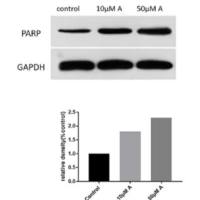
6、祛湿育发汤(QSYF)上调FOXN1和TGM3的表达
统计了6个检测样本中TGM3和FOXN1的相对转录水平(图6A),结果显示,QSYF处理后,FOXN1和TGM3的转录水平显著升高(图6B、C)。因此,将FOXN1和TGM3选定为QSYF调控毛囊周期和角化过程的核心靶点。Western blot和免疫组织化学染色技术检测小鼠皮肤组织中FOXN1和TGM3的表达,结果一致显示,QSYF可促进AGA模型小鼠皮肤组织中FOXN1和TGM3的表达(图6D-I)。QSYF处理可提高小鼠皮肤中FOXN1和TGM3的转录水平。综上,我们确定QSYF可在转录水平和蛋白表达水平上上调皮肤组织中FOXN1和TGM3的表达。
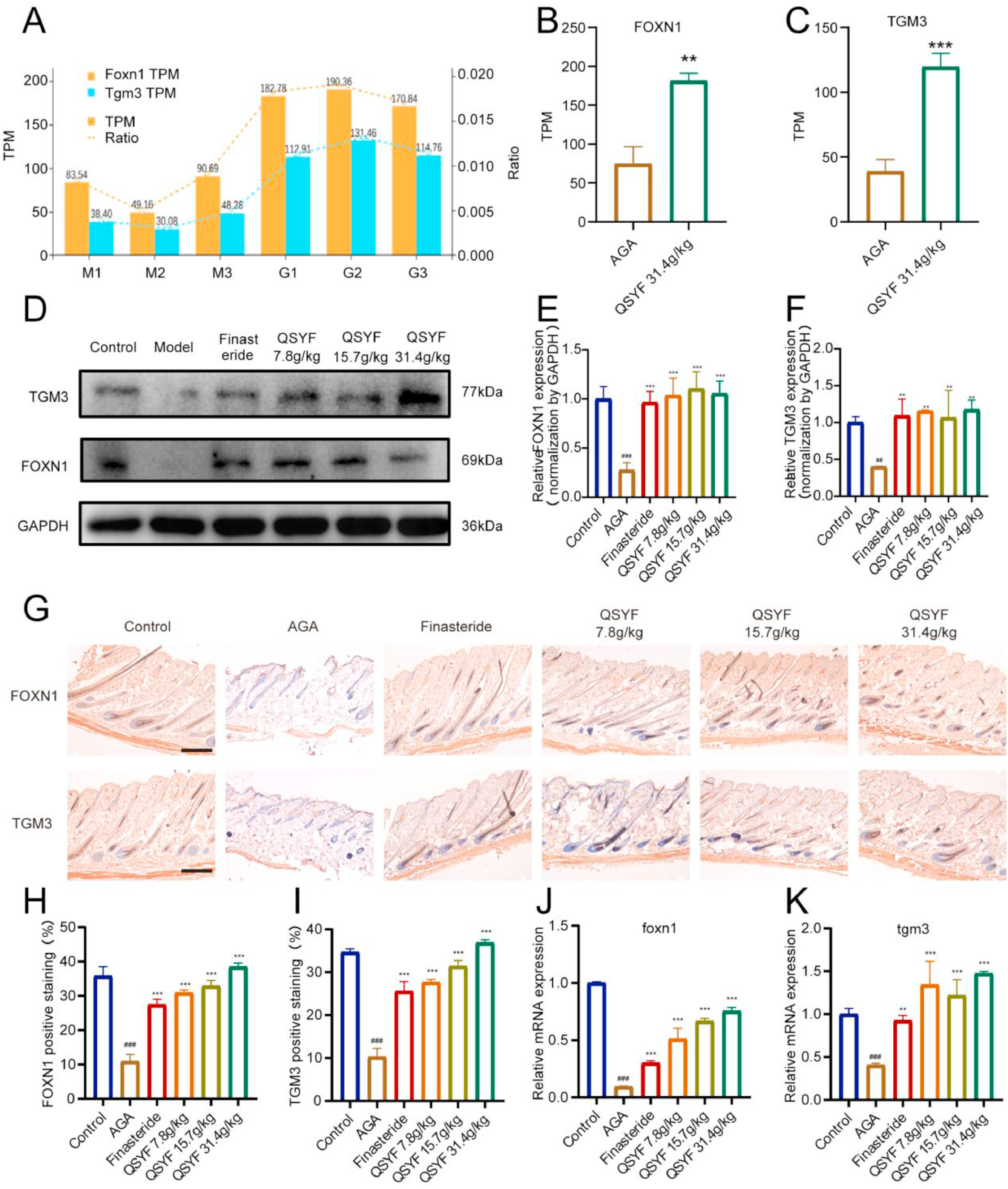
图6
7、抑制FOXN1和TGM3加重雄激素性脱发(AGA)
为明确证实叉头框蛋白N1(FOXN1)和转谷氨酰胺酶3(TGM3)是祛湿育发汤(QSYF)发挥治疗作用的核心靶点,分别用生理盐水、LDN193189(骨形态发生蛋白(BMP)信号通路抑制剂,FOXN1是BMP信号通路下游的转录因子)、半胱胺(转谷氨酰胺酶抑制剂)以及LDN193189与半胱胺的混合物处理雄激素性脱发(AGA)模型小鼠,实验期间持续给予31.4g/kg剂量的QSYF。
结果显示,半胱胺组、LDN193189组以及半胱胺+LDN193189组小鼠的毛发生长均受到抑制,毛发生长速度慢于31.4g/kgQSYF单独处理组,且半胱胺+LDN193189组的毛发生长抑制效果最为显著(图7A)。皮肤镜结果(图7B)与上述结果一致。
皮肤颜色评分结果显示(图7D),脱毛后第10天、14天和17天,31.4g/kgQSYF组小鼠的皮肤颜色评分高于其余各组;其中,TGM3和FOXN1同时被抑制的半胱胺+LDN193189组,其皮肤颜色评分始终最低。
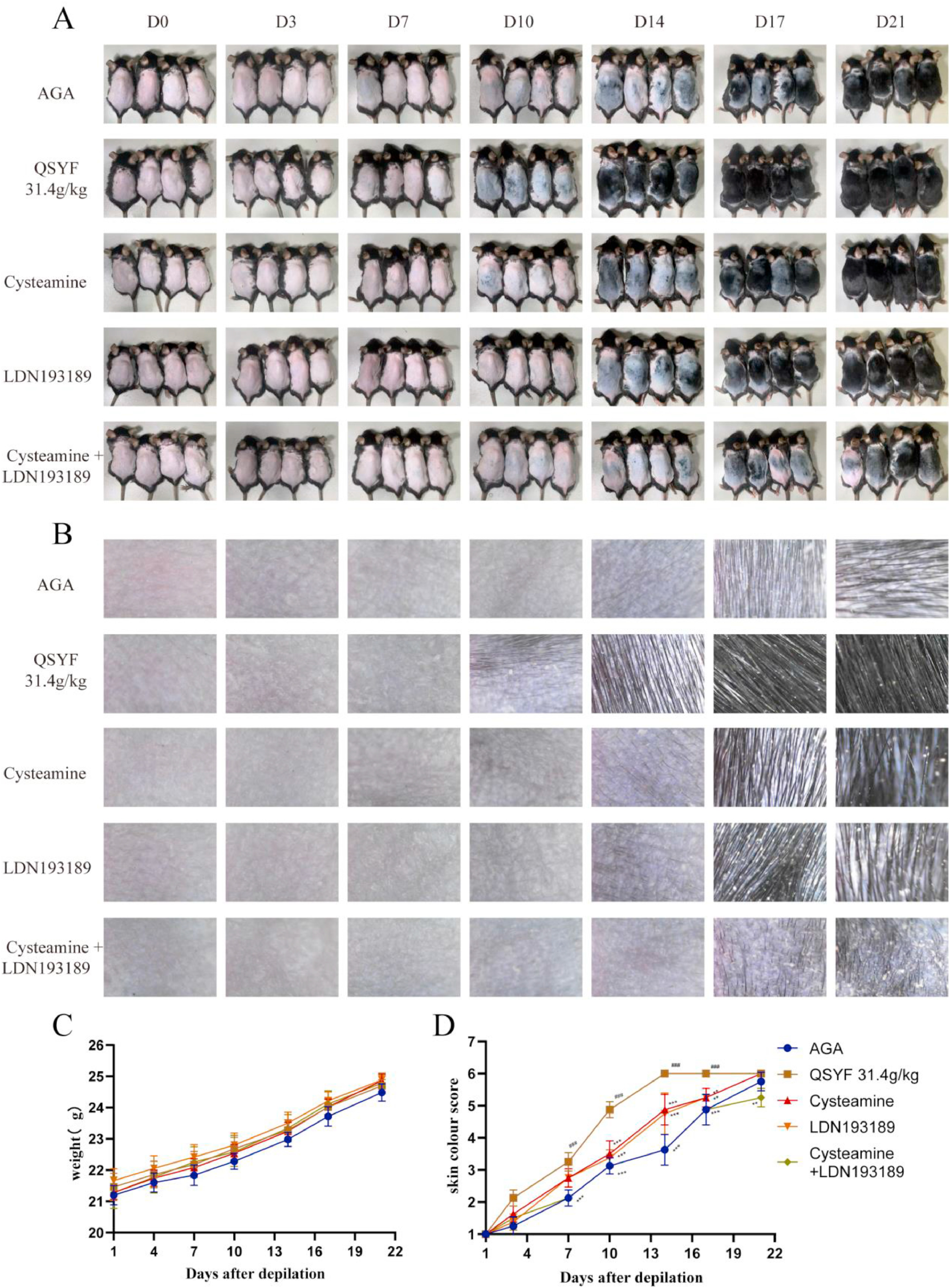
图7
苏木-伊红(HE)染色结果(图8A)显示,脱毛后第10天、14天和17天,31.4g/kg QSYF组小鼠的皮肤颜色评分显著高于其余各组;且该组小鼠的毛球直径和皮肤厚度均显著大于半胱胺+LDN193189组(图8B-G)。上述结果表明,QSYF通过作用于TGM3和FOXN1发挥治疗AGA的作用。
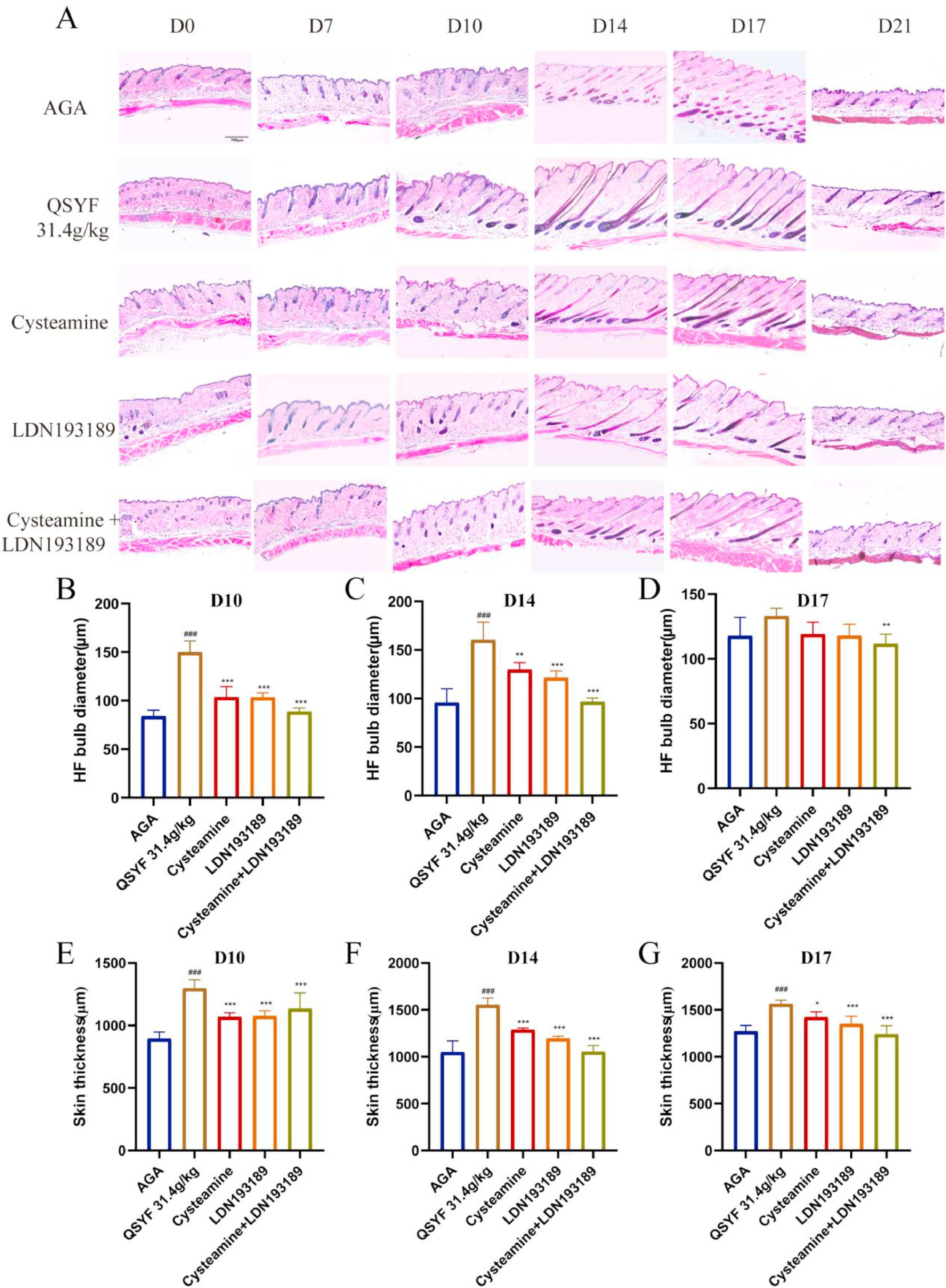
图8
8、网络药理学揭示祛湿育发汤(QSYF)治疗雄激素性脱发(AGA)的潜在信号通路
网络药理学方法探究祛湿育发汤(QSYF)的作用机制。通过数据库与筛选QSYF的可能成分,获得了97种活性成分对应的264个作用靶点(图9A)。之后将药物靶点、疾病靶点与mRNA测序(RNA-seq)获得的差异基因进行交集分析(图9B)。借助String数据库构建蛋白质-蛋白质相互作用(PPI)网络(图9C),发现AKT1、MAPK1等基因的度值较高。对这53个核心靶点进行基因本体论(GO)富集分析,结果显示它们主要与细胞群体增殖、转录调控复合物、转录因子结合等功能相关(图9D)。KEGG富集分析发现,QSYF治疗AGA所涉及的信号通路包括磷脂酰肌醇3-激酶-蛋白激酶B(PI3K-Akt)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路等(图9E)。上述结果揭示了QSYF治疗AGA的潜在信号通路。
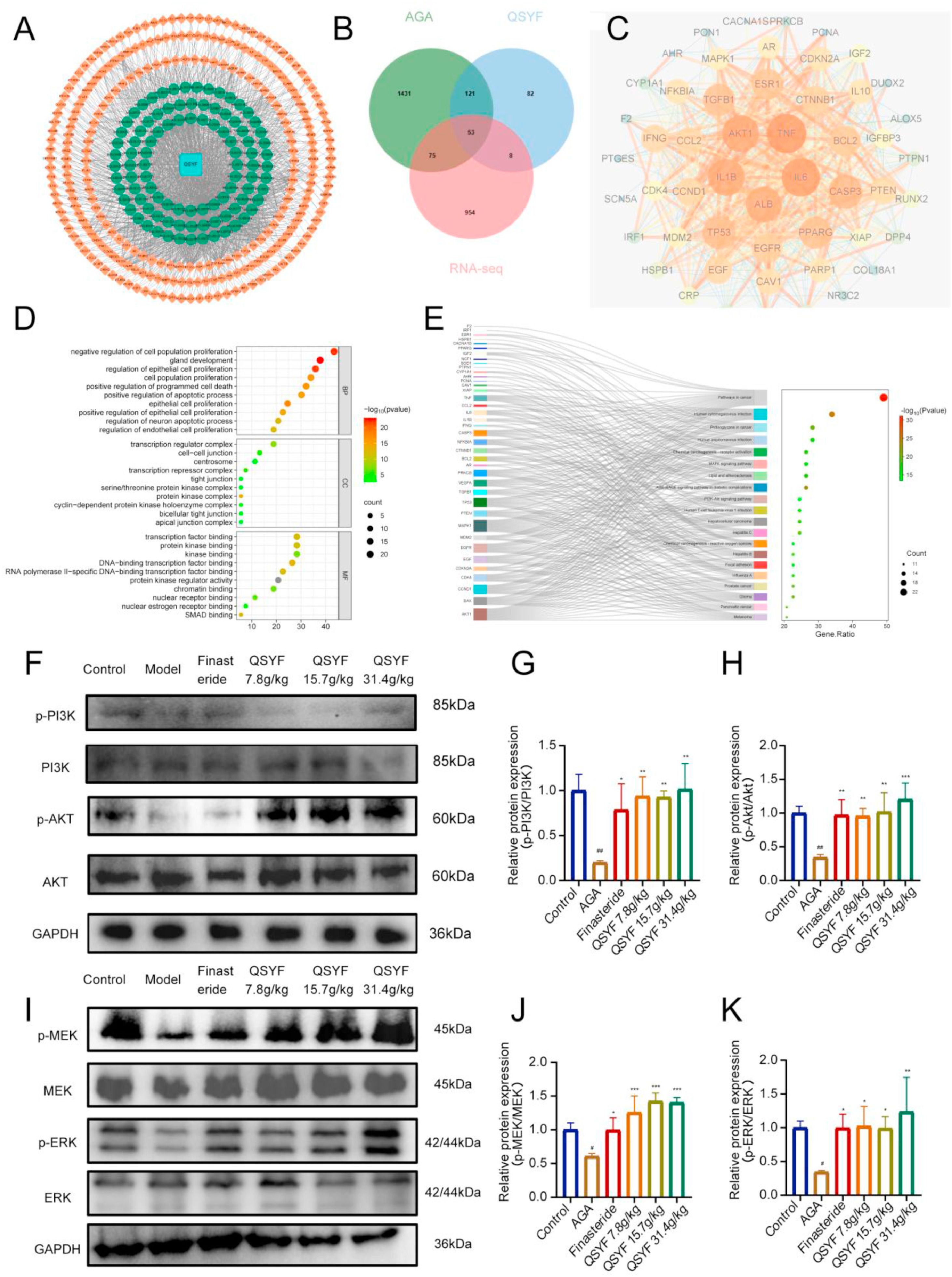
图9
9、祛湿育发汤(QSYF)激活丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶-蛋白激酶B(PI3K-AKT)信号通路
多项研究表明,TGM3可通过磷脂酰肌醇3-激酶-蛋白激酶B(PI3K-Akt)、丝裂原活化蛋白激酶(MAPK)等信号通路发挥治疗作用。因此,从逻辑上而言,接下来探究了TGM3介导的生物学过程是否通过上述信号通路实现。
经QSYF处理后,AGA模型小鼠背部皮肤中PI3K和AKT的激活水平显著升高(图9F、G、H),这表明PI3K-Akt信号通路被激活;同时,MEK(丝裂原活化蛋白激酶激酶)和ERK(细胞外调节蛋白激酶)的磷酸化水平也显著升高,这提示MAPK信号通路被触发。上述结果表明,QSYF可通过激活PI3K-Akt和MAPK信号通路,调控角化过程;(同时,QSYF也可通过相关)信号通路调控毛囊周期与角化过程。
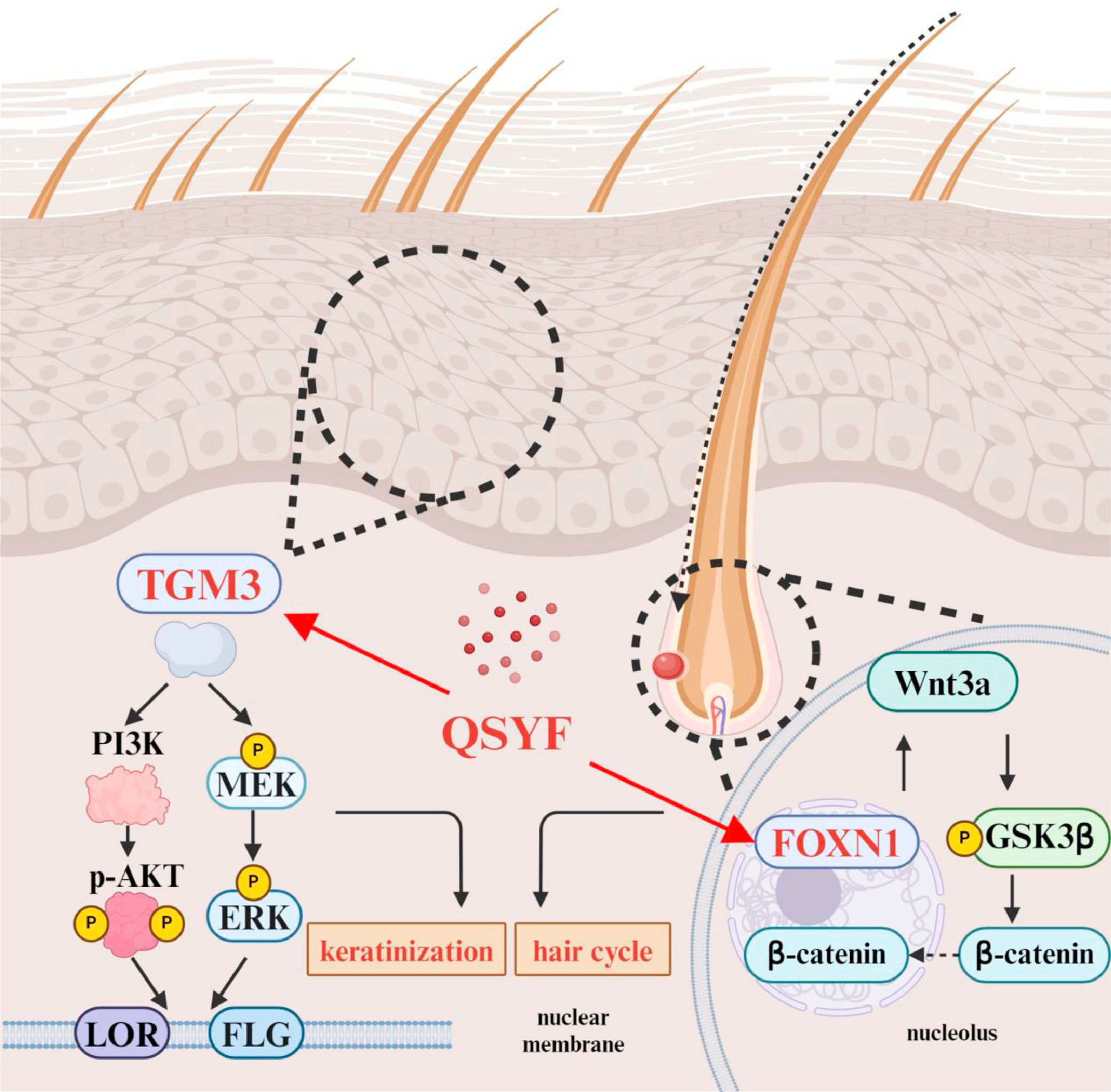
图10
总结:本研究首次证明QSYF通过上调FOXN1的表达调节毛周期,并通过上调TGM3的表达促进角化,两者共同发挥治疗AGA的作用。研究不仅为中药疗法的多靶点多通路研究提供了有价值的见解,也为QSYF治疗AGA提供了理论基础。星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!