His 融合蛋白纯化常见问题解答
蛋白过镍柱纯化的原理:Ni-NTA 纯化介质纯化带有 His6-Tag 的融合蛋白是目前蛋白纯化中最常使用的一种方法。Ni 柱中的氯化镍或者硫酸镍可以与有 HIs(组蛋白) 标签的碱性蛋白蛋白结合,组蛋白标签一般是 6 个组氨酸 (碱性氨基酸)。在蛋白上样后,带有组氨酸标签的蛋白特异性结合到柱子里,其他的杂蛋白流出。Ni 柱中的氯化镍或者硫酸镍也可以与咪唑结合,采用咪唑洗脱,咪唑竞争性结合到硫酸镍上,目的蛋白就被洗脱了,这时候收集穿出液,里面就是目的蛋白,然后透析掉咪唑即可。 上样,清洗,洗脱,基本三个步骤就结束了。
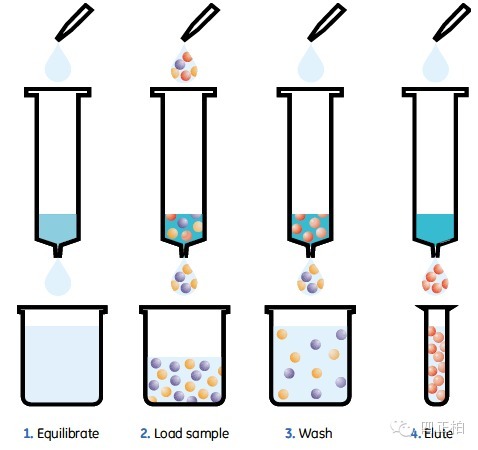
Ni-NTA 常见问题及建议
1. His 标签蛋白没有与柱结合:
a. 可能原因:超声的功率不对 ( 太大,蛋白炭化,太小,蛋白没有释放)。
解决方法:改变超声功率,并在超声前加入溶菌酶。
b. 可能原因:样品或者是结合缓冲液不正确。
解决方法:检测 pH 及样品和结合缓冲液的组成份。确保在溶液中鳌合剂或强还原剂的浓度及咪唑的浓度不是太高。
c. 可能原因:组氨酸标签暴露不完全。
解决方法:在变性条件下 ( 用 4-8 M 脲,或 4-6 M 盐酸胍) 进行纯化。
d. 可能原因:His 标签丢失。
解决方法 1:WB 检查 His 是否表达,上游构建,改变 His-tag 的位置 (C- 端或 N- 端),必要时增加 His 个数。
解决方法 2:孵育的时间不够,降低流速和增加孵育的时间。
解决方法 3:改变螯合的金属离子,寻找到最佳的结合金属离子。
Ni2+ 通常是从宿主细胞蛋白中纯化大多数 6×His 标记的重组蛋白质的首选金属离子。也是一般最常用的离子。蛋白和金属离子之间的结合强度受几种因素影响,包括长度、位置、亲和标记在蛋白的暴露程度、所用离子的类型、以及缓冲液的 pH,因此一些蛋白用其他离子可能更容易地进行纯化而不用 Ni2+。
2. His 标签蛋白没有被洗脱下来:
a. 可能原因:洗脱条件太温和 (组氨酸标记的蛋白质仍然结合在柱上,结合力较强)。
解决方法:增加咪唑的梯度洗脱或降低 pH 来找出最佳的洗脱条件。
b. 可能原因:降低 pH 的方法洗脱的,若 pH 低于 3.5,会导致镍离子脱落。
解决方法:改变洗脱办法,咪唑竞争性洗脱。
c. 可能原因:蛋白已沉淀在柱上。
解决方法: 减少上样量,或使用咪唑的线性梯度而不是分步洗脱以降低蛋白的浓度。试用去污剂或改变 NaCl 的浓度,或在变性条件 ( 去折叠) 下洗脱 ( 用 4~8 M 脲,或 4~6 M 盐酸胍)。
d. 可能原因:非特异性疏水或其他相互反应。
解决方法:加非离子去污剂到洗脱缓冲液 (如:2% Triton X-100) 或增加 NaCl 的浓度。
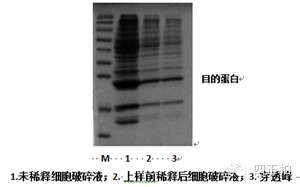
3. His 标签蛋白洗脱后杂带较多
a. 可能原因:蛋白酶部分降解了标签蛋白。
解决方法:添加蛋白酶抑制剂。
b. 可能原因:杂质对镍离子有更高的亲和性。
解决方法 1:咪唑浓度必须优化,以确保高纯度 ( 宿主细胞蛋白质的低结合) 和高产率 ( 组氨酸标记的目标蛋白质的强结合) 之间的最佳平衡。分步或者线性洗脱摸索出最优的咪唑结合和清洗浓度; 在样品中加入与结合缓冲液同样浓度的咪唑; 咪唑的梯度不大 (20 个或更多的柱床体积),可能分离出有相似结合强度的蛋白。
解决方法 2:筛选最适合的缓冲液条件,NaCl 浓度,pH 的范围都需要进行筛选。对于单一目标蛋白在进行缓冲液筛选时,将缓冲液、盐、甘油和还原剂设计成不同的混合配方来进行优化。
解决方法 3:若以上优化的条件都不能去除杂质蛋白,需要考虑多步纯化的思路,如利用 Strep 标签进行两步纯化或采用 Subtractive method 进行纯化。
c. 可能原因:杂质和标签蛋白结合在一起。
解决方法:在超声破碎细胞之前加入去垢剂或者还原剂; 增加去垢剂的浓度 ( 2% Triton X-100 or 2% Tween 20); 或者在 Wash buffer 中增加甘油的浓度 (50%) 减少非特异性的相互反应; 考虑增加咪唑的浓度或者改变金属离子。
d. 可能原因:洗涤不充分。
解决方法:增加洗涤的次数,使洗涤充分。
4. 使用几次后 Ni 柱载量下降,挂柱效率低,如何处理?
可能原因:逐渐积累沉淀,变性或非特异结合的蛋白占据了有效的结合位点,而通过洗脱液无法彻底清洗所致。
较温和的清洗方法:
用 2 倍柱体积的 6M 盐酸胍或 8M 尿素洗涤,然后用 5 倍体积的缓冲液洗涤,以去除沉淀或变性物质。用 2 倍柱体积的 1% Triton X-100 洗涤,然后用 5 倍柱体积的缓冲液洗涤,以去除疏水结合的物质。若改变不明显,可选择强烈清洗方式。
强烈清洗方式:
首先用 5-10 倍柱体积的脱镍缓冲液(20 mM 磷酸钠, 0.5 M NaCl,50 mM EDTA, pH 7.4)洗涤,迚行脱镍操作,然后用 5~10 倍柱体积的平衡缓冲液冲洗,最后用 5-10 倍柱体积的双蒸水冲洗;随后进行清洗操作,去除离子型杂蛋白,可以用 5 倍柱体积的 1.5 M NaCl 溶液,然后 10 倍柱体积的双蒸水冲洗;去除沉淀或变性蛋白,可以用 1M 氢氧化钠溶液,结合 1~2 小时,然后用 10 倍柱体积的平衡缓冲液和 10 倍柱体积的双蒸水迚行冲洗;去除疏水蛋白或者脂蛋白,可以用 5-10 倍柱体积的 30% 异丙醇溶液清洗,然后 10 倍柱体积的双蒸水洗涤;最后进行生镍操作,用 0.1M 硫酸镍上柱,随后 5 倍柱体积的双蒸水和平衡缓冲液迚行洗涤,如需保存,保存在 20% 乙醇溶液。
5. 镍柱使用中出现棕色是怎么回事?
可能原因:缓冲液中 DTT 的影响, DTT 会对镍柱的颜色和纯化效率有很大的影响, 在碱性的缓冲液条件下,镍离子会被 DTT 还原生成棕色的沉淀,所以要尽量避免 DTT 的参与。
因此,若您的样品中含有 DTT,在上样之前, 我们推荐采用不含还原性试剂的空白运行来除去任何较弱结合的镍离子;空白运行方法(使用不含还原剂的平衡液和洗脱液)1)5 倍柱体积的双蒸水洗柱 ;2)5 倍柱体积的平衡液洗柱;3)5 倍柱体积的洗脱液洗柱;4)10 倍柱体积的平衡液平衡。当不使用时,勿将 Ni Sepharose 6 Fast Flow 保存于含还原性试剂的缓冲液中。
6. 填料是否可以重复使用?可以使用多少次?
如果维护的好的话, 填料在其效期之内可以一直重复使用。如果每次都是纯化同样的蛋白就没有必要剥离掉镍离子重新挂镍,一般经过 5-7 次纯化之后可以进行脱镍和再生镍的操作。如果柱子反压高了,填料需要做彻底的在位清洗 CIP,在清洗之前,为了避免金属盐的沉淀,需要剥离掉镍离子,然后再重新挂镍,清洗后保存在 20% 的乙醇中。
- 大肠杆菌高效表达外源蛋白的策略
大肠杆菌表达系统是发展最早、目前最为成熟的表达系统。因其遗传背景清楚、繁殖快、成本低、表达量高、表达产物容易纯化、稳定性好、抗污染能力强以及适用范围广等,是...
- His 融合蛋白纯化常见问题解答
蛋白过镍柱纯化的原理:Ni-NTA 纯化介质纯化带有 His6-Tag 的融合蛋白是目前蛋白纯化中最常使用的一种方法。Ni 柱中的氯化镍或者硫酸镍可以与有 HIs(组蛋白)...
- GST 融合蛋白纯化常见问题指南
谷胱甘肽 S 转移酶(GST)是一个含有 211 个氨基酸的蛋白,通常将该蛋白加入到重组蛋白的末端以便对该重组蛋白进行纯化或检测。具有组氨酸的非融合蛋白会产生非特...
- DNA 甲基化修饰
DNA 甲基化修饰作为一种重要的表观遗传修饰,能通过影响染色质结构、DNA 构想、稳定性以及蛋白质相互作用方式等,起到调控基因表达的作用。与多种肿瘤的发生、发展密...
- 组织分离优化指南
尽管对于特定细胞种类的细胞分离步骤的优化,与细胞恢复的各种所需特性有关,但仍可以建立通用的优化指南。结合合理的实验设计方案,以下就细胞分离和酶的使用提出优化...
- 如何 30 秒完成抗体标记?
英国生物偶联技术专家级公司 InnovaBiosciences 为您提供一步法快速标记试剂盒!Perfect!Innova Biosciences 成立于 2002 年,是世界领先的生物偶联技术公司。...
- 昆虫杆状病毒表达系统
昆虫杆状病毒表达系统 (baculovirus expression vector system, BEVS) 以昆虫杆状病毒为外源基因载体, 昆虫和昆虫细胞为受体的表达系统。昆虫细胞与哺乳动...







