GST 融合蛋白纯化常见问题指南
谷胱甘肽 S 转移酶(GST)是一个含有 211 个氨基酸的蛋白,通常将该蛋白加入到重组蛋白的末端以便对该重组蛋白进行纯化或检测。具有组氨酸的非融合蛋白会产生非特异性结合,这会阻碍组氨酸标签的亲和纯化。但 GST 标签则与之不同。由于 GST 对于其底物-谷胱甘肽具有极高的特异性,所以可以获得更高的纯度。
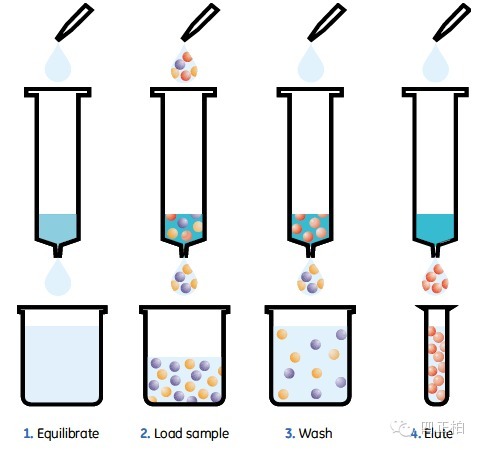
但是,在 GST 融合蛋白纯化中,经常会遇到一些问题。本专题对这些问题进行了汇总,指出了大多数纯化方法存在的普遍问题,对于特别的纯化方法的问题也有提,形成了 GST 融合蛋白纯化常见问题指南。
问题一: 目的蛋白与 Glutathione Sepharose 不结合或结合效率低
a. 可能原因:目的蛋白与磁珠不结合或结合效率低
解决办法:测序确认,调整阅读框以获得 GST.Tag 融合表达蛋白;使用蛋白酶缺陷型大肠杆菌作为表达宿主菌; 如果有稀有密码子应采用 Rosetta 系列宿主菌。
b. 可能原因:GST 融合蛋白被机械裂解的方法变性(比如超声)
解决办法:过度超声会破坏标签蛋白而减少其与磁珠的结合;在裂解过程中,用温和的机械/化学裂解条件,裂解的条件必须依照经验来决定。
c. 可能原因:GST 融合蛋白在样品中有聚集,导致沉淀.
解决办法:在细胞裂解前加入 DTT,在缓冲液中也加入 DTT。1-20 mM DTT 会显著增加某些 GST 融合蛋白的结合。
d. 可能原因:GST 融合蛋白的浓度过低
解决办法: 浓缩样品。结合能力具有浓度依赖性。低表达量的蛋白可能不会像高表达量蛋白那样有效地结合 Glutathione Sepharose。因此,浓缩样品可提高结合。
e. 可能原因:标签蛋白可能改变 GST 的构象,因此降低了 GST 标签蛋白的结合能力
解决办法:检测所使用的 pGEX 载体中 GST 的结合。准备带有所使用的 pGEX 的细胞超声裂解物,检测其与 Glutathione Sepharose 的结合,如果结合的很好,则可能是标签蛋白改变了 GST 的构象,因此降低了 GST 标签蛋白的亲和力。可以通过降低结合温度到 4oC 限制洗涤来改善结果。
f. 可能原因:结合条件不佳。
解决办法:低于 pH6.5 或高于 pH8.0 时,融合蛋白与 Glutathione Sepharose 结合不充分导致结合率低,请确认 Glutathione Sepharose 在用于目的蛋白纯化前经过 pH6.5-8.0 缓冲液充分平衡。
g. 可能原因: Glutathione Sepharose 使用次数过多
解决办法:如果已使用几次,应考虑再生或更换新的 Glutathione Sepharose
问题二. 目的蛋白不能洗脱或洗脱效率低
a. 可能原因:洗脱缓冲液的体积太少。
解决办法: 增加洗脱缓冲液的体积。
b. 可能原因:洗脱的时间不够
解决办法:增加洗脱缓冲液中 Glutathione Sepharose 反应的时间。
c. 可能原因: 洗脱缓冲液中谷胱甘肽 (GSH) 浓度太低。
解决办法: 增加洗脱缓冲液中 GSH 的浓度:常规方案中建议 10 mM GSH 对于大多数应用来说足够了,但是也存在例外。尝试使用 50 mM Tris-HCl,20-40 mM GSH, pH8.0 作为洗脱缓冲液。
d. 可能原因: 洗脱缓冲液的 pH 过低。
解决办法: 增加洗脱缓冲液的 pH 值:将 pH 增加到 8-9,会增强洗脱而不用提高洗脱所用 GSH 的浓度。
e. 可能原因: 洗脱缓冲液离子强度过低。
解决办法:增加洗脱缓冲液中的离子强度,在洗脱缓冲液中加入 0.1-0.2M 的氯化钠也会改善洗脱效果。
f. 可能原因:洗脱缓冲液中的 GSH 被氧化了。
解决办法:使用新鲜配制的洗脱缓冲液。
问题三: 洗脱的蛋白中有杂带
a. 可能原因: GST 融合蛋白被蛋白酶部分降解。
解决办法: 加入蛋白酶抑制剂。出现多条带可能是由于目的蛋白被蛋白酶部分降解的结果。可在裂解溶液中加入 1 mM PMSF 防止目的蛋白降解。丝氨酸蛋白酶抑制剂必须在使用凝血酶或凝血因子 Xa 前除去。
b. 可能原因: 在宿主细菌中的蛋白降解。
解决办法: 多带可能是在宿主细菌中蛋白酶切造成的。如果是这种情况,需要使用蛋白酶缺陷型菌株(比如 Ion-或 ompT),大肠杆菌 BL21 随 pGEX 载体提供,这种菌株是 ompT 和 Ion 缺陷型菌株。
c. 可能原因: 细胞破碎时超声处理过度。
解决办法: 多余的条带可能由于共纯化一些分子伴侣所造成。这些分子伴侣参与大肠杆菌新生成的蛋白的正确折叠。如:DnaK(分子量 70,000)、 DnaJ(分子量 37,000) GrpE(分子量 40,000) GroEL(分子量 57,000) GroES(分子量 10,000)。一些从这些共纯化的的蛋白中分离 GST 融合蛋白的方法已经发表。
问题四:目的蛋白酶切后电泳检测发现多条条带。
a. 可能原因:蛋白酶切发生在宿主细菌内
解决办法:检测条带何时出现:如果确定多余的条带在 Precission Protease,凝血酶,凝血因子 Xa 切割前不存在,这些条带可能是在宿主细菌中被降解的结果。目的蛋白可能含有 Precission Protease,凝血酶,凝血因子 Xa 的切割位点,请检查序列。
- 大肠杆菌高效表达外源蛋白的策略
大肠杆菌表达系统是发展最早、目前最为成熟的表达系统。因其遗传背景清楚、繁殖快、成本低、表达量高、表达产物容易纯化、稳定性好、抗污染能力强以及适用范围广等,是...
- His 融合蛋白纯化常见问题解答
蛋白过镍柱纯化的原理:Ni-NTA 纯化介质纯化带有 His6-Tag 的融合蛋白是目前蛋白纯化中最常使用的一种方法。Ni 柱中的氯化镍或者硫酸镍可以与有 HIs(组蛋白)...
- GST 融合蛋白纯化常见问题指南
谷胱甘肽 S 转移酶(GST)是一个含有 211 个氨基酸的蛋白,通常将该蛋白加入到重组蛋白的末端以便对该重组蛋白进行纯化或检测。具有组氨酸的非融合蛋白会产生非特...
- DNA 甲基化修饰
DNA 甲基化修饰作为一种重要的表观遗传修饰,能通过影响染色质结构、DNA 构想、稳定性以及蛋白质相互作用方式等,起到调控基因表达的作用。与多种肿瘤的发生、发展密...
- 组织分离优化指南
尽管对于特定细胞种类的细胞分离步骤的优化,与细胞恢复的各种所需特性有关,但仍可以建立通用的优化指南。结合合理的实验设计方案,以下就细胞分离和酶的使用提出优化...
- 如何 30 秒完成抗体标记?
英国生物偶联技术专家级公司 InnovaBiosciences 为您提供一步法快速标记试剂盒!Perfect!Innova Biosciences 成立于 2002 年,是世界领先的生物偶联技术公司。...
- 昆虫杆状病毒表达系统
昆虫杆状病毒表达系统 (baculovirus expression vector system, BEVS) 以昆虫杆状病毒为外源基因载体, 昆虫和昆虫细胞为受体的表达系统。昆虫细胞与哺乳动...







