流式细胞多色分选中的最大错误
多色分选是一个很复杂的过程,有很多相同的科学失误。
失败的多色分选会导致数据错误和结果无效。换句话说,成功的多色分选,可以得到很好的数据和得出强有力的结论。
成功的多色细胞分选需要很好的实验设计。给自己的实验设置特殊的策略可以为复杂的过程设计流水线式的合理系统。例如,多色分选实验中的重要步骤和方案可以节省时间和更好的阐释你的实验结果。
当设置多色实验时,最常见的错误是未能正确设置 PMT 电压,未能使用活性染料,无法正确识别粘连细胞,以及无法正确设定分选的区域和正确设门。所有流式实验都需要避免这四个错误,尤其是流式细胞分选实验。
接下来四个错误需要在分选前的设置前期避免,为了尽可能得到更好的细胞分选结果,这个设置需要被包含在设计、优化、预实验的过程中。
以下是需要注意的 4 个多色细胞分选常见错误:
1. 不能正确地设置 PMT 电压
在设置多色实验时,最关键的步骤是正确设置 PMT 电压。
实验设置的这一部分,与大多数的流式一样,需要最大信噪比。
因此,需要用未染色的空白组来设置电压调节阴性对照的峰到 log 象限的 101 的位置,不过往往不是这样的,电压调节的目的是每个通道取得最大的灵敏度。
记住在每一个单独的电压设置下 PMTs 不能最大化地展现(尽可能地把光源转为电源)。此外,为了确保检测器在峰呈现时工作,样品中必须含阳性和阴性的细胞群。
空白组只能观测到阴性细胞群,因此,不能确定染色的细胞群比未染的细胞群荧光信号好多少。
总而言之,如果电压设得太低,会导致干扰光信号产生和检测到干扰信号。
当在某个通道检测到待测细胞有自发荧光(如光谱的绿色区域),通过空白对照来设置电压,可能导致 PMT 电压太低。 相反地,红光通道中用空白对照设置电压,其中细胞自发荧光非常少,可能导致电压设置得过高,一旦需要所有荧光被检测,可能导致阳性细胞群超出了检测范围。
如果使用 BD 仪器用 FACSDiva 软件 (e.g. FACSAria, LSR II, LSR Fortessa) 通过 CS&T 质控微球系统会有助于检测电压的最小基线,或是在最小电压下检测器可以操作,优秀的文献提供了更广泛和更深入的方法达到相同的目的。
总的来说,有些有用的经验法则能帮助你选择最优的方法合理设置 PMT 电压。
首先,电压的设置要考虑所有的染色群都能被检测到,无论是从可视化角度还是从测量的角度看都是至关重要的(没有人喜欢看着染色超过检测范围)。 荧光强的部分可能不在检测器的线性范围内和可能不利于荧光检测。 这样只能通过跑一个有明确阳性细胞群的样本来完成。
通过补偿磁珠来设定电压要引起注意,染色可能非常亮,这可能导致将电压降低。检查后确保染色没有超出范围,调整电压,通常通过增加电压,把阳性和阴性细胞群最大化地区分开。
流式细胞术中的一个常见习惯是倾向于特意把补偿矩阵的百分比调至最小,以此来调整 PMT 设置。 记住,设置电压的主要目标是确保阳性和阴性之间的分群更明显。
重叠百分比不是对分离是否最大化的特别好的指示。
只要电压的设置能保证没有细胞群超出检测范围,检测器在线性范围中操作,并且阳性和阴性可以很好地分开,假设补偿被正确设置,不用担心补偿百分比。数据本身就可以证明。
始终确保每个对照组的 PMT 电压相同。 如果在所有通道中电压无法在对照组之间保持一致,那么补偿就不能被正确的计算。
2. 没有正确使用活性染料
抗体趋向于与死细胞结合,会导致结果出现假阳性,很难得到比较好的纯度,对细胞分选来说这可能是毁灭性的,特别是当细胞将用于下游分子应用时。 此外,在以细胞为基础的检测实验中,包含了碎片的假阳性死细胞也无法生长,它们的存在可能影响其他细胞的生长进程。
有很多不错的细胞活性染料可供选择,它们基于有两种不同机制的:与 DNA 结合染料和胺反应性染料。
DNA 结合染料,如碘化丙锭(PI),DAPI 和 7-AAD,是典型的不能通过完整细胞膜的具有较强 DNA 亲和力的带正电荷分子。 因此,它们只染死亡或细胞膜受损的将要死亡的细胞。这些染料是很好的选择,因为染色非常快,因此染料可以在分选之前才加入,而且不需要单独的染色步骤。
因为染色剂过量的存在于缓冲液中,DNA 结合染料提供了细胞死亡的「实时」指示; 所以在分选期间死亡的细胞将允许染料进入细胞核并且将开始发荧光。
虽然不是分选经常要注意的,但是这些染料不能与固定的细胞一起使用,因为染料-DNA 结合是非共价和平衡驱动的。
如果细胞在染色后固定,则在固定之前死亡的细胞中从 DNA 解离的染料可能对在固定之前存活的细胞的 DNA 染色,因为固定会破坏细胞膜完整性。 而胺反应性染料(通常称为「可固色」染料?)与细胞上和细胞中的游离胺共价结合。 用这些类型的染料染色必须在独立的染色步骤中进行。
染料将进入并染死亡或膜受损的细胞,因此死细胞的染色强度将远高于活细胞的染色强度,这样允许染料仅与细胞表面上的那些胺结合。 染色后,如果需要,可以固定细胞,因为染料 - 胺键是共价的而不是平衡驱动的,因此在固定后染色完整性能被保证。
通常,鉴于其易于使用和「实时」性质,在细胞分选实验上,DNA 结合染料优于胺活性染料,因此在设计配色时可用的选择很多。
试剂生产商已经设计了许多不同的 DNA 结合活性,所以不难找到一个适合你的配色。由 ThermoFisher 生产的 SYTOXⓇ染料,是一个不错的选择。
比较好的是可以将活性染料与 dump channel 结合或与用于选出一个或多个阳性标志细胞的通道组合,例如从分析中除去「lineage-negative」细胞。 由于 dump channe 和活力染料通道都用于选出被染色的细胞,因此两者可以组合成一个通道,这可以节省出另一个通道用于另一个标记。
3. 没有区分双粘连体和单细胞
当两个细胞通过检测点很近,仪器将它们作为一个事件处理出现双粘连体。
双粘连体的脉冲看起来像下图中所示的脉冲。
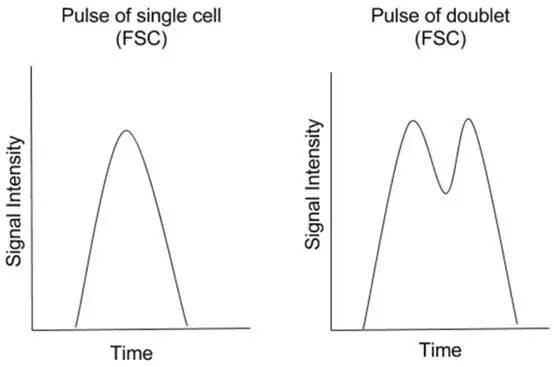
双粘连体的脉冲高度通常与单个粒子脉冲高度相等。
然而,因为双粘连体的脉冲基本上是两个单粒子脉冲的合并,所以这样的脉冲面积和宽度将大于单个粒子脉冲的面积和宽度。我们可以利用单个粒子和双粘连体信号的脉冲参数之间的差异来将两者彼此区分开。
通常,做面积和高度,高度和宽度,面积和宽度的散点图,所有细胞必须在所选参数中具有可测量的信号,因此通常使用前向散射或侧向散射。
此外,双粘连体可以包括两个双重鉴别门,一个利用 FSC,另一个利用 SSC,辨识双粘连体。虽然双粘连体鉴别对于任何种类的流式细胞实验都非常重要,但它对于细胞分选是尤为关键。
不能从单细胞中区分双粘连体会严重影响多色细胞分选的纯度。
双粘连体可能包括满足分选逻辑的一个细胞和不满足分选逻辑的另一个细胞。因为分选仪已经将这两种细胞都鉴定为一个事件,所以整个事件(靶细胞和非靶细胞)将被分选,导致收集的结果中同时含靶细胞和非靶细胞 。
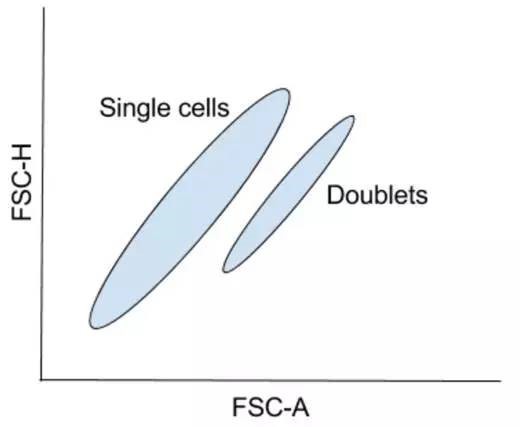
双粘连体的存在不一定表示分选流式细胞仪的性能差。
双粘连体在流式细胞实验中是正常的和符合预期的,并且其频率由细胞如何分散到液流中决定。悬浮液浓度过高和带黏性的细胞类型肯定会影响分散,因此如果观察到双粘连体,不要惊讶。最重要的是发现并消除它们。
4. 未能设置正确的分选区域和正确设门
设置正确的分选区域和门对于细胞分选是特别重要的,为了得到比较好的实验结果,在分选操作开始之前,所有设置必须是完美的。基于通过 FMO 对照确定的阳性边界来设门,以确保只有真阳性细胞被分选。
请记住,流式细胞术中的细胞群特性是具有固有变化或宽度的。
细胞群的宽度主要是结合(免疫荧光)或由(荧光蛋白)细胞表达的荧光团的数目以及测量变化的函数。通过细胞仪 1000 次的单个理论细胞的荧光将每次不同地检测,将产生其自身的「细胞群」。
这种情况的程度取决于许多因素,包括激光功率,仪器的收集效率和检测波长。细胞群在对数上荧光强度越低,相同的方式揭示的错误就越多,这种错误由补偿导致的溢出扩散所显示。
在对数上的较低十进制比较高的十进制包含更少的荧光强度值,因此具有相同方差的分布将在对数标度的第二个十进制看起来比在第三个十进制更宽。
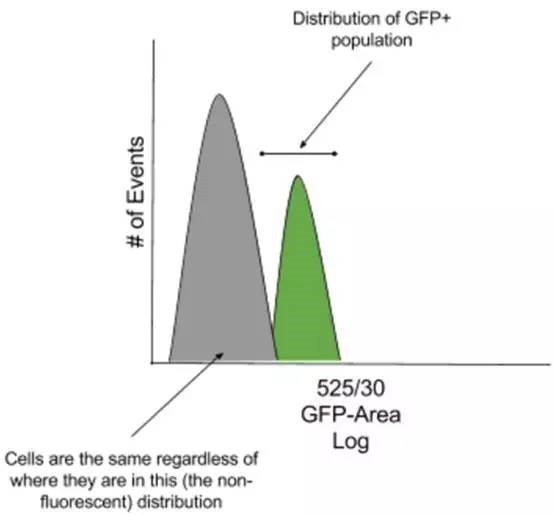
在上述例子中,GFP +群体非常接近 GFP-群体并且两个群体重叠。
因此,在这种情况下最关键的是,定位一个区域可以将 GFP+群体离 GFP -足够远,以确保没有 GFP-细胞落入 GFP +区域导致检测结果不精确。此外,阴性组的分布是无论如何都不带荧光信号的,并且细胞落在该分布中没有意义。
在大多数情况下,假设阴性组中所有细胞的自发荧光是相同的,分布左侧的阴性细胞与分布右侧的细胞没有区别。因此,如果分选区域包含非荧光群体的特定部分,则不要期望得到比较「纯」的细胞群。
当通过仪器返回纯度检查时,整个负分布将被重新填充,因为未染色细胞与它们在标尺上出现的位置之间完全没有差异。
提示下,通常二维点图比在直方图更易区分低表达的 GFP 信号与背景,如下所示:
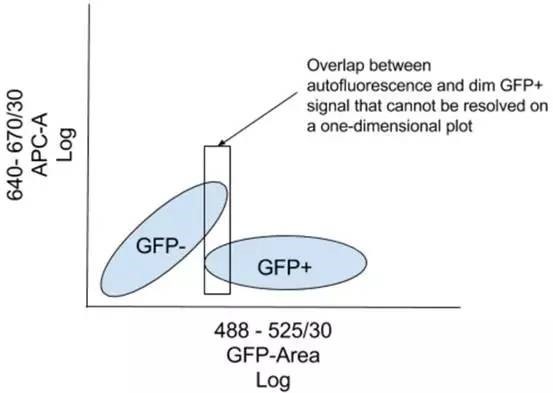
通过画 GFP 或与其相关的任何其他信号图,在图上另一参数未在实验中用到。如上所述,可根据细胞在两个通道分布将低表达细胞与不表达而又带自发荧光的细胞分开。
下图,摘自 Arnold 和 Lannigan 的论文,清楚地强调了当信号弱时,适当地设置分选门的重要性。如果不这样,不表达的细胞会进入分选区域,从而严重影响纯度。
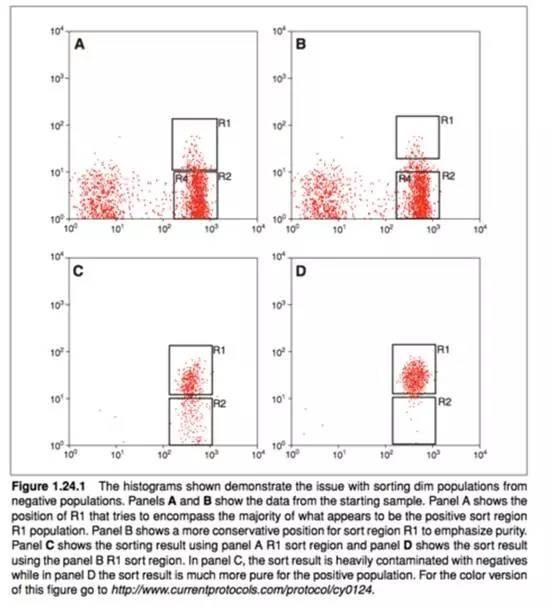
上图是 Arnold 等人在 Current Protocols in Cytometry 上发表的论文。这里,图 A 和 C 显示了当分选门 R1 离阴性群体(R2)太近时的效果。因为这个门占阴性分布区域,所以它不能把不表达的细胞从表达的细胞里区分出来。使用这个门的纯度很差。
当分选门更加适当时,纯度会更高。
当对低表达细胞设门时,请记住这一点。它关系到能否成功分选。
多色流式细胞术分选实验虽然有时具有挑战性,但并非不可逾越。当设置多色实验时,首要的关键步骤是正确设置 PMT 电压。此外,使用活性染料和辨别双粘连体和设置正确的分选区域和门对于任何种类的流式细胞术实验都很重要,特别是细胞分选。利用这些提示以及丰富的其他资源,以帮助优化多色染色,应该有助于认清设置和执行这类实验中一些更难的方面。
- 大肠杆菌高效表达外源蛋白的策略
大肠杆菌表达系统是发展最早、目前最为成熟的表达系统。因其遗传背景清楚、繁殖快、成本低、表达量高、表达产物容易纯化、稳定性好、抗污染能力强以及适用范围广等,是...
- His 融合蛋白纯化常见问题解答
蛋白过镍柱纯化的原理:Ni-NTA 纯化介质纯化带有 His6-Tag 的融合蛋白是目前蛋白纯化中最常使用的一种方法。Ni 柱中的氯化镍或者硫酸镍可以与有 HIs(组蛋白)...
- GST 融合蛋白纯化常见问题指南
谷胱甘肽 S 转移酶(GST)是一个含有 211 个氨基酸的蛋白,通常将该蛋白加入到重组蛋白的末端以便对该重组蛋白进行纯化或检测。具有组氨酸的非融合蛋白会产生非特...
- DNA 甲基化修饰
DNA 甲基化修饰作为一种重要的表观遗传修饰,能通过影响染色质结构、DNA 构想、稳定性以及蛋白质相互作用方式等,起到调控基因表达的作用。与多种肿瘤的发生、发展密...
- 组织分离优化指南
尽管对于特定细胞种类的细胞分离步骤的优化,与细胞恢复的各种所需特性有关,但仍可以建立通用的优化指南。结合合理的实验设计方案,以下就细胞分离和酶的使用提出优化...
- 如何 30 秒完成抗体标记?
英国生物偶联技术专家级公司 InnovaBiosciences 为您提供一步法快速标记试剂盒!Perfect!Innova Biosciences 成立于 2002 年,是世界领先的生物偶联技术公司。...
- 昆虫杆状病毒表达系统
昆虫杆状病毒表达系统 (baculovirus expression vector system, BEVS) 以昆虫杆状病毒为外源基因载体, 昆虫和昆虫细胞为受体的表达系统。昆虫细胞与哺乳动...







