Cell Mol Immunol. | 曾欣/林勇团队揭示肠道代谢物IPA缓解肝纤维化的机制
2025-09-22 14:40点击次数:415
关键词:AAV-CremRNAAAV9AAV8-TBG-CreAdipoq-Cre尾静脉注射AAV肝脏肝纤维化是肝硬化的前期病理阶段,肝硬化是全球范围内导致肝脏相关死亡的主要原因,占全球死亡人数的2.4%。近年来,越来越多研究表明巨噬细胞在肝纤维化发生发展中作用关键,调控巨噬细胞表型和生物学功能成为干预肝纤维化的潜在方向。
肠-肝轴作为连接胃肠道和肝脏的桥梁,介导肠道微生物群、代谢物与肝脏代谢、炎症及免疫间的双向交流。肠道来源代谢物对肝纤维化的影响逐渐成为研究热点。色氨酸是一种必需氨基酸,其代谢产物吲哚-3(IPA)由肠道微生物产生,在肠道和全身免疫中具有保护作用。然而IPA在肝纤维化中的作用存在争议,且肝硬化患者中IPA水平变化尚未得到充分研究,因此深入探究IPA在肝纤维化中的作用及机制具有重要意义。
2025年9月8日,上海市东方医院曾欣团队和上海长征医院林勇团队合作在Cellular & Molecular Immunology发表了题为“Gut-derived indole propionic acid alleviates liver fibrosis by targeting profibrogenic macrophages via the gut‒liver axis”的研究成果。该研究分析了肝硬化患者和肝纤维化小鼠的宏基因组特征及色氨酸代谢谱,并证实了IPA的抗纤维化作用。进一步研究表明,IPA靶向AhR/NF-κB/S100A8/A9和AhR/SPHK2/S1P双重信号通路,调控巨噬细胞表型与功能,进而抑制肝纤维化的发生与发展。这些发现具有转化价值,为开发靶向肠源性代谢物的抗纤维化策略提供了新方向。

研究核心结果
肠道来源的IPA在体内具有抗纤维化作用
该研究首先对14例临床样本进行宏基因测序,结果显示肝硬化患者肠道菌群多样性显著改变,色氨酸代谢通路紊乱,产生IPA的梭菌属丰度下降。针对色氨酸代谢的代谢组学分析结果表明,肝硬化患者粪便与血清中IPA水平均低于健康人群。此外,IPA水平与肝纤维化相关指标(如白蛋白-胆红素评分、纤维化指数评分)呈显著负相关,这为IPA与肝纤维化的关联提供了临床依据。在动物实验中,研究人员通过Cy7标记IPA,观察到IPA可经肠-肝轴转运至肝脏,且100 mg/kg剂量的IPA在CCl₄、硫代乙酰胺(TAA)和胆管结扎(BDL)三种肝纤维化模型中均展现出显著抗纤维化效果。此外,实验结果显示IPA能降低肝损伤指标、抑制胶原沉积,同时对心、脾、肺、肾无毒性,还可保护肠屏障功能,减少内毒素入血。
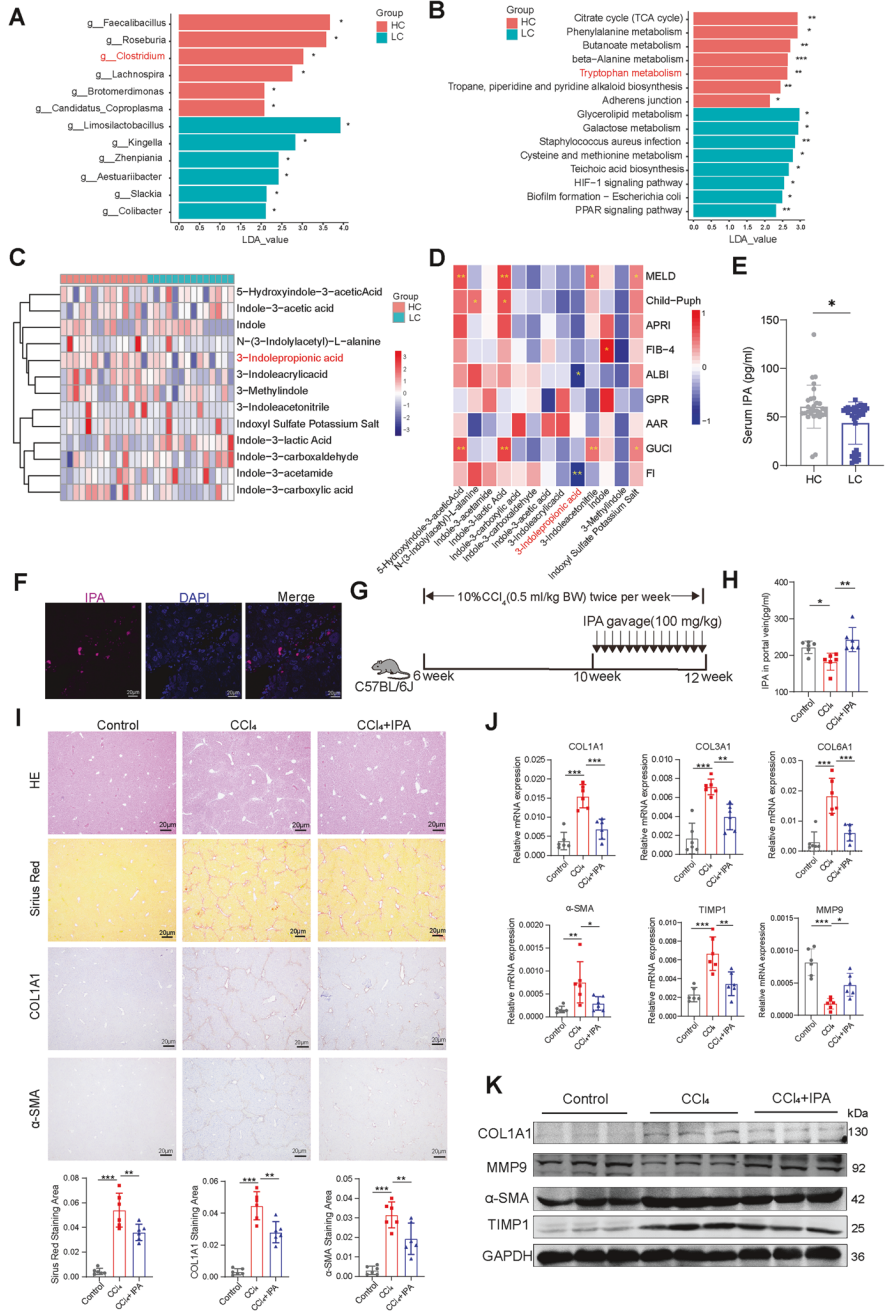
肠道来源的IPA在体内具有抗纤维化作用
IPA直接靶向肝脏巨噬细胞以发挥其抗纤维化作用
通过单细胞RNA测序(scRNA-seq)分析,研究在纤维化肝脏中识别出10类细胞群,发现IPA处理后单核/巨噬细胞群的比例和数量下降最为显著。进一步通过多重免疫组化(mIHC)和数字自适应光学扫描光场断层成像(DAOSLIMIT)观察到,IPA主要被肝脏中F4/80+巨噬细胞捕获,而非HNF4α+肝细胞或α-SMA+肝星状细胞(HSC)。体外实验证实,在THP-1巨噬细胞中,IPA能抑制NF-κB和Wnt/β-catenin通路,降低促纤维化和促炎细胞因子(TNFα, CCL2, TGFβ1)的表达。清除巨噬细胞后,IPA在体内的抗纤维化作用完全消失。此外,IPA可通过下调CCR2表达减少促纤维化巨噬细胞招募,CCR2基因敲除小鼠中IPA的抗纤维化效果也明显减弱,进一步证实巨噬细胞是IPA发挥作用的核心靶点。
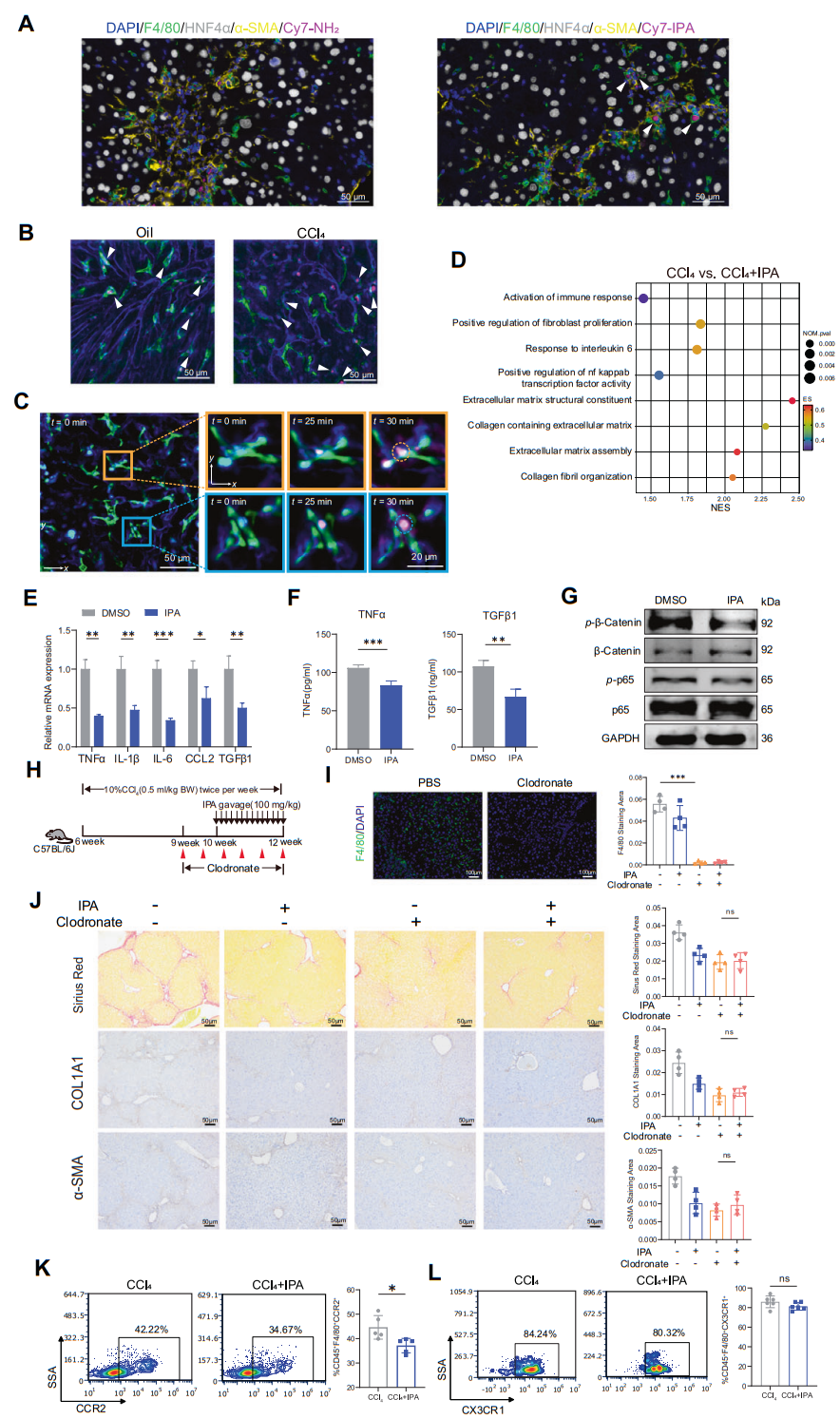
IPA主要靶向肝脏巨噬细胞发挥抗纤维化作用,而非直接作用于HSC或肝细胞
IPA通过AhR/NF-κB/S100A8/A9及AhR/SPHK2/S1P信号通路调控巨噬细胞功能
研究人员进一步深入挖掘了IPA作用于巨噬细胞后的分子机制。芳香烃受体(AhR)是IPA在巨噬细胞中的关键受体。当使用CRISPR/Cas9技术敲除THP-1细胞的AHR或使用AHR拮抗剂(CH223191)后,IPA对NF-κB通路和炎症因子的抑制作用被完全阻断,p-p65表达增加。在巨噬细胞特异性AHR敲除小鼠中,IPA的抗纤维化效果消失;而HSC或肝细胞特异性AhR敲除不影响IPA疗效。
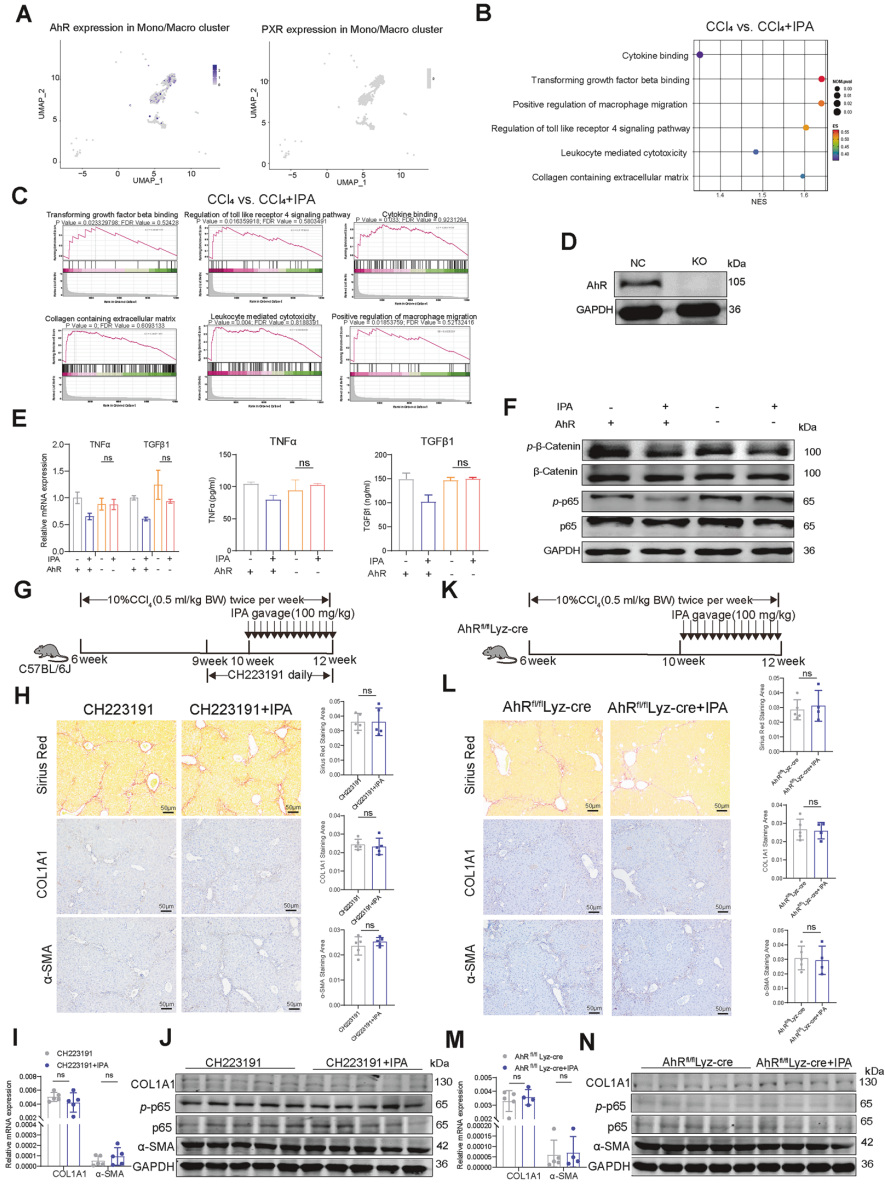
IPA通过调节AhR/NF-κB信号通路来抑制巨噬细胞的促纤维化功能
单细胞数据分析发现,IPA治疗后S100A8/A9+巨噬细胞亚群几乎消失;KEGG分析表明这群细胞高表达促炎和促纤维化基因。之前的实验结果表明,IPA结合AhR后可抑制NF-κB信号活性,减少p-p65表达;而S100A8和S100A9是NF-κB已知的转录调控因子,CUT&Tag和双荧光素酶报告实验证实p65可直接结合S100A8/A9启动子并促进其表达。因此IPA可通过AhR/NF-κB轴显著减少 S100A8/A9+巨噬细胞数量,抑制其促炎、促纤维化功能。同时,IPA还能通过AHR抑制鞘脂代谢中的关键酶SPHK2的转录,减少促纤维化介质S1P的生成,这为IPA调控巨噬细胞代谢和功能提供了另一条机制。在Transwell共培养体系和3D肝脏类器官模型中,IPA处理后的巨噬细胞可显著抑制HSC活化,减少胶原生成,且该效应在AhR敲除巨噬细胞中完全消失,证实IPA通过调控巨噬细胞间接抑制HSC功能。
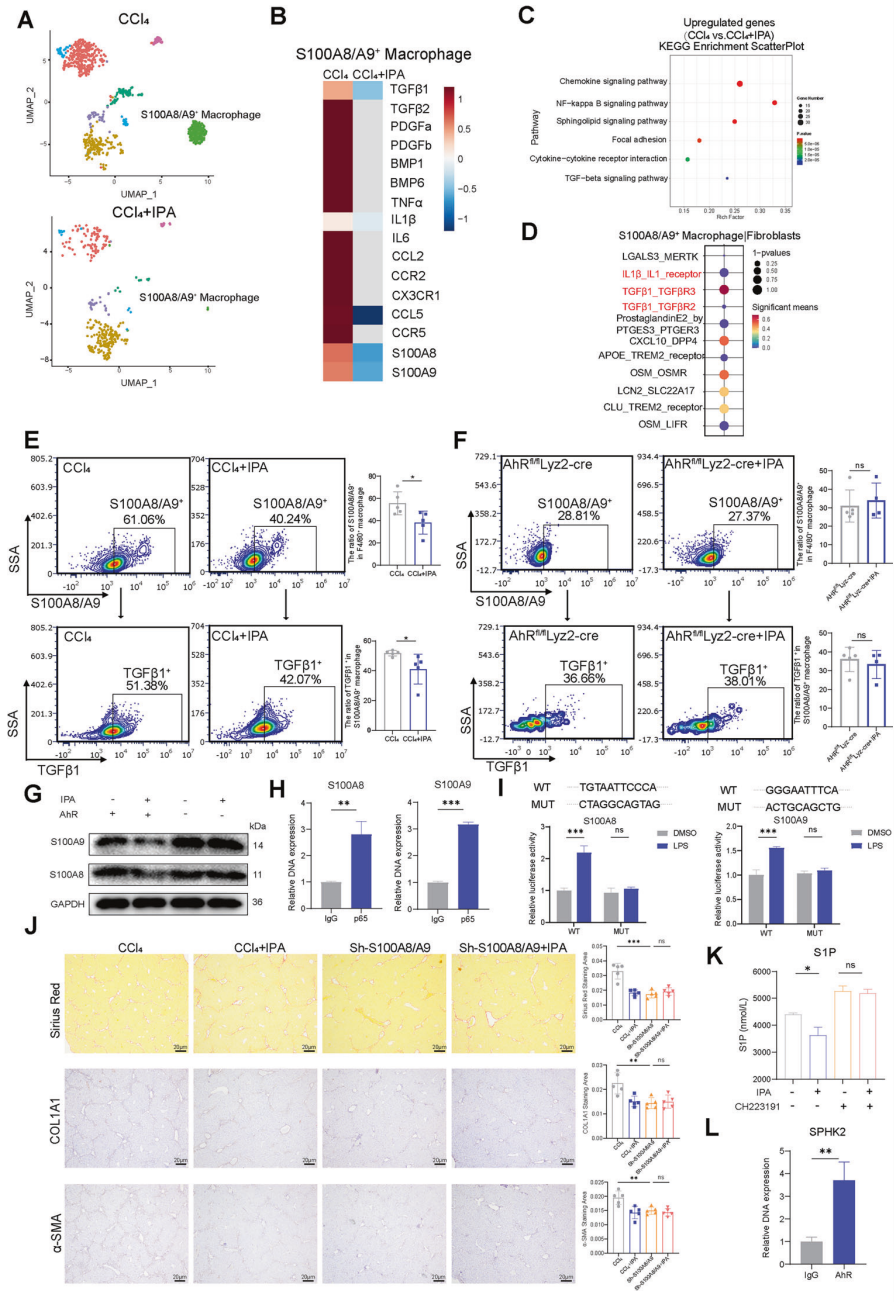
IPA通过AhR/NF-κB途径抑制S100A8/A9+巨噬细胞,并改变鞘脂代谢以抑制纤维生成
研究结论
本研究首次明确肠道来源的IPA在肝纤维化中发挥保护性作用,其核心机制是通过肠-肝轴靶向肝脏巨噬细胞,依赖AhR介导的两条关键通路——AhR/NF-κB/S100A8/A9信号轴和 AhR/SPHK2/S1P信号通路,抑制促纤维化巨噬细胞的招募、表型转化及功能,进而阻断巨噬细胞与HSC的促纤维化交叉对话,最终缓解肝纤维化。此外,IPA具有良好的口服生物利用度和安全性,且其水平与肝纤维化程度负相关,不仅为肝纤维化的临床诊断提供了潜在生物标志物,更有望成为靶向肠道代谢产物治疗肝纤维化的新型候选药物,为肝纤维化的临床管理开辟了新路径。
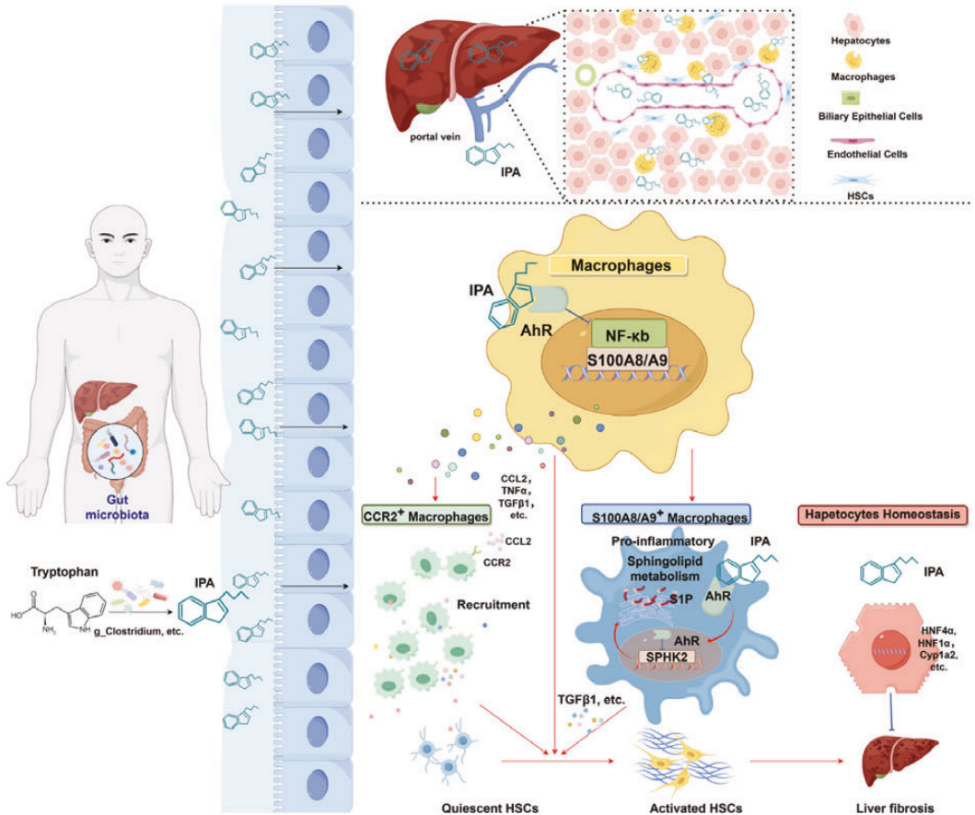
肠道来源的IPA抗纤维化作用机制的示意图
和元助力
和元生物有幸为研究者提供实验中使用的AAV载体,以实际行动助力代谢研究!
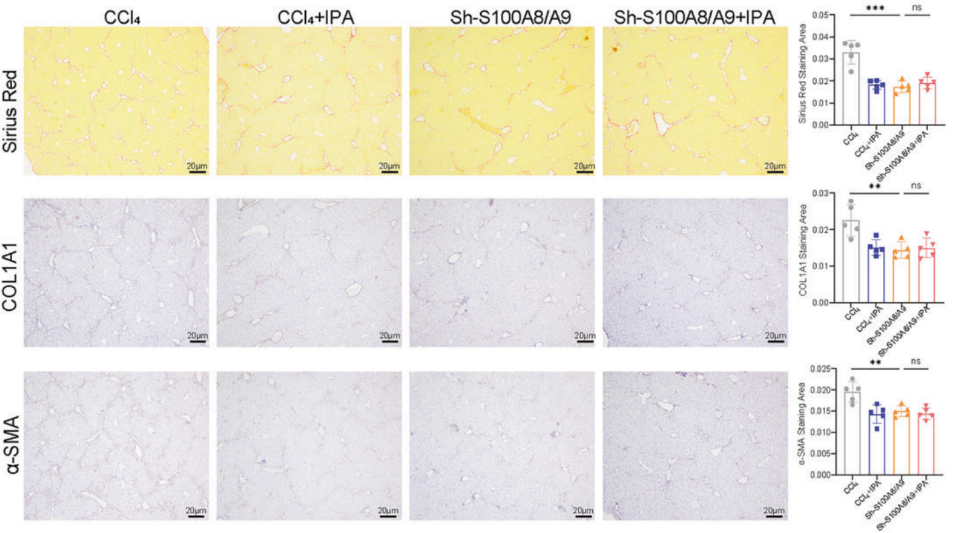
注射AAV8-Sh-S100A8/A9来减少S100A8/A9+巨噬细胞的数量削弱了IPA的抗纤维化作用

和元开学大促火热进行中!

业务咨询:15800353038



本周
本月
本年
LetPub发布最新SCI影响因子查询及期刊投稿分析系统
ELISpot试剂盒限时特惠!一口价低至500元,加赠免费读板服务
草甘膦(glyphosate)酶联免疫分析(ELISA)试剂盒使用说明书
应用gentleMACS™灌流技术从脂肪肝小鼠模型高效分离肝细胞与非实质细胞
单个细胞也能提取核酸?超全干货教你微量样本发高分(含完整电子版宝典资料))
链脲佐菌素 (Streptozotocin,STZ)-糖尿病动物模型造模
LetPub完整SCI影响因子、期刊分区查询系统
研究思路 | 多组学专题——如何进行转录组+蛋白组关联分析?
Elabscience® 从原料到标记,打造属于中国自己的流式抗体品牌
淋巴细胞百分比偏低原因解析
- 促销公告
- 更多 ›


